6,6'-二溴-1,1'-联-2-萘酚的偶联合成与手性拆分
——对一个有机化学综合实验的改进与发展
邸士睿,王帅,刘鑫,朱红平
厦门大学化学化工学院,化学国家级实验教学示范中心(厦门大学),福建 厦门 361005
1 引言
手性合成是当前有机化学研究中的热点和前沿领域之一,由于使用很少量的光学纯催化剂就可以产生大量所需的手性物质,并避免对映异构体的生成,因此符合绿色化学的要求。在各种手性合成方法中,不对称催化是获得光学物质最有效的手段之一。在众多手性催化剂中,以光学纯1,1'-联-2-萘酚(BINOL)及其衍生物为配体的金属络合物是应用最广泛和成功的一例。因此,(±)-BINOL及其衍生物的化学拆分在本科实验阶段具有重要的实践意义,其不仅有助于学生理解手性分子的空间结构和产生原因,也有助于学生加强对外消旋体拆分原理的认识。本实验采用了N-苄基氯化辛可尼丁作为拆分剂,其优势是拆分收率较高,并且拆分剂能够实现回收再利用[1],符合绿色化学的主旨。
然而,(±)-BINOL及其衍生物的化学拆分在本科实验室存在两个困难:一是(±)-BINOL及其衍生物不易获得,即使是外消旋体,其价格也较为昂贵,不适合大规模大用量的本科实验;二是传统的N-苄基氯化辛可尼丁的合成费时费力[2],并且产量较低。因此,本实验探索使用微波合成的方法:由简单易得的β-萘酚及其衍生物通过FeCl3作氧化剂微波偶联的方式,合成(±)-BINOL及其衍生物;微波合成N-苄基氯化辛可尼丁拆分剂。与传统的方法相比,微波合成法大大缩短了反应时间,而且减少了毒性有机溶剂的使用,符合绿色化学的主旨。
2 实验目的
(1) 了解氧化偶联合成的实验原理。
(2) 了解分子识别原理及其在手性拆分中的应用。
(3) 掌握实验中涉及到的基本操作。
(4) 制备光学纯(R)-(+)-6,6'-二溴-1,1'-联-2-萘酚和(S)-(−)-6,6'-二溴-1,1'-联-2-萘酚。
3 实验原理
BINOL及其衍生物在手性催化领域应用非常广泛[3],例如BINOL是制备2,2'-双二苯膦基-1,1'-联萘(BINAP)的前体[4],BINAP已经成为应用最为广泛的手性配体之一,不仅可以用于Rh、Ru等金属催化反应,同时还可以用于不对称羟基化、Heck反应、烯丙基的不对称异构化反应等。
BINOL的衍生物中典型的是6-位被取代的衍生物,通过对BINOL的6-位的修饰,可以合成很多具有特殊功能的分子,例如通过6-位基团取代将各种联萘酚络合物固定在支持物上[5],最简单的6-位单取代的BINOL的衍生物为6,6'-二溴-1,1'-联-2-萘酚(其结构如图1所示),是合成许多其他BINOL衍生物的前驱体。因此,本实验采用6,6'-二溴-1,1'-联-2-萘酚作为BINOL的代表衍生物,作为实验对象举例。
从BINOL的结构分析,由于8,8'-位氢的位阻作用,使得1,1'之间C―C键的旋转受阻,因而分子中两个萘环不是处于同一个平面上,而是存在一定的夹角,分子中没有对称面,在垂直于1,1'之间C―C键有一个C2对称轴,因此BINOL是具有C2对称性的手性分子,如图2所示。
由于BINOL及其衍生物的价格较为高昂,并不适合本科实验室大批量拆分,因此本实验也设计了BINOL及其衍生物的微波合成,采用FeCl3作为氧化剂,微波条件下偶联β-萘酚及其衍生物,两种可能的机理如图3所示。

图3 两种可能的偶联反应机理
拆分剂N-苄基氯化辛可尼丁的合成反应式如图4所示。

图4 N-苄基氯化辛可尼丁的合成反应式
外消旋化合物的拆分方法有很多种,最常用的一种化学拆分方法便是通过分子识别的方法选择性形成络合物。N-苄基氯化辛可尼丁是一种常用的BINOL拆分剂,其原理为:N-苄基氯化辛可尼丁与(R)-BINOL通过分子间氢键作用以及氯负离子与季铵正离子的静电作用结合,包括一个(R)-BINOL分子的羟基氢与氯负离子间以及临近的另一个(R)-BINOL分子的羟基氢与氯负离子间的氢键作用,氯负离子在两个(R)-BINOL分子间起桥梁作用,同时氯负离子与N-苄基辛可尼丁正离子的静电作用以及N-苄基辛可尼丁离子中羟基氢与(R)-BINOL分子中的一个羟基氧间的氢键作用使BINOL部分与N-苄基辛可尼丁离子部分结合起来。利用容易制备的N-苄基氯化辛可尼丁作为拆分剂,能够选择性地与(±)-BINOL中的(R)-对映异构体形成稳定的分子络合物晶体,而(S)-BINOL则被留在母液中,从而实现(±)-BINOL的光学拆分,如图5所示。

图5 N-苄基氯化辛可尼丁拆分机理
4 实验操作
由于β-萘酚及其衍生物6-溴-2-萘酚都是较为易得的化学品,因此,下面的实验方法将以6-溴-2-萘酚的微波偶联、拆分剂的合成、6,6'-二溴-1,1'-联-2-萘酚的化学拆分这三步实验为例,BINOL和其他衍生物的方法步骤与之同理,实验反应流程图如图6所示。
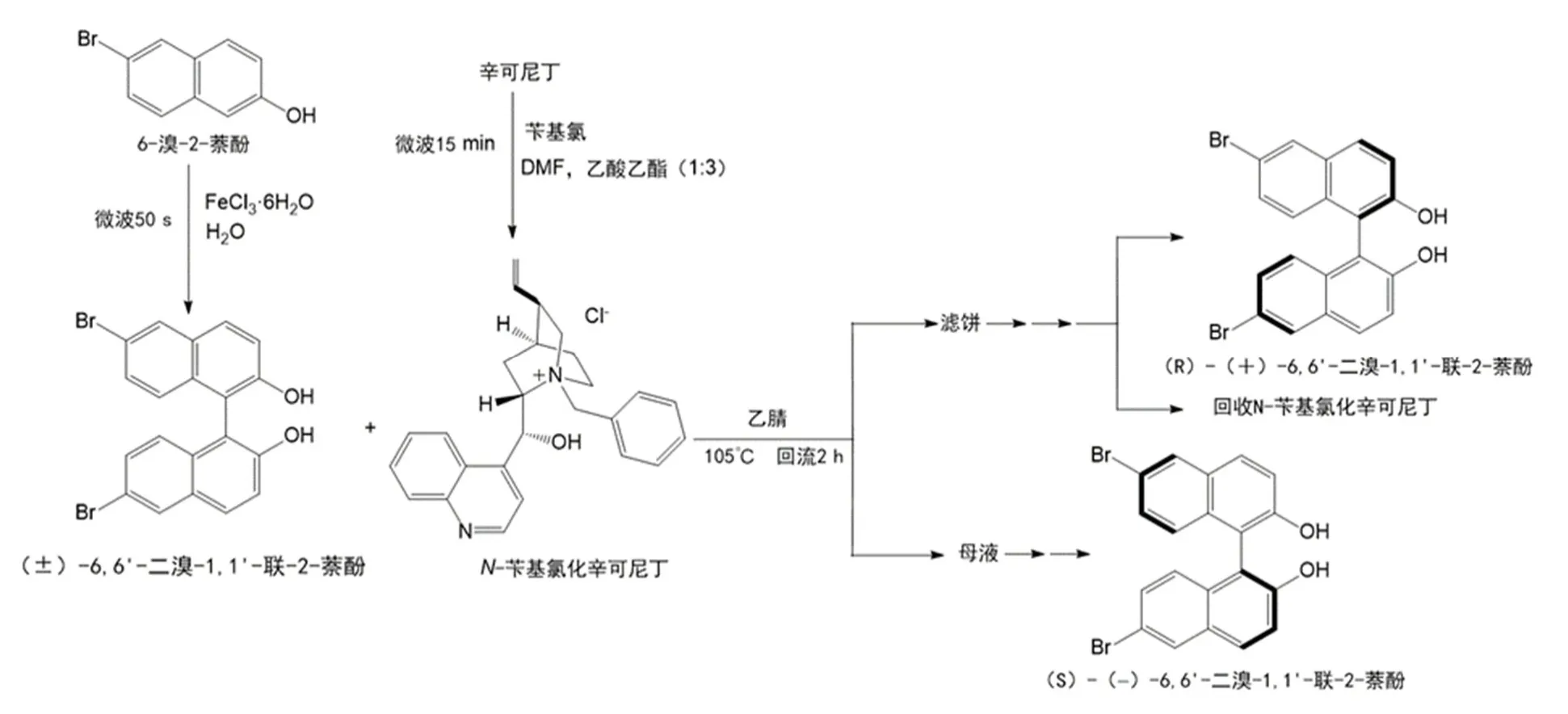
图6 反应流程图
4.1 6,6'-二溴-1,1'-联-2-萘酚的偶联合成[6–8]
在150 mL圆底烧瓶中依次加入1.75 g (7.8 mmol) 6-溴-2-萘酚、4.22 g (15.6 mmol) FeCl3·6H2O、85 mL水。将反应瓶放入微波炉中,装上搅拌回流装置。设置微波功率为495 W,在不断搅拌下,辐射50 s。冷却、抽滤。粗产物用15 mL无水乙醇加热回流至溶解,稍冷后加入约1.0 g活性炭加热煮沸约10 min进行脱色,热过滤入50 mL锥形瓶中,烧瓶和残渣用约2.5 mL热无水乙醇洗涤。合并的滤液置于热水浴上加热至沸腾,往其中逐渐加入水(约10 mL)至溶液变浑浊或出现少量晶体(回流状态下),然后让其自然冷却至结晶完全。抽滤,所得晶体用少量水洗涤,得6,6'-二溴-1,1'-联-2-萘酚晶体,得到产品1.55 g,产品为乳白色晶体,收率89%。
4.2 N-苄基氯化辛可尼丁的微波合成
在微波实验仪器内安装25 mL圆底烧瓶,瓶内加入0.73 g (2.5 mmol)辛可尼丁,0.40 g (3.2 mmol)氯化苄,3.5 mL DMF与10.5 mL乙酸乙酯混合溶剂。开动搅拌后,用235 W微波输出功率加热反应液15 min。反应完毕后,冷却至低温,过滤出粗产品,将过滤所得固体用乙酸乙酯洗涤,溶于22.5 mL 100 °C的沸水中重结晶,趁热过滤,滤液冷却至低温,析出无色晶体。干燥称量,得到产品0.88 g,产品为无色晶体,收率84%。制得的N-苄基氯化辛可尼丁可直接用于下一步拆分,可通过溶于沸水中重结晶以提升纯度。
4.3 6,6'-二溴-1,1'-联-2-萘酚的手性拆分[1,9,10]
在一装有回流冷凝管的50 mL圆底烧瓶中,加入1.55 g (3.5 mmol) (±)-6,6'-二溴-1,1'-联-2-萘酚和0.88 g (2.1 mmol)N-苄基氯化辛可尼丁以及20 mL乙腈。加热回流2–3 h,然后冷却至室温,过滤析出的固体用乙腈洗涤3次(3 × 5 mL)。固体是(R)-(+)-6,6'-二溴-1,1'-联-2-萘酚与N-苄基氯化辛可尼丁形成的1 : 1分子络合物。母液保留,用于回收(S)-(−)-6,6'-二溴-1,1'-联-2-萘酚。
将固体悬浮于由40 mL乙酸乙酯和稀盐酸水溶液(1 mol·L−130 mL + H2O 30 mL)组成的混合体系中,室温下搅拌30 min,直至固体消失。分出有机相,水相用10 mL乙酸乙酯再萃取1次,合并有机相,并用饱和食盐水洗涤,无水硫酸镁干燥,蒸去有机溶剂,残余物用约10 mL甲苯重结晶,得(R)-(+)-6,6'-二溴-1,1'-联-2-萘酚,得到产品0.62 g,产品为乳白色晶体,收率80%。
将母液蒸干,所得固体重新溶于40 mL乙酸乙酯中,并用10 mL 1 mol·L−1稀盐酸和10 mL饱和食盐水各洗涤1次,有机层用无水硫酸镁干燥。蒸去有机溶剂,残余物用约10 mL甲苯重结晶,得(S)-(−)-6,6'-二溴-1,1'-联-2-萘酚,得到产品0.58 g,产品为乳白色晶体,收率75%。
上述萃取后的盐酸层(水相)合并后用固体Na2CO3中和至无气泡放出,得到白色沉淀,过滤,固体用甲醇-水混合溶剂重结晶,得N-苄基氯化辛可尼丁,得到产品0.70 g,产品为无色晶体,收率80%。
5 结果与讨论
本实验着眼于联萘酚及其衍生物的化学拆分,在上面的实验操作中,我们以联萘酚常见的一类衍生物6,6'-二溴-1,1'-联-2-萘酚的化学拆分为例,详细介绍了三个实验模块。以下是对三个模块实验结果的详细讨论。
5.1 6,6'-二溴-1,1'-联-2-萘酚的偶联合成
本实验采用微波偶联的方式,在微波条件下反应50 s即可获得不错的收率。与传统方法相比,微波偶联的合成方法大大缩短了反应耗时,并且可以放大合成。由于微波反应耗时短,比较难以观察到反应现象,并且6,6'-二溴-1,1'-联-2-萘酚与6-溴-2-萘酚的性状相似,为了验证产物确为6,6'-二溴-1,1'-联-2-萘酚,对所得物质采用了核磁共振氢谱进行分析,确定偶联产物为6,6'-二溴-1,1'-联-2-萘酚。
5.2 N-苄基氯化辛可尼丁的微波合成
N-苄基氯化辛可尼丁的微波合成是我们本实验的亮点,由于传统的合成方法是将辛可尼丁、苄基氯、乙腈/丙酮溶剂[11]在105 °C下加热回流4 h[12],不仅耗时长,而且选用乙腈做溶剂,也不符合绿色和安全的原则。因此我们开发了DMF和乙酸乙酯[13]的混合溶剂(DMF : 乙酸乙酯 = 1 : 3),成功在微波反应15 min后析出了目标晶体,经过冷却抽滤,重结晶等步骤后,我们最终得到纯白色的晶体。对得到的白色晶体进行核磁共振氢谱分析后,确定合成产物为N-苄基氯化辛可尼丁。
以下是对两种合成方法的比较,如图7所示。

图7 两种合成方法的比较
传统的加热回流4 h的合成方式已被证明可以放大进行,并且收率高,因此更适合规模生产;相比之下,微波合成N-苄基氯化辛可尼丁的收率有所降低,但是考虑到微波合成将反应时间压缩到了15 min,从短时间内看显然微波合成的效率更高,从本科实验室的角度讲也有利于开展实验。
另外,本实验也对实验所用的溶剂进行了改良:由传统的乙腈溶剂/DMF溶剂更改为乙酸乙酯和DMF (3 : 1)混合溶剂,安全性更高且符合绿色化学的原则。
5.3 6,6'-二溴-1,1'-联-2-萘酚的手性拆分
不同的操作细节对最终拆分得到的(R)-(+)-6,6'-二溴-1,1'-联-2-萘酚和(S)-(−)-6,6'-二溴-1,1'-联-2-萘酚的收率的影响很大。例如,对于加热回流步骤,可以采用不同的方式来加热:置于电热套上加热回流或是置于磁力搅拌器上使用盐水浴加热搅拌回流。尽管在使用电热套加热时溶剂的不断汽化和液化也能起到一定的搅拌作用,但是其效果终归较弱,因此在回流2 h结束后冷却至室温,圆底烧瓶中可以明显观察到淡黄色的结块(如图8所示),淡黄色的结块即是由回流过程中不充分的混合所致,其成分为(R)-(+)-6,6'-二溴-1,1'-联-2-萘酚与N-苄基氯化辛可尼丁形成的1 : 1分子络合物,而结块中可能会包藏部分(S)-(−)-6,6'-二溴-1,1'-联-2-萘酚,因此会影响到最终的收率和拆分效果。

图8 置于电热套上加热回流所导致的分子络合物结块
相比之下,置于磁力搅拌器上使用盐水浴加热搅拌回流有两大优势:一是温度稳定可控,有利于(R)-(+)-6,6'-二溴-1,1'-联-2-萘酚与N-苄基氯化辛可尼丁形成1 : 1分子络合物;二是可以加入磁子搅拌防止结块,从而避免了包藏部分(S)-(−)-6,6'-二溴-1,1'-联-2-萘酚所导致的产物纯度下降。
由于本实验的目的是针对联萘酚及其衍生物进行化学拆分,因此相对于比较收率,比较拆分得到的R、S构型的产物的光学活性更加重要,这也对学生的操作水平提出了较高的要求[14]。通过对产物旋光度的测定,可以发现两种产物拥有显著的相反的旋光性,由此可以得知通过此法进行拆分的效果较好,适合用于有机化学综合实验的教学。
5.4 对实验可推广性的评价
“6,6'-二溴-1,1'-联-2-萘酚的偶联合成”和“N-苄基氯化辛可尼丁的微波合成”两个模块的实验操作较为简便,反应速度快,具有较高的可推广价值,亦可在开展单项实验的情况下由指导教师预先完成。N-苄基氯化辛可尼丁的回收可由指导教师统一进行,可以有效提高拆分剂的回收率。“6,6'-二溴-1,1'-联-2-萘酚的手性拆分”模块的实验耗时较长(如图9所示),因此可以根据高校自身的教学要求和实际情况部分或完整地开展本实验。

图9 实验时间分布
6 结语
本实验着眼于对手性联萘酚及其衍生物进行偶联合成与拆分纯化。使用微波合成的方法偶联合成6,6'-二溴-1,1'-联-2-萘酚,简便快捷并且有较高的收率。在合成拆分剂N-苄基氯化辛可尼丁时,采用了更适合教学的微波合成方法和更加绿色安全的溶剂,大大缩短了反应时间。对于6,6'-二溴-1,1'-联-2-萘酚的手性拆分,置于磁力搅拌器上使用盐水浴加热搅拌回流来进行,令其具有更高的收率和更好的拆分效果。本实验涉及的操作步骤较多,操作相对复杂,因此有助于高校教师综合考查学生的有机化学实验操作水平。

