头孢克肟胶囊溶出曲线一致性评价研究*
叶伟文,高琳,蔡国伟,赖烨才,秦飞
(广州白云山医药集团股份有限公司白云山制药总厂/广东省化学药原料与制剂关键技术研究重点实验室,广州 510515)
头孢克肟是首个第3代口服头孢菌素[1],为低溶解、低渗透药物[2],由藤泽制药株式会社研发,于1987年在日本上市,白云山制药总厂最早于1993年获得头孢克肟胶囊的全国首仿药品注册证书。溶出曲线研究可预测药物在体内的溶解情况,提高生物等效性(bioequivalence,BE)实验的成功率,已成为评价药品质量差异的重要手段[3-5]。
2020年版《中华人民共和国药典》[6]收载的头孢克肟胶囊溶出度测定方法为紫外-可见分光光度法,溶出液需要稀释后才能测定,而《医疗用医药品品质情报集》[7]推荐方法为高效液相色谱(high performance liquid chromatography,HPLC)法,但后者检测时间长,效率低,不利于高通量样品检测。核壳型色谱填料由实心硅胶核和外层多孔硅胶壳组成,该类型填料的色谱柱具有快速、高分辨率和低背压的特点,在药品领域的快速分析中已被广泛应用[8-10]。笔者在本实验优选核壳型色谱柱建立快速测定头孢克肟胶囊溶出度的HPLC法,考察头孢克肟胶囊在多种介质的溶出行为,并结合BE实验结果,以期为其一致性评价提供借鉴。
1 仪器与试药
1.1仪器 Thermo UltiMate 3000型高效液相色谱仪(美国Thermo公司,DAD检测器);FADT-1202RC型自动溶出度仪(上海富科思分析仪器有限公司);CPA225D电子天平(德国Sartorius公司,感量:0.01 mg);TDL-50B离心机(上海安亭科学仪器厂);E300H超声波清洗器(德国Elmassonic)。
1.2试药 头孢克肟胶囊仿制制剂(白云山制药总厂,规格:0.1 g,批号:02180401、02180501、02180502);头孢克肟胶囊参比制剂(长生堂制药株式会社,规格:0.1 g,批号:CB011);头孢克肟对照品(中国食品药品检定研究院,批号:130503-201706,含量:89.2%);甲醇(德国默克公司,批号:11736420346)、乙腈(德国默克公司,批号:10955330820)、三氟乙酸(美国天地有限公司,批号:I6110077)为色谱纯,水为纯化水,氯化钠(批号:20171105)、氢氧化钠(批号:20171002)、磷酸二氢钾(批号:20180102)、无水磷酸氢二钠(批号:20180104)、一水合柠檬酸(批号:20171205)、盐酸(批号:20180104)均为分析纯(广州化学试剂厂)。
2 方法与结果
2.1溶出方法与溶出介质的选择
2.1.1溶出方法 2020年版《中华人民共和国药典》[6]采用篮法,转速100 r·min-1,而《医疗用医药品品质情报集》[7]采用桨法,转速50 r·min-1,溶出介质均为900 mL。头孢克肟主要在肠道吸收[2],前期研究选择区分力较好的pH值6.8磷酸盐缓冲液(phosphate buffer solution,PBS)介质和溶出速度较快的pH值7.5 PBS介质进行对比,取头孢克肟胶囊分别采用篮法(100 r·min-1)和桨法(50 r·min-1)进行溶出实验,结果见图1。相比之下桨法(50 r·min-1)区分力更好,最终选择的溶出条件为:桨法,50 r·min-1,溶出介质900 mL。
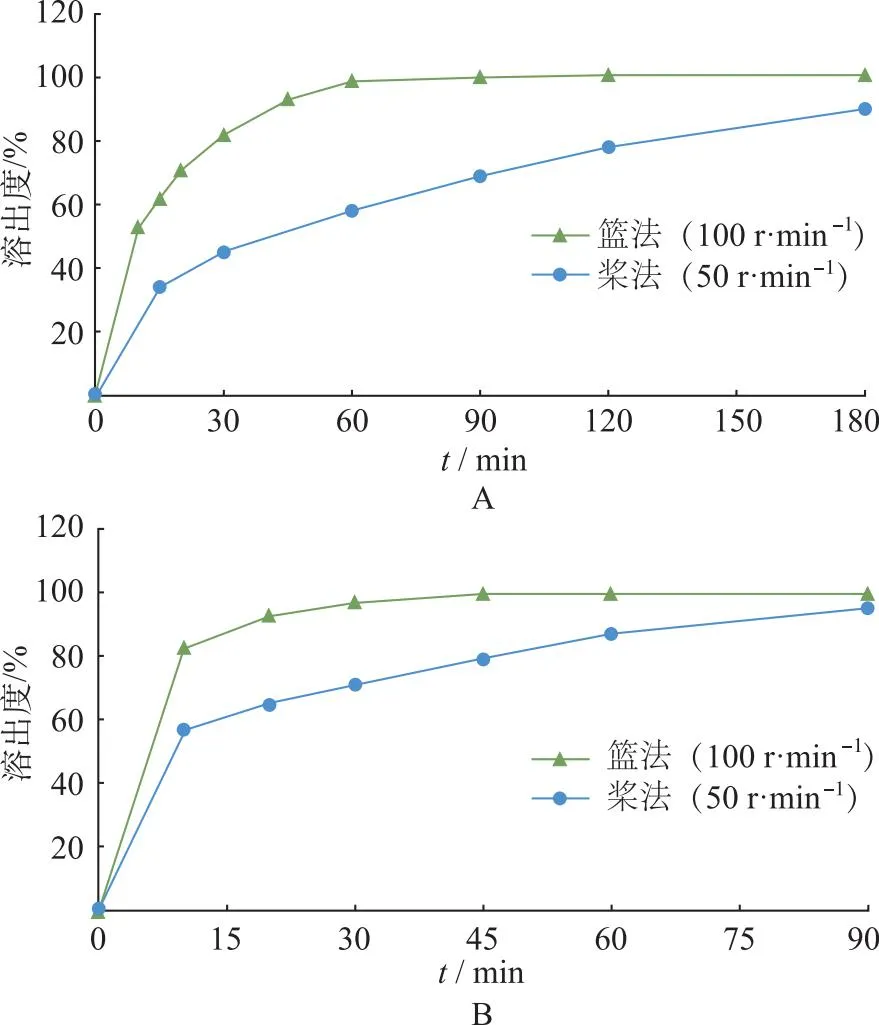
A.pH值6.8 PBS;B.pH值7.5 PBS。
2.1.2溶出介质 参考《医疗用医药品品质情报集》[7],选择pH值1.2盐酸、pH值6.8 PBS、pH值7.5PBS和水为溶出介质。
2.1.3取样时间 结合本品在各介质的溶出速度,pH值1.2盐酸、pH值6.8 PBS和水介质的取样时间点分别为5、15、30、60、90,120和180 min,pH值7.5 PBS介质的取样时间点为5、10、15、30、45、60和90 min。
2.2溶液的制备 ①空白辅料溶液:取空白辅料适量及一粒明胶空心胶囊,置100 mL量瓶中,分别加入相应溶出介质超声溶解并稀释定容,滤过,取续滤液。②对照品贮备液:精密称取头孢克肟对照品适量,置250 mL量瓶,加适量甲醇溶解,加水稀释至刻度,摇匀,制成1.115 8 mg·mL-1头孢克肟(以C16H15N5O7S2计)对照品贮备液。③对照品溶液:精密量取上述贮备液2 mL,置20 mL量瓶,分别加入相应溶出介质稀释定容,作为对照品溶液。④供试品溶液:取本品1粒,按“2.1.1节”溶出方法进行实验,于设定的时间点取溶出液适量,滤过,取续滤液。⑤系统适用性溶液:取头孢克肟对照品约23 mg,置20 mL量瓶,加水稀释定容,于95 ℃水浴45 min,冷却至室温后滤过,取续滤液[6]。
2.3分析方法的建立和验证
2.3.1HPLC色谱条件 以Thermo Accucore C18(50 mm×4.6 mm,2.6 μm)为色谱柱;以乙腈-0.8%三氟乙酸溶液(20:80)为流动相;检测波长254 nm;柱温45 ℃;流速1.2 mL·min-1;等度洗脱;进样量5 μL。《医疗用医药品品质情报集》[7]采用四丁基氢氧化铵溶液和乙腈为流动相,在常规C18色谱柱中头孢克肟出峰时间约为12 min,且该有机盐试剂对色谱柱填料的损耗较大。本研究优选核壳型C18色谱柱,流动相换作乙腈-三氟乙酸溶液,使头孢克肟出峰时间缩短至1 min内,极大地提升了检测效率。2种方法的典型色谱图见图2。

A.《医疗用医药品品质情报集》检测方法;B.本研究提出的检测方法;1.头孢克肟。

A.pH值1.2盐酸;B.pH值6.8 PBS;C.pH值7.5 PBS;D.水;a.空白辅料;b.对照品;c.供试品;1.头孢克肟。
2.3.2专属性实验 取空白辅料溶液、对照品溶液和供试品溶液,按“2.3.1节”色谱条件测定,色谱图见图
3,结果表明辅料均无干扰。
2.3.3系统适用性实验 取系统适用性溶液,按“2.3.1节”色谱条件测定,色谱图见图4,结果表明头孢克肟峰与杂质峰的分离度>1.5,本方法系统适用性良好。

1.头孢克肟;2.头孢克肟(E)异构体。
2.3.4线性关系考察 精密量取“2.2节”贮备液0.1、0.2、0.5、1、2、4、6 mL,分别置20 mL量瓶,用相应溶出介质稀释配制成不同浓度对照品溶液。按“2.3.1节”色谱条件测定,以峰面积(Y)为纵坐标、浓度(X)为横坐标进行线性回归,结果表明头孢克肟浓度在5.58~334.74 μg·mL-1范围内线性关系良好,见表1。

表1 头孢克肟的回归方程
2.3.5精密度实验 取对照品溶液(111.58 μg·mL-1)连续测定6次,记录峰面积,见表2,结果表明本方法精密度良好。

表2 精密度实验结果
2.3.6滤膜吸附实验 取本品1粒,加入pH值1.2盐酸900 mL,超声处理30 min,作为供试品溶液,同法制备另外3种介质的供试品溶液。取供试品溶液适量离心处理,取上清液;另取供试品溶液1.5 mL过孔径0.45 μm滤膜,弃去滤液一半后取续滤液。取上述2种溶液按“2.3.1节”色谱条件测定,记录峰面积,计算滤膜对头孢克肟的吸附率,公式如下:

结果显示,4种供试品溶液的吸附率分别为0.67%、0.49%、0.56%和0.44%,表明滤膜对头孢克肟无明显吸附作用。
2.3.7溶液稳定性实验 取“2.3.6节”4种供试品溶液,过滤后于室温放置0、2、4、6和8 h后,按“2.3.1节”色谱条件测定,结果4种供试品溶液的峰面积RSD分别为0.48%、0.18%、0.10%和0.26%,表明供试品溶液在室温8 h内稳定。
2.3.8重复性实验 取本品,按“2.2节”制备各介质的供试品溶液,于溶出终点取样,重复取样6次,按“2.3.1节”色谱条件测定,记录峰面积,见表3,结果表明本方法重复性良好。

表3 重复性实验结果
2.3.9回收率实验 分别精密量取“2.2节”贮备液0.5、1和2 mL,置20 mL量瓶,加入相当于1粒头孢克肟胶囊的空白辅料和胶囊壳,并用相应介质稀释配制成相当于标示量(111 μg·mL-1)25%、50%和100%的溶液,各介质每个浓度溶液平行制备3份,按“2.3.1节”色谱条件测定,见表4,结果表明本方法回收率良好。

表4 回收率实验结果
2.3.10耐用性实验 按“2.2节”方法制备pH值7.5 PBS介质的供试品溶液(90 min取样)和对照品溶液,以“2.3.1节”色谱条件为基础,按表5条件和参数进行调整,每个色谱条件进样测定3次,按外标法计算供试品溶液药物浓度的RSD,结果见表5,表明本方法耐用性良好。
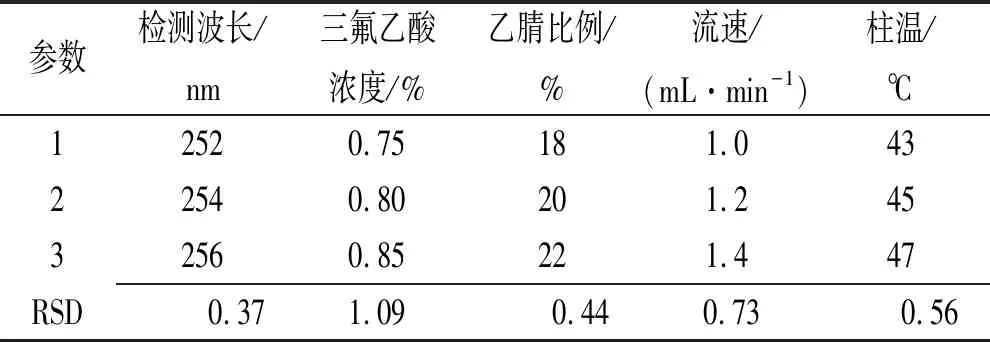
表5 耐用性考察结果
2.4溶出曲线测定和相似性评价 取本品参比制剂(批号:CB011)和仿制制剂3批(批号:02180401、02180501和02180502),按“2.1节”进行溶出度实验(n=12),于各时间点分别取溶出液1.5 mL,过滤后按“2.3.1节”色谱条件测定,以外标法计算各时间点的溶出度,结果见表6—9,溶出曲线见图5。参考《普通口服固体制剂溶出度实验技术指导原则》[11],采用相似因子(f2)法评价两制剂溶出曲线的相似性,计算公式如下:

表6 pH值1.2盐酸中的溶出实验结果

表7 pH值6.8 PBS中的溶出实验结果
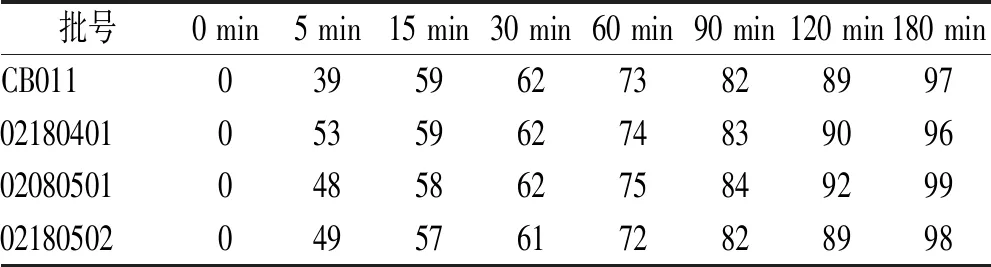
表8 pH值7.5 PBS中的溶出实验结果

表9 水中的溶出实验结果

A.pH值1.2盐酸;B.pH值6.8 PBS;C.pH值7.5 PBS;D.水。
式中Rt和Tt分别表示参比制剂与受试制剂在各取样时间点的溶出度,n为取样时间点个数,当f2≥50,可判断两制剂的溶出曲线相似。结果显示,3批仿制制剂与参比制剂在4种介质中的f2因子均>50,见表10,表明仿制制剂和参比制剂的溶出行为一致。
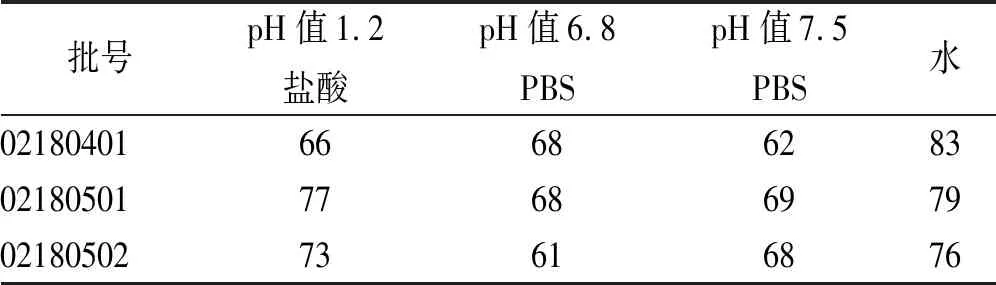
表10 头孢克肟胶囊在不同介质中的相似因子(f2)
2.5生物等效性实验 取头孢克肟胶囊仿制制剂(T,批号:02180401)和参比制剂(R,批号:CB011),采用单中心、随机、开放、单剂量、两制剂、两序列、两周期交叉给药实验设计方法(清洗期4 d)进行空腹和餐后人体生物等效性实验(空腹和餐后实验健康受试者各30例),受试者入选标准:年龄≥18岁的健康受试者;身体质量指数19.0~26.0 kg·m-2;男性体质量≥50.0 kg,女性体质量≥45.0 kg;无心血管、血液、肝、肾、内分泌、呼吸、消化、神经、精神、免疫、皮肤及代谢紊乱等疾病病史。空腹实验于给药前0 h(30 min内)和给药后1.0、2.0、3.0、3.33、3.67、4.0、4.33、4.67、5.0、5.5、6.0、8.0、10.0、12.0、14.0、24.0 h时间点采集静脉血,餐后实验于给药前0 h(30 min内)和给药后1.0、2.0、3.0、3.5、4.0、4.33、4.67、5.0、5.33、5.67、6.0、8.0、10.0、12.0、14.0、24.0 h时间点采集静脉血[12],检测各血样中头孢克肟的血药浓度[13],通过Phoenix WinNonlin 7.0版软件计算头孢克肟药动学参数[药-时曲线下面积(AUC0-t和AUC0-∞)],并用SAS9.4版统计软件对关键药动学参数达峰浓度(Cmax)、AUC0-t和AUC0-∞进行统计分析,评价两制剂生物等效性,结果见表11[14]。结果显示,仿制制剂和参比制剂空腹和餐后药动学参数几何均值比90%置信区间均在80%~125%,表明两制剂生物等效[15]。

表11 两种制剂的生物等效性评价结果
3 讨论
3.1检测方法的优化 2020年版《中华人民共和国药典》[6]收载的溶出度测定法为紫外-可见分光光度法,溶出液需要稀释后才能测定,且不同介质、不同时间的药物浓度跨度较大,难以统一稀释操作,不利于高通量样品检测。《医疗用医药品品质情报集》[7]的HPLC法可直接进样检测,但单个样品的检测时间约为15 min,且流动相对色谱柱填料的损耗较大,需频繁更换色谱柱。本研究优选核壳型C18色谱柱、以乙腈-三氟乙酸水溶液为流动相,建立了快速测定头孢克肟胶囊溶出度的HPLC法,既省去了繁琐操作,又减少了人为误差,单个样品的检测时间约为1 min,极大地缩短了检测时间、减少了有机溶剂和色谱柱的耗费,提高了检测效率,达到降本增效的目的,适合研发和生产中高通量样品的分析应用。
3.2溶出方法的选择 本研究参考《医疗用医药品品质情报集》[7]采用桨法(50 r·min-1),与2020年版《中华人民共和国药典》[6]的篮法(100 r·min-1)相比,更有区分力,能更好地反映制剂的内在质量差异。头孢克肟主要在小肠吸收[2],结合本研究在4种介质中的溶出情况,pH值6.8 PBS介质可模拟小肠环境,且区分力较好,在处方工艺开发过程可作为重点考察的关键介质。
3.3体内外相关性 溶出曲线研究是评价口服固体制剂内在质量差异,保证临床用药有效的一种重要手段。本实验3批仿制制剂在体外多种介质中与参比制剂的相似因子(f2)均>60,表明仿制制剂与参比制剂在各介质中的溶出行为一致,批间差异小,且仿制制剂和参比制剂在人体内空腹和餐后均为生物等效,表明本实验的溶出方法在一定程度上能预测药物在体内的溶解情况,可为头孢克肟胶囊的一致性评价提供借鉴。

