红山茶花、叶提取液在化妆品中的抗老功效研究
胡 昕,李广涛,高宏旗
(上海林清轩生物科技有限公司,上海 201400)
山茶属(CamelliaL.)是山茶科(Theaceae)中最大的属,包含20 组,共280 种,我国有238 种[1]。其中有一组为红山茶组(Sect.Camellia),全世界有57种,而我国拥有55种,其余2种在日本[2]。红山茶组植物不仅具有重要的经济、药用、观赏价值,在化妆品行业也具有一定的应用价值。目前,在化妆品行业,对油茶组[3-4]和茶组[5-6]的研究较多,但对红山茶组的研究并未很多。例如,爱茉莉公司研究了红山茶(Camellia japonicaL.)花的抗氧化能力[7],并考察了从山茶籽饼中提取的山奈酚三糖和四糖的抑制MMP-1 的作用[8],且进一步得到山奈酚四糖可以通过抑制PDK1(3-phosphoinositide-dependent kinase 1)减少细胞衰老,同时可促进胶原纤维的增加[9]。还有学者研究了红山茶叶中抗氧化物质的抗光老化作用[10]。红山茶花提取物还可以对城市空气污染物激活的皮肤老化机制具有保护作用[11]。
与化妆品最相关的人体器官为皮肤。从重量和范围的角度,皮肤是人体最大的器官,像传感器一样促使人体对外界变化做出反应[12]。随着年龄的增长,皮肤主要受到外源性因素(紫外线[13]、空气污染[14]、温度[15]等)和内源性因素(遗传或激素等)的影响,逐渐衰老,主要表现为皱纹的产生、色素的沉着或变得松垮等[16]。而与皱纹最相关的为皮肤真皮层的细胞外基质(Extracellular matrix,ECM),它可以赋予皮肤强度和弹性,假如ECM 的机械结构破坏,意味着皮肤不再具有充足的弹性和支撑,从外形上体现为皱纹产生、皮肤松弛、缺少紧致与弹性等[17]。在分子或细胞层面,过多的活性氧(Reactive oxygen species,ROS)会引发一系列细胞信号转导,进而产生更多的炎症因子以及基质金属蛋白酶(Matrix metalloproteinase,MMPs),从而导致ECM的降解[18-19]。因此,抗氧化成为大家较为关注的功效评价。除此之外,抗糖化也逐渐受到大家的青睐。糖基化是还原糖(如葡萄糖)与蛋白质、脂质或核酸之间的非酶促反应,其最终产物即晚期糖终末产物(Advanced glycation end products,AGEs)。一方面,AGEs 会导致色素沉着,主要体现为与蛋白质形成色素加合物[20]或影响黑色素的分泌量[21]。另一方面,AGEs会导致皮肤皱纹的出现,主要原因为:(1)AGEs 与ECM 中的蛋白质形成交联,降低结缔组织通透性,使皮肤组织硬度增加,皮肤弹性下降,导致皱纹产生[22];(2)AGEs会与晚期糖基化终产物受体结合,导致ROS大量产生,最终导致皮肤衰老[23]。因此抗氧化、抗糖化都可以进一步抗皱,进而达到抗老的效果。
近年来,红山茶越来越多应用在化妆品领域中,但是对红山茶的研究结果还不是很多。因此本文对红山茶花、叶提取液的抗老功效进行了多种体外功效测试分析,主要从抗皱、抗氧化和抗糖化的角度阐述了其抗老的功效,为其在化妆品的应用提供了一定的参考意义。
1 材料与方法
1.1 试剂与仪器
试剂:野生型 AB 品系斑马鱼(杭州环特生物科技股份有限公司)、人永生化角质形成细胞(北京颐唯实检测技术有限公司)、成纤维细胞(陕西博溪通用检测科技有限公司)、离体皮肤组织培养液(FSK4,陕西博溪通用检测科技有限公司)、MMP-1 ELISA 试剂盒(Abcam)、MMP-3 ELISA 试剂盒(Abcam)、稀释荧光探针DCFH-DA、SOD 试剂盒(S0103,上海碧云天生物技术有限公司)、PBS(武汉博士德生物工程有限公司)、多聚甲醛(中国医药集团有限公司)、甲基乙二醛(MGO,Sigma)、荧光染料(Takara)、氨基胍硫酸盐(AM,Sigma)、TGF-β1(Peprotech)
仪器:Accuri C6-流式细胞仪(Becton Dickinson)、CFX-96-荧光定量 PCR 仪(Bio-Rad)、UVA 照射仪(陕西博溪通用检测科技有限公司)、150i-CO2培养箱(Thermo Fisher)、SW-CJ-1F-超净工作台(苏州安泰空气技术有限公司)、BX53-正置显微镜(Olympus).
1.2 实验方法
1.2.1 红山茶花、叶提取液的制备
在室温下用30%的乙醇水溶液超声萃取干燥之后的红山茶花、叶(上海柒潭生物科技有限公司提供)(m红山茶花∶ m红山茶叶= 2 ∶ 1)30 min,料液比(重量)为1 ∶ 20,随后加热到60℃,震荡萃取2 h,然后将萃取液用AB-8 大孔树脂吸附,用70%乙醇溶液洗脱;之后真空浓缩,获得浓缩液;在浓缩液中加入水和1,3-丙二醇,使得总质量为山茶花、叶总质量的15倍,最终得到红山茶花、叶提取液。
1.2.2 抗皱能力检测
1.2.2.1 基于斑马鱼的抗皱功效测试
实验步骤为:(1)随机选取斑马鱼于6 孔板中,每孔30 尾。(2)水溶给予样品,同时设置正常对照组,每孔容量为3 mL,3次生物学重复。(3)28℃条件下避光孵育24 h。(4)提取各实验组斑马鱼总RNA,合成cDNA,利用q-PCR 检测β-actin 和col1a1b的基因表达。(5)用β-actin作为基因表达的内参,计算目的基因的RNA 相对表达量。计算方法如以下公式:
1.2.2.2 基于成纤维细胞的抗皱功效测试
基于成纤维细胞的MTT 法检测实验步骤为:(1)细胞接种:接种细胞至96孔板,培养箱(37℃、5%CO2)中孵育过夜。(2)分组及配液:设置空白组、阴性对照组、阳性对照组和样品组。其中,阴性对照组为30 J/cm2UVA辐照,阳性对照组为100 ng/mL -TGFB1溶液,样品组为红山茶花、叶提取液。按表1配制不同浓度的红山茶花、叶提取液。每个浓度梯度下设置3个重复孔。(3)给药:待 96 孔板中细胞铺板率达到 40% ~ 60%时进行给药。给药完成后放置在培养箱(37℃、5% CO2)中培养 24 h。(4)检测:细胞孵育培养24 h后,弃掉上清,加入MTT工作液(0.5 mg/mL),37℃避光孵育4 h,孵育结束后,弃掉上清,每孔加 150 µL DMSO,在 490 nm 处读取OD 值。(5)细胞相对活力计算:根据公式4计算。

表1 样品测试浓度表Tab. 1 Test concentrations of sample
基于成纤维细胞的MMP-1 和MMP-3 测试 实验步骤为:(1)细胞接种:接种成纤维细胞至 24 孔板,培养箱(37℃、5% CO2)中孵育过夜。(2)配液:按分组分别配制受试物工作液。(3)给药:待细胞铺板率达到 40% ~ 60%时,进行分组给药。给药完成后放置在培养箱(37℃、5% CO2)中培养 24 h。(4)UVA辐照:根据试验分组,对需要 UVA 照射的组别进行 30 J/cm2的 UVA 辐照,置于培养箱(37℃、5%CO2)中继续培养 24 h。(5)收样:培养 24 h 后,收集细胞培养上清液于离心管中,置于-80℃冰箱冷冻保存。(6)ELISA 检测:MMP-1、MMP-3 ELISA 试剂盒的操作说明书进行检测。
1.2.3 抗氧化能力检测
1.2.3.1 基于角质形成细胞的MTT法检测
实验步骤为:(1)细胞接种:接种密度接种细胞至96 孔板,培养箱(37℃、5% CO2)中孵育过夜。(2)分组及配液:实验设置空白组、溶剂对照组和样品组。按表2 配制不同浓度的红山茶花、叶提取液,每个浓度梯度下设置3 个重复孔。(3)给药:细胞培养24 h 后进行给药。给药完成后放置在培养箱(37℃、5% CO2)中培养。(4)检测:细胞孵育培养20 h 后,加入MTT 工作液(5 mg/mL),37℃避光孵育4 h,孵育结束后,每孔加100 μL 三联液,在培养箱(37℃、5% CO2)中孵育过夜。在570 nm,参考波长630 nm 条件下测吸光度。细胞相对活力计算请参考公式4。

表2 样品测试浓度表Tab. 2 Test concentrations of sample
1.2.3.2 基于角质形成细胞的ROS测定
实验步骤为:(1)种板:将细胞消化,计数,置于孔板内。(2)置于37℃培养箱培养24 h 后,使细胞贴壁,弃上清液,空白组每孔加入2 mL培养基,对照组和样品组每孔加入2 mL 0.003%的H2O2。(3)加完H2O26 h 后,吸出六孔板中的培养液,空白组、对照组每孔加入2 mL 培养基,样品组每孔加入2 mL 终浓度为1.875%的样品,继续培养18 h。(4)用培养基(无血清)稀释荧光探针DCFH-DA(2′,7′-Dichlorodihydrofluorescein diacetate,2′,7′-二氯二氢荧光素二乙酸酯),使终浓度为10 μmol/L;吸出上清液,每孔加入2 mL 终浓度为10 μmol/L 的DCFH-DA。(5)将六孔板置于37℃培养箱内孵育20 min。用无血清培养液洗涤3 次。(6)用荧光显微镜观察,然后用胰酶消化收集细胞24℃ 1000 r/min,离心5 min,调节细胞浓度,用流式细胞仪定量检测。
1.2.3.3 基于角质形成细胞的SOD测定
前3 个步骤见1.2.2.2 前3 个步骤,之后弃上清液,胰酶消化,24℃ 1000 r/min,离心5 min,调节细胞浓度,按照超氧化物歧化酶(Superoxide dismutase,SOD)试剂盒说明书操作,用流式细胞仪定量检测。
1.2.4 基于离体皮肤的抗糖化能力测试
本实验采用免疫组织化学(Immunohistochemistry,IHC)检测离体皮肤组织中表皮层和真皮层中AGEs 含量的变化,评价红山茶花、叶提取液的抗糖化作用。
实验步骤为:(1)Ex vivo处理:获取去除皮下脂肪组织,将组织在液氮和 37℃水浴锅中反复冻融 5次,然后将皮肤组织置入 6 孔板中。用磷酸缓冲盐溶液(Phosphate buffered saline, PBS)冲洗 3 遍,放入 75% 乙醇中浸泡 5 min,然后再用含有双抗的PBS 冲洗 3 遍。(2)培养过夜:灭菌后,将皮肤组织切成直径为 0.6 cm 的小圆片,放入培养模具中,然后放入 6 孔板中,每孔加入 4 mL PBS 缓冲液,将孔板转移至 45℃恒温培养箱培养 24 h。(3)给药:孵育 24 h 后,给药处理,空白对照和阴性对照都不进行给药处理,阴性对照组将培养液更换为糖化反应液(0.5 mM MGO 的 PBS 缓冲液),阳性对照组给药 3 mM 的氨基胍硫酸盐,将培养液更换为糖化反应液,样品组表面涂抹样品,添加量为 1.5 μL,同时将培养液更换为糖化反应液。(4)UVA 辐照:给药结束后进行10 J/cm2UVA 的照射。(5)糖化反应:辐照结束后,将孔板转移至 45℃恒温培养箱进行糖化反应 72 h。(6)72 h 之后,重复步骤(3)至步骤(5)。(7)UVA 辐照进行 3 次,第 4 次之后,只进行给药和更换糖化反应液,不再进行 UVA 的照射处理,共计持续 21 天。(8)糖化反应结束后,将离体皮组织转移至 1.5 mL 离心管中,用 4%多聚甲醛固定,进行包埋、切片、AGEs 免疫组化染色,显微镜下采集图片。
1.2.5 结果统计分析
应用Excel 2016 作图,结果表示为Mean ± SD。各组间比较采用t-test 统计分析。统计分析均为双尾。P< 0.05 认为具有显著差异,P< 0.01 认为具有极显著差异。
2 结果与分析
2.1 红山茶花、叶提取液的抗皱能力
斑马鱼中col1a1b基因表达量,如图1 所示。从图1 中可以得出,使用0.25% 红山茶花、叶提取液的斑马鱼的col1a1b基因相对表达量为1.22,与正常对照组相比显著增加,表明红山茶花、叶提取液能促进I型胶原蛋白的表达。
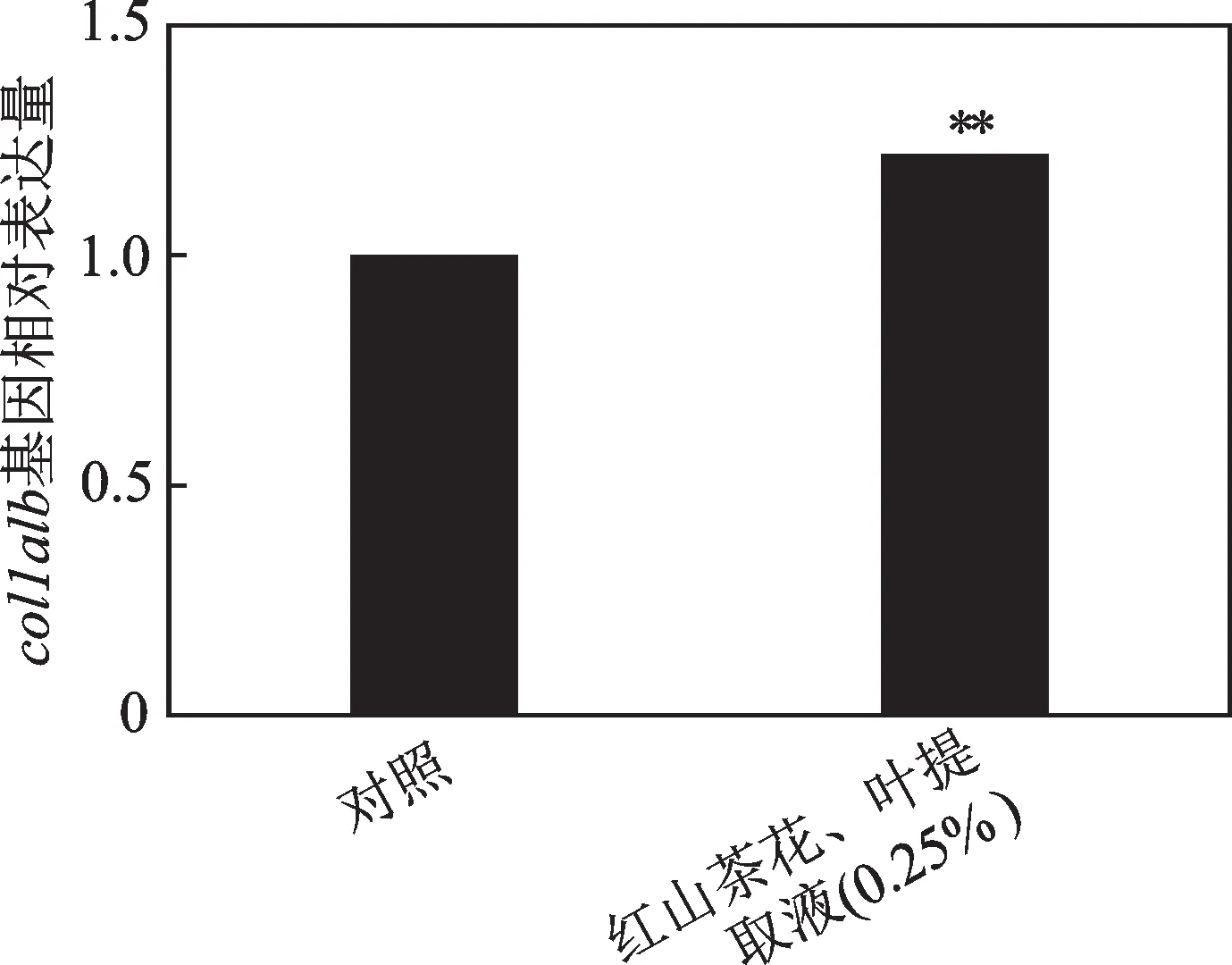
图1 红山茶花、叶提取液对斑马鱼 col1a1b 基因相对表达量的影响Fig.1 Effect of C. japonica flower and leaf extract on the relative expression of col1a1b gene in Brachydanio rerio
在成纤维细胞上开展细胞毒性检测试验,细胞存活率随着红山茶花、叶提取液浓度的大小变化如图2 所示,可以得到,在0.625%范围内的红山茶花、叶提取液并未体现出明显的细胞毒性。基于此,选取0.5% 红山茶花、叶提取液,测试其对成纤维细胞中MMP-1 和MMP-3 含量的影响,结果如图3 和图4。从图3 中可以看出,与阴性对照组相比,0.5%的红山茶花、叶提取液可以明显抑制MMP-1 的表达,并经过计算得到抑制率为14.34%。从图4中可以看出,与阴性对照组相比,0.5%的红山茶花、叶提取液也可显著性抑制MMP-3 的表达,抑制率为14.78%。
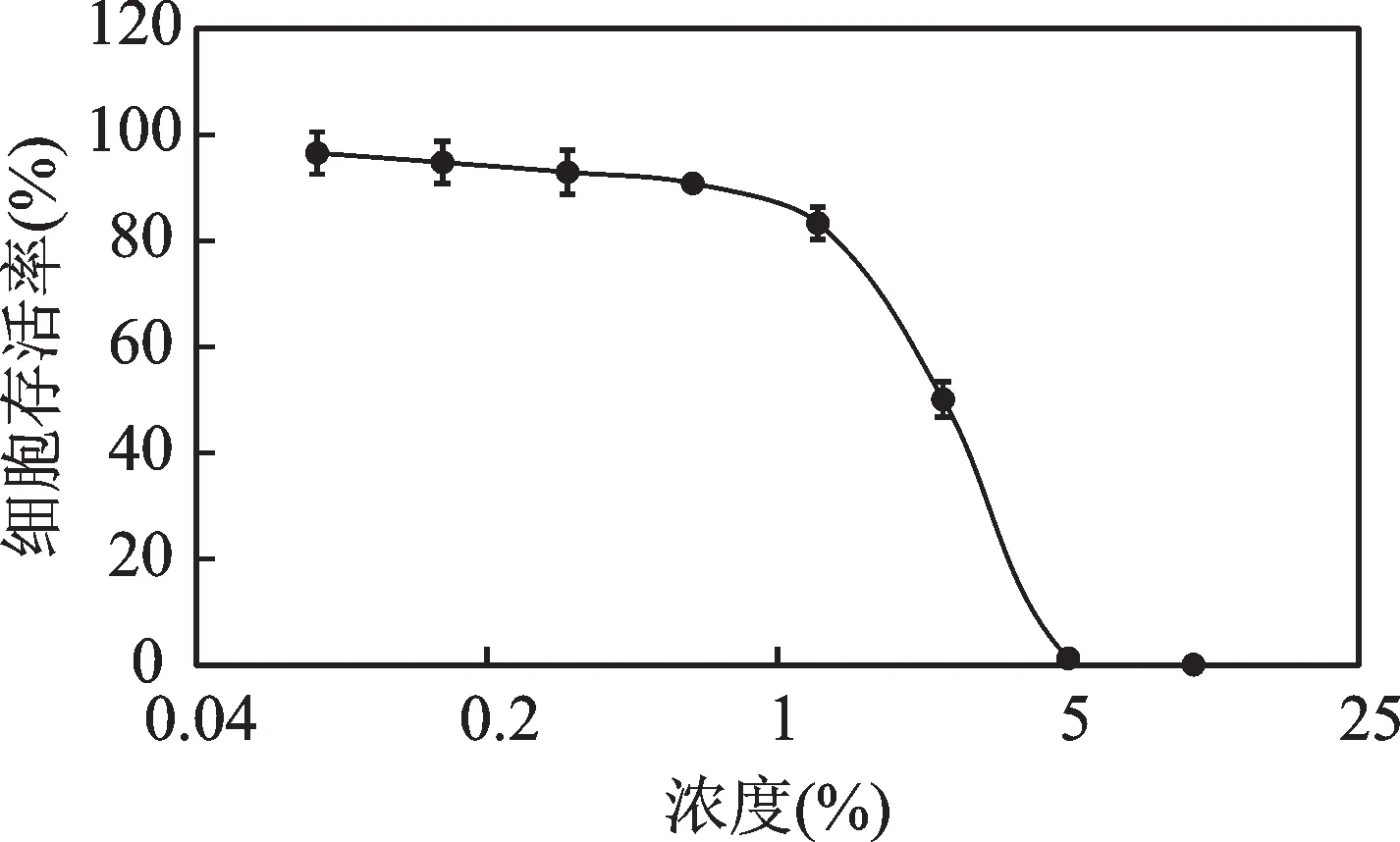
图2 红山茶花、叶提取液对成纤维细胞存活率的影响Fig.2 Effects of C. japonica flower and leaf extract on the survival rate of fibroblast
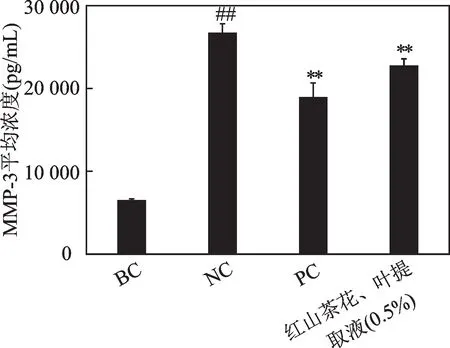
图4 红山茶花、叶提取液对MMP-3含量的影响Fig.4 Effects of C. japonica flower and leaf extract on MMP-3 content
因此,综合红山茶花、叶提取液对col1a1b基因表达量的促进以及对MMP-1 和MMP-3 表达的抑制,可以得到,红山茶花、叶提取液可以促进胶原蛋白的表达,且可以抑制胶原蛋白或弹性蛋白等ECM的降解,从而达到抗皱的效果。
2.2 红山茶花、叶提取液的抗氧化能力
在角质形成细胞上开展细胞毒性检测试验,细胞存活率随着红山茶花、叶提取液浓度的大小变化如图5所示,可以得到当红山茶花、叶提取液的浓度在0.234% ~ 1.875%范围内,细胞存活率均大于100%,并未体现出明显的细胞毒性。因此选取1.875%的红山茶花、叶提取液从对ROS 和SOD 表达的影响评估其抗氧化能力,结果如图6 和图7 所示。与空白组相比,对照组中活性氧ROS和SOD的表达有显著变化,表明造模成功。从图6 中可以看出,与对照组相比,红山茶花、叶提取液可显著性抑制ROS 的表达,且计算得到抑制率为28.85%;从图7 中可以看出,与对照组相比,红山茶花、叶提取液可显著提升SOD 的表达,且计算得到促进率为25.65%。因此,从细胞层面,红山茶花、叶提取液具有一定的抗氧化能力。这也与之前对红山茶的抗氧化研究结论一致。
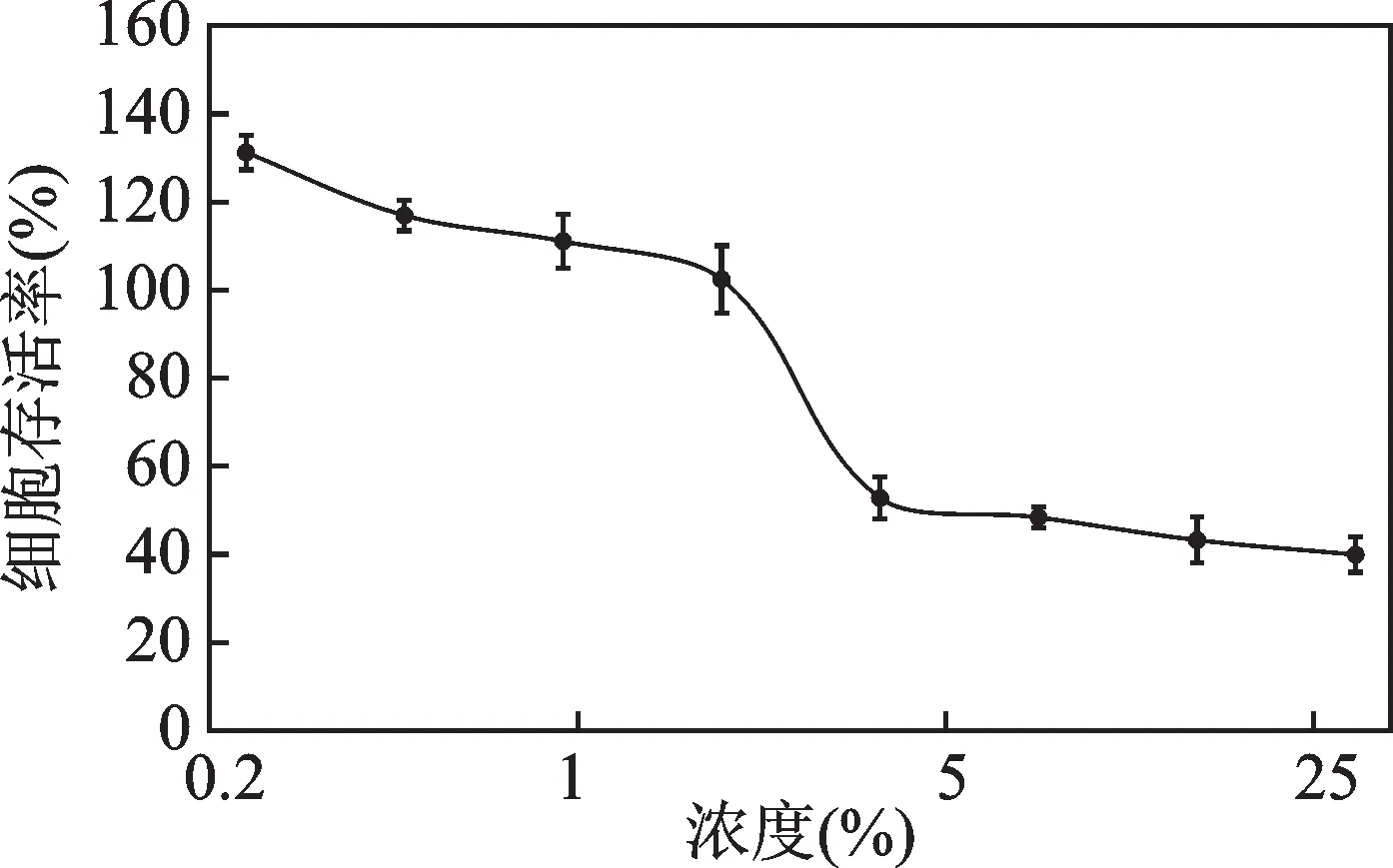
图5 红山茶花、叶提取液对角质形成细胞存活率的影响Fig.5 Effects of C. japonica flower and leaf extract on the survival rate of keratinocytes

图6 红山茶花、叶提取液对ROS水平的影响Fig.6 Effects of C.japonica flower and leaf extract on ROS level

图7 红山茶花、叶提取液对SOD活性的影响Fig.7 Effects of C. japonica flower and leaf extract on SOD activity
2.3 红山茶花、叶提取液的抗糖化能力
通过对离体皮肤中AGEs 免疫组化染色,且使用显微镜对其进行观察,如图8 所示(正文只展示1个复孔的显微照片)。可以明显看出,对比于阴性对照组,涂抹了红山茶花、叶提取液的离体皮肤中AGEs 的免疫组化强度明显减弱,且可以分别得到表皮层和真皮层中AGEs 的含量,分别如图9 和图10 所示。从图中可以得知,与阴性对照组相比,红山茶花、叶提取液对表皮层和真皮层中AGEs 的表达均为抑制,且抑制率分别为12.65%和13.87%。因此,红山茶花、叶提取液对离体皮肤的表皮层和真皮层均有抗糖化的作用。

图8 离体皮肤的表皮层和真皮层中AGEs的免疫组化显微照片Fig.8 Immunohisto chemistry micrographs of AGEs in the epidermis and dermis of ex vivo skin
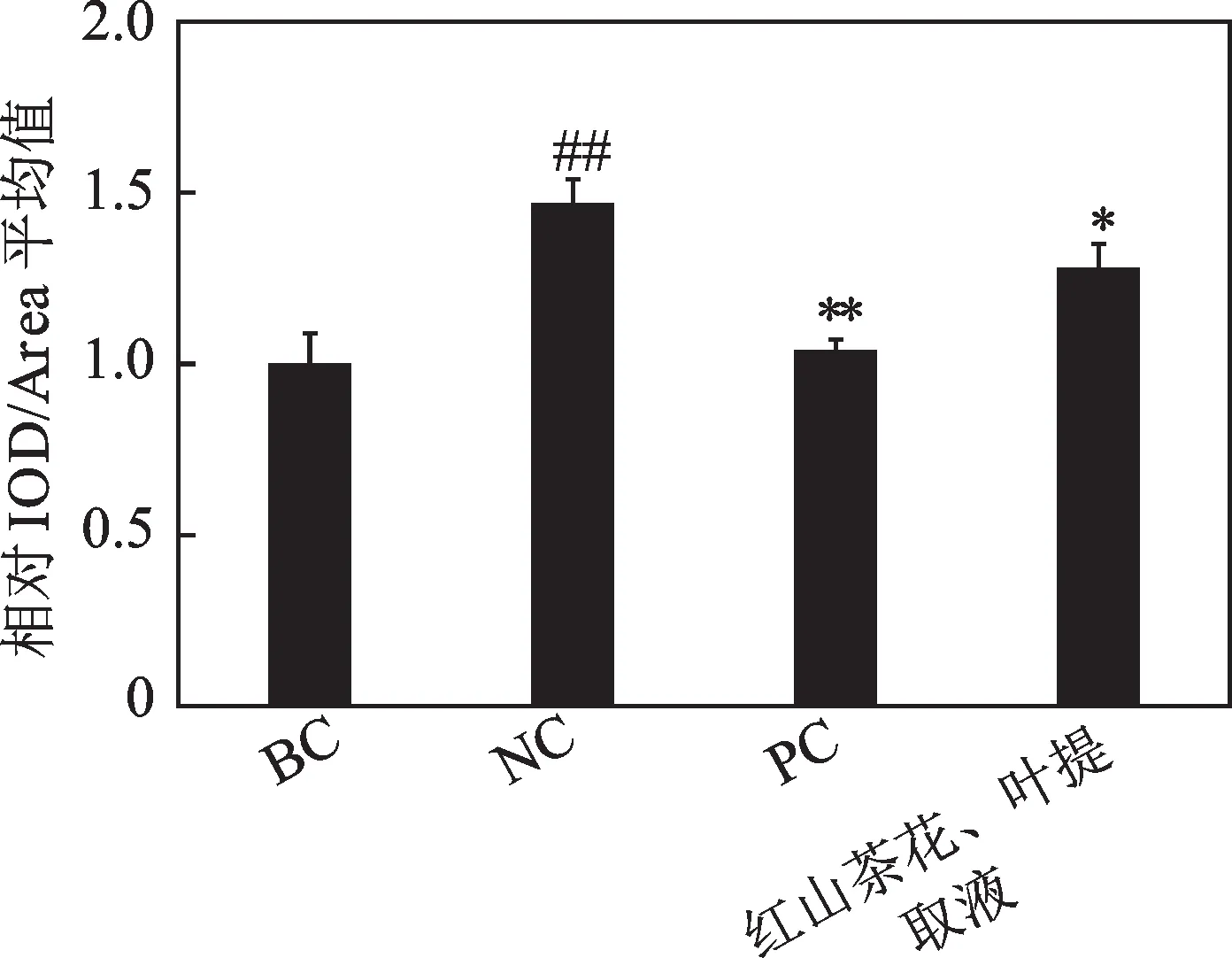
图9 红山茶花、叶提取液对表皮层中AGEs表达的影响Fig.9 Effects of C. japonica flower and leaf extract on the expression of AGEs in the epidermis
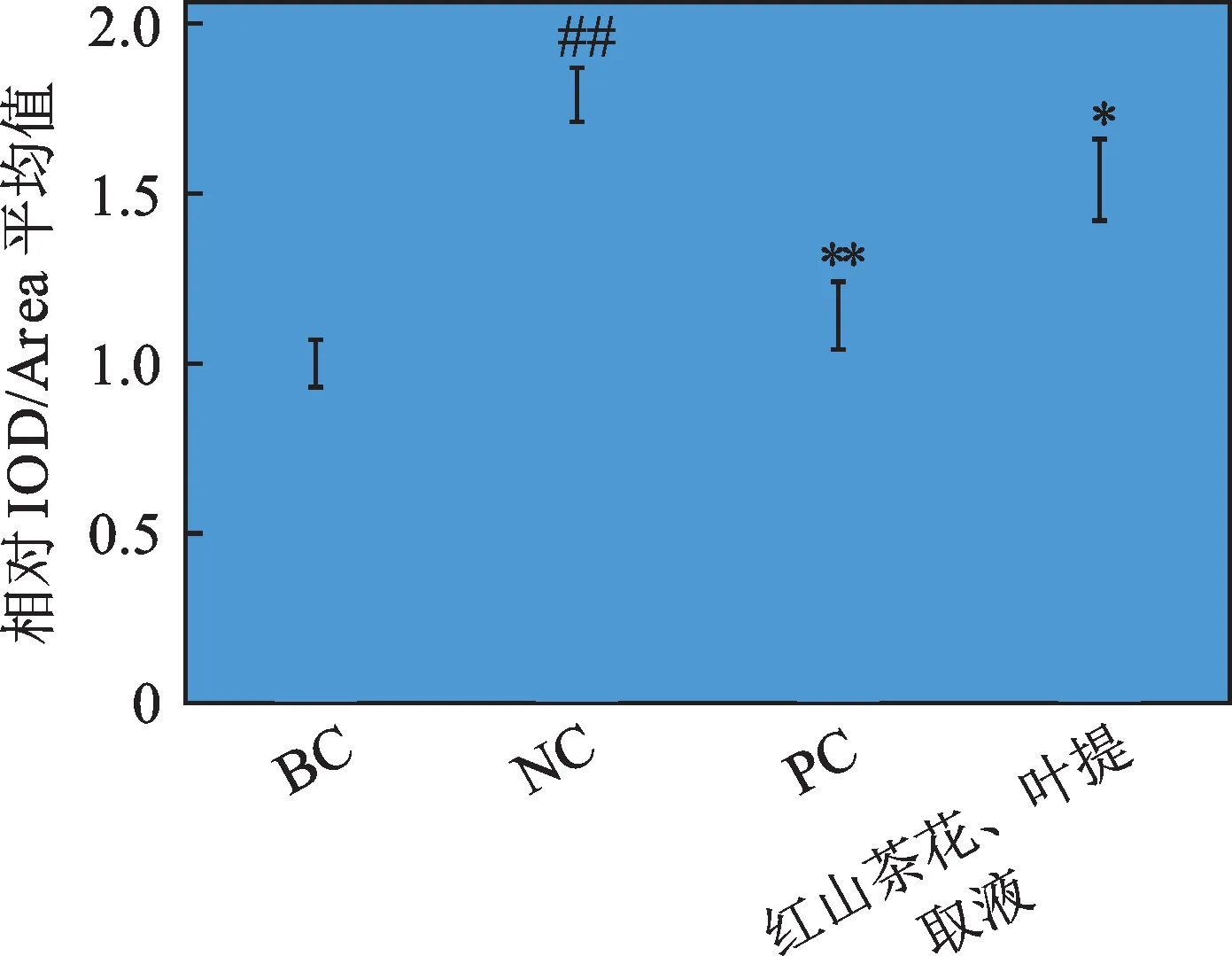
图10 红山茶花、叶提取液对真皮层中AGEs表达的影响Fig.10 Effects of C. japonica flower and leaf extract on the expression of AGEs in the dermis
3 讨论
本研究从抗皱、抗氧化及抗糖化的体外功效测试阐述了红山茶花、叶提取液的抗老功效。从之前的大量研究中可以得知,红山茶花、叶中主要含有山茶苷(Camellianoside)[24]、黄酮类、酚类和三萜类[25]等活性成分,因此具有优异的生物活性,如抗氧化等,主要体现为对ROS 的抑制以及对DPPH 的清除,还可提升抗氧化酶如SOD 等的活性。因此,本研究的结论与这些研究结果一致。
而对于红山茶组花、叶的抗糖化研究并无太多报道,目前研究集中在茶组或油茶组的抗糖化功效上,如油茶(Camellia oleiferaAbel.)壳[26],绿茶(Chinese green tea)叶、红茶(Black tea)叶及乌龙茶(Oolong tea)叶都具有抗糖化的功效[27]。但红山茶组、茶组及油茶组都属于山茶属,因此本研究也验证了红山茶组也具有抗糖化的功效。
近年来在化妆品领域,对红山茶的研究也在逐渐增多,选择不同种红山茶的花、叶、籽或籽饼为研究对象,使用不同组学分析工具分析其DNA序列或活性成分[28]。现在越来越多的化妆品公司选择将红山茶提取物作为原料添加进化妆品中,并进行人体功效测试证明其确实具有优异的功效,如抗皱、紧致、抗氧化等。未来也需更深入且准确地分析出红山茶不同部位(花、叶等)中的活性单体成分,对其进行作用靶点和通路的研究,使其作用机理更为明确,另外,开发出更高效的提取工艺对其进行富集,最终使其可以更好地应用在化妆品行业中。

