中川208烟草内生细菌微生物群落结构及其多样性
高嘉宁,张丹,杨军伟
生物技术
中川208烟草内生细菌微生物群落结构及其多样性
高嘉宁1,张丹2*,杨军伟3
1 乐山师范学院旅游与地理科学学院,四川 乐山 614000;2 中国科学院、水利部成都山地灾害与环境研究所,四川 成都 610041;3 四川省烟草公司攀枝花市公司,四川 攀枝花 617061
【目的】分析中川208四个器官(根、茎、叶、花)的细菌群落多样性与物种组成,为利用中川208内生细菌资源提供科学依据。【方法】以中川208的根、茎、叶、花为研究对象,采用高通量测序与生物信息学分析方法,解析中川208不同器官内生细菌的群落结构与物种组成,探讨植物养分特征对优势细菌菌群的调控作用。【结果】(1)从中川208四种样品中共获得5460条特征序列(amplicon sequence variants:ASVs),归属于19门、72纲、161目、285科和389属。(2)各样本的细菌群落多样性为根>茎≥花>叶。Beta多样性和聚类分析表明,中川208的根和叶内生细菌群落组成较相似,与花和茎有明显区别。(3)物种组成上,根、茎、叶内以变形菌门和放线菌门相对丰度最高,花中以厚壁菌门和拟杆菌门的相对丰度最高。LEfSe分析结果表明,中川208不同器官中的细菌群落构成在属水平上存在显著差异性,特别是细菌属不动杆菌、短波单胞菌、异根瘤菌、芽孢杆菌、金黄杆菌、肠杆菌、另枝菌、毛螺菌、普拉梭菌、瘤胃球菌和的相对丰度在茎、叶、花内差异显著。(4)冗余分析表明,烟株总N(2= 0.730,< 0.001)、总糖(2= 0.883,< 0.001)和Mg(2= 0.907,< 0.01)含量与各器官中的优势细菌群落分布密切相关。【结论】中川208内生细菌群落多样性自根依次向花、茎、叶呈递减趋势,且不同器官中的内生细菌群落在物种组成上具有明显差异性。中川208植物器官中存在多种显著富集的细菌菌群,值得进一步研究与开发利用。
中川208;植物内生细菌;群落结构;多样性;植物区室分化
植物内生菌广泛存在于生物体的花、果、叶、茎、根中,它们与生物体共同进化,在养分吸收、新陈代谢和免疫调节等生物过程中发挥着重要作用[1]。目前,关于烟草内生菌的研究已受到国内外学者的广泛关注。研究证实,烟草内生菌可作为微生物菌肥,在促进植物生长与养分吸收(固氮、解钾和溶磷)、降烟碱和亚硝酸盐、增强植物抗逆性(高温、干旱、高盐和重金属)与抗病性(病害、虫害)等方面发挥积极作用[2-5]。
中川208是以中烟103为母本、T136为父本,选育而成的烤烟雄性不育杂交种[6]。据报道,中川208在质量性状、经济性状和抗病性(如抗TMV、耐气候性斑点病)等方面均明显优于K326和云烟87,且能表现出良好的区域适应性[6-7]。近年来,中川208作为我国西南和华中烟区新的主推品种,在四川攀枝花、凉山州、宜宾和湖南等烟区广泛种植。前人对烟草内生细菌类群和动态的研究已有一些报道,但是这些研究大多集中在云烟85、云烟87和K326等几个烤烟品种,且多采用组织分离或可培养的研究方法[8-12]。如徐慧等[8]利用微生物分离培养基,从云烟中下部叶片中共分离筛选出129株细菌菌株,分属于19个属,其中葡萄球菌属、假单胞菌属和芽孢杆菌属分别占总分离数量的29.4%、17.1%和16.3%。陈泽斌等[9]为了解烟草K326的内生细菌多样性,从健康烟草的根、茎、叶组织中分离获得了267株内生细菌,并通过16S rRNA序列同源性比对分属于21个属,其中芽孢杆菌属是烟草可培养内生细菌的优势种群。然而,关于烟草新品系中川208内生细菌的多样性研究目前还未有相关报道。因此,本研究基于高通量测序与分析技术,从整体水平上分析中川208内生细菌的群落结构、物种组成和微生物多样性,并探讨植物养分特征对内生细菌群落分布的影响,以期揭示中川208植物组织内的微生物多样性与分布特征,为开发利用微生物资源、探究植物与微生物间的相互作用关系提供基础理论依据。
1 材料与方法
1.1 中川208种植烟区生态因子
供试烟草样品“中川208”于2021年8月中旬采自四川攀枝花市米易县(27°6′25.76″ N,102°8′48.58″ E)。米易县地处青藏高原东南缘,位于金沙江下游,受河谷深切和大气环流的影响,该区域属季节性干旱区,年均温16.2℃,年有效积温5249℃,年日照时数2700 h,年均降雨量1112 mm,年均蒸发量2003 mm,无霜期达268 d[13]。米易县种植的主流烟草品种为中川208,主要分布在海拔1300~1700 m的山地坡地,土壤类型以赤红壤为主[14]。
1.2 样品采集与无菌化处理
2021年8月,于研究区域内随机确定6个30 m×30 m的样方,在各样方内分别选取5株健康且长势一致的成熟烟株(株高122.7±14.2 cm,茎围10.5±1.6 cm,节间距6.5±0.7 cm,叶片数21±3片,最大叶长73.2±4.5 cm,最大叶宽33±4.4 cm),收获植株的根、茎、叶、花4个部位。分别将同一样方内5株植物的根、茎、叶、花样品混合,每组样品重复6次。所有样品用无菌袋4℃保藏,12 h内带回实验室进行内生微生物提取。
植物组织表面消毒方法参照陈泽斌等[15]。先用流水冲洗组织表面,再用无菌水漂洗数次至洗涤液无色,除去表面非固定性附着物与杂质。根部样品依次置于0.1% SDS、1% NaClO溶液中浸泡3~5 min,茎、叶和花样品于75%酒精中处理5 min,所有样品用无菌水漂洗、无菌吸水纸擦干表面,并置于无菌袋内-80℃保存,用于后续DNA提取。
1.3 DNA提取与扩增子测序
样本总DNA抽提、浓度与纯度检测方法均参照文献[16]进行。质检合格后采用338F(ACTCCTAC GGGAGGCAGCA)、806R(GGACTACHVGGGTW TCTAAT)扩增细菌16S rRNA基因V3-V4区。PCR反应体系(25 μL)与反应条件(25~30个循环)参照文献[17]。TAE缓冲液洗脱回收目标片段后,采用Qubit 2.0系统对PCR产物进行定量,并使用Illumina NovaSeq 6000系统方法进行测序。
1.4 测序数据处理及生物信息学分析
采用DADA 2和QIIME 2软件分析序列。使用QIIME 2中的Naive Bayes分类器对质控后的序列以100%的相似度聚类生成每个特征序列(amplicon sequence variants:ASVs),重复序列中去除singletons。为了获得ASV的注释分类信息,对16S rRNA生成的每个ASV特征序列于SILVA_132(http://www.arb- silva.de)进行比对。对获得的ASV以最小样本序列数抽平后,采用QIIME 2软件计算各样本的Alpha多样性指数;基于Bray-Curtis距离矩阵分析样本的Beta多样性,并采用主坐标分析(principal coordinates analysis:PCoA)评估样本微生物群落结构的差异性与相似性[18];采用线性判别效应量分析(linear discriminant analysis Effect size:LEfSe)解析各组间稳健的差异类群[19];最后采用冗余分析(redundancy analysis:RDA)探讨烟叶质量与内生细菌群落之间的相关性。以上分析均在上海派森诺基因云平台(https://www.genescloud.cn)上完成。
1.5 植物理化性质分析
植物总氮、钾、钙和镁提取与含量测定方法参照文献[20-21]进行;总糖含量测定采用紫外分光光度 法[22]。
2 结果与分析
2.1 测序数据集
从中川208根、茎、叶、花4种样品的16S rRNA测序数据中共产生了74604条原始序列,平均长度为389 bp,质控、优化后获得了67927条有效序列。这些序列被聚类为5460个不同的扩增子特征序列(amplicon sequence variants:ASVs)(以100%的相似度水平为标准),归属于19门、72纲、161目、285科和389属。根、茎、叶、花4种样品细菌群落的ASV数分别为2733、944、1019和1132,分别占ASV总数的50.05%、17.29%、18.66%和20.73%。
2.2 细菌群落Alpha多样性
根、茎、叶、花4种样品中的细菌群落Alpha多样性指数如表1所示。从表1可看出,根、茎、叶、花的细菌群落Alpha多样性存在显著差异(Duncan检验,< 0.05)。其中,根的Chao1、Shannon和Pielou’s evenness指数最高(分别为736.12、8.05和0.98),而物种覆盖度指数则显著低于茎、叶和花,为0.38;辛普森指数由大到小依次为根>茎≥花>叶。由此可以看出,烟草根内细菌群落的Alpha多样性最高,茎和花次之,叶内的细菌群落多样性最低。
表1 烟草细菌群落Alpha多样性

Tab. 1 Alpha diversity indices of bacterial communities in Nicotiana tabacum.
注:同列不同小写字母表示存在显著差异性(Duncan检验,< 0.05)。
Note: Different lowercase letters in the same line indicate significant differences (Duncan's test,< 0.05).
2.3 细菌群落优势类群组成
在门水平上(图1A),根、茎、叶、花内生细菌丰度较大的菌群主要为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes),在根、茎、叶、花中的总丰度占比分别为76.07%、98.19%、99.15%和97.01%。其中,根中相对丰度最高的为变形菌门(30.43%)和放线菌门(36.04%),茎和叶中相对丰度最高的为变形菌门(57.07%和80.56%),而花中相对丰度较高的为厚壁菌门(59.72%)和拟杆菌门(29.34%)。
在纲水平上(图1B),γ-变形菌纲(Gammaproteobacteria)、梭菌纲(Clostridia)、拟杆菌纲(Bacteroidia)、放线菌纲(Actinobacteria)、α-变形菌纲(Alphaproteobacteria)和芽孢杆菌纲(Bacilli)为各样本的优势菌群,在根、茎、叶、花中的总丰度占比分别为59.95%、95.96%、97.94%和96.62%。其中,γ-变形菌纲在茎和叶中的相对丰度最高,分别为39.83%和75.43%;梭菌纲(Clostridia)在花中的相对丰度最高,为50.98%;而根中以放线菌纲(Actinobacteria)的相对丰度最高,为24.50%。
在属水平(Top 20)上(图1C),不动杆菌(Acinetobacter)、金黄杆菌(Chryseobacterium)、短波单胞菌(Brevundimonas)、异根瘤菌(Allorhizobium)和Candidatus_Portiera主要分布在茎中,相对丰度占比分别为20.57%、12.12%、5.33%、4.45%和4.39%;泛菌(Pantoea)、肠杆菌(Enterobacter)、假单胞菌(Pseudomonas)、Rosenbergiella和寡养单胞菌(Stenotrophomonas)主要分布在叶中,相对丰度占比分别为20.76%、14.68%、4.63%、7.28%和2.83%;拟杆菌(Bacteroides)、普拉梭菌(Faecalibacterium)、瘤胃球菌(Ruminococcaceae_UCG-014)、另枝菌(Alistipes)、乳杆菌(Lactobacillus)和Ruminococcus_ torques主要分布在花中,相对丰度占比分别为23.36%、7.62%、7.47%、5.32%、5.45%和4.95%;而根内以芽孢杆菌(Bacillus)、梭菌(Clostridium_sensu_ stricto_1)、类诺卡氏菌(Nocardioides)和Subgroup_6的丰度相对较高,分别为4.21%、1.85%、1.96%和2.31%。同时,由各样本聚类分析(Average算法)的结果可看出(图1C),根与叶聚为一支,表明中川208根与叶的内生细菌物种组成相似性相对较高,这与基于加权UniFrac距离(Bray-curtis)的Beta多样性分析结果相一致。从主坐标分析结果可看出(图2),第一主坐标和第二主坐标解释的变异度分别为20.9%和18.0%,根与叶细菌分类单元聚类距离较近,而花与茎两两之间的聚类距离较远,表明中川208根与叶的内生细菌群落结构与物种组成更接近。
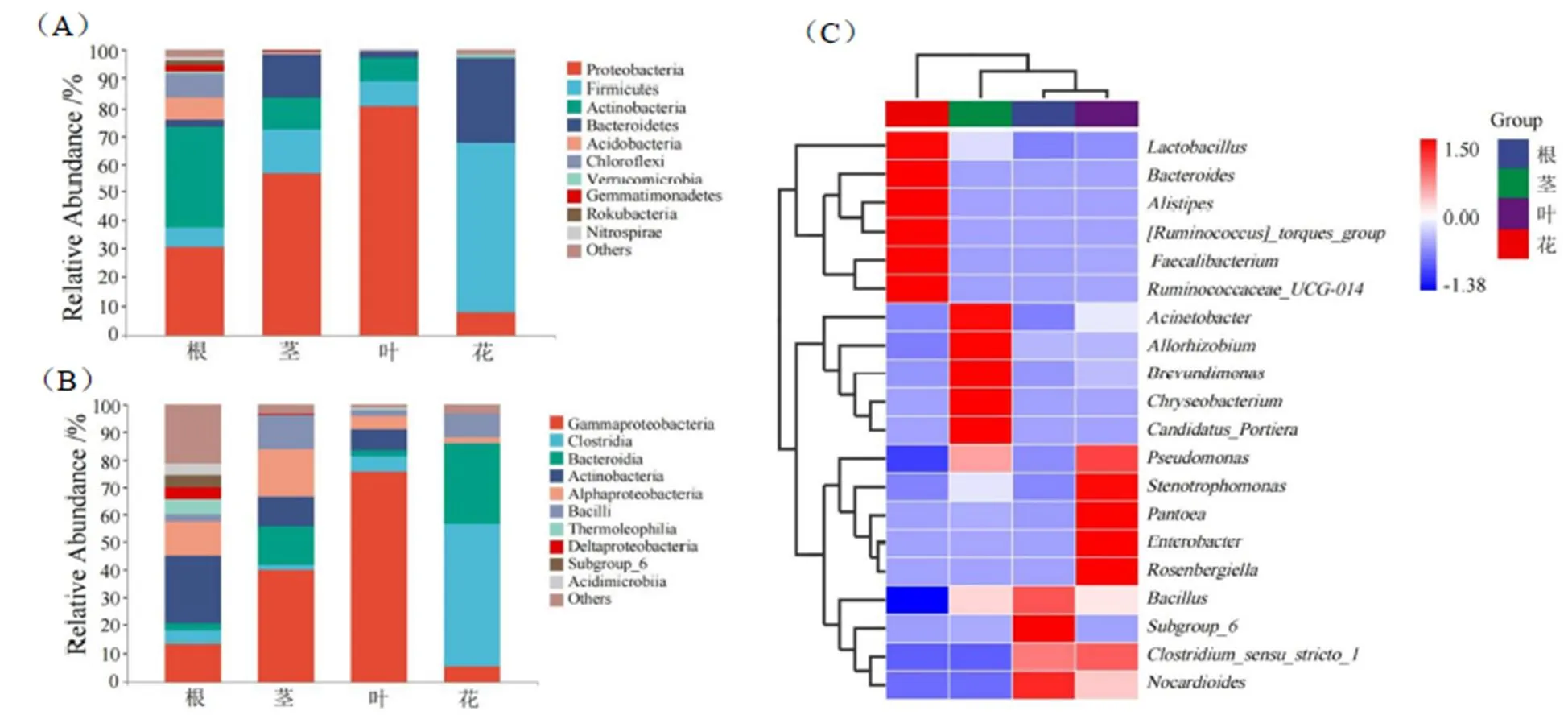
注:图A和图B中的others表示相对丰度低于1%的类群,图C中的色标表示数据转换(log 2)后的相对丰度值,红色表示高丰度,蓝色表示低丰度。
Note: In figure A and figure B, “others” represents the sum of bacterial taxa with relative abundance of less than 1%. In figure C, the colors represent the relative abundance values after the data conversion (log 2),and the red and blue color represent the higher and lower relative abundance, respectively.
图1 烟草内生细菌群落在门(A)、纲(B)和属(C)水平上的相对丰度
Fig. 1 The relative abundance of endophytic bacterial communities inat phylum (A), class (B) and genus (C)

图2 烟草内生细菌群落主坐标分析
2.4 细菌菌群物种差异
为了探究从门到属水平上的烟草内生细菌物种组成差异,对各组样品进一步进行了线性判别效应量分析(linear discriminant analysis Effect size:LEfSe),结果如图3所示。根中显著富集的细菌(目水平)主要为微球菌目(Micrococcales)、Gaiellales和Corynebacteriales等,均属放线菌门。茎中显著富集的细菌(属水平)主要为不动杆菌()、短波单胞菌()、异根瘤菌()和_,均属变形菌门中的假诺卡氏菌目(Pseudonocardiales)和Caulobacterales;另外,厚壁菌门中的芽孢杆菌属()和金黄杆菌属()也显著富集于茎中。叶中显著富集的细菌(属水平)主要为肠杆菌()和,均属变形菌门中的肠杆菌目(Enterobacteriales)。花中显著富集的细菌(属水平)主要为毛螺菌()、链球菌()、普拉梭菌()和瘤胃球菌(),均属厚壁菌门,且拟杆菌门中的另枝菌()也显著富集于花中。由此可以看出,上述这些细菌菌群的显著富集导致了中川208根、茎、叶、花内生细菌在群落结构及物种组成上的明显差异性。

注:图A为分类学分支图,图中的节点表示显著富集类群;图B为LDA分析得分图,得分越高表明物种丰度对组间差异的影响越大。p、c、o、f、g分别表示门、纲、目、科和属水平。
Note: Figure A is the cladogram of bacterial communities. The nodes in the figure represent bacterial taxa that are significantly enriched in different groups. Figure B is the LDA analysis of bacterial communities. The LDA score represents the influence of taxa abundance on the difference among groups, and the higher the score, the greater the influence of species abundance on the intergroup differences . The p, c, o, f and g represent the phylum, class, order, family and genus levels, respectively.
图3 烟草内生细菌群落组成LEfSe分析
Fig. 3 LEfSe analysis of endophytic bacterial communities in
2.5 烟草总糖、总N、K、Ca和Mg含量与菌群丰度
2.5.1 烟草总糖、总N、K、Ca和Mg含量差异性
烟草根、茎、叶、花中的总糖、总N、K、Ca和Mg含量如表2所示,烟草不同器官中的总糖、总N、K、Ca和Mg含量存在极显著差异(Duncan检验,< 0.01)。其中,总N平均含量以根部和茎部显著最高,分别为4.21%和3.99%;Mg和总糖平均含量以根部显著最高,分别为4.74 g/kg和40.46%;K含量以叶部显著最高,平均为3.37%;而Ca含量以茎部显著最低,平均为19.88 g/kg,且根、叶和花中的Ca含量无显著性差异。

表2 烟草各组织器官主要品质成分
注:同一行的不同小写字母表示存在显著差异性(Duncan检验,< 0.05)。
Note:Different lowercase letters in the same line indicate significant differences (Duncan's test,< 0.05).
2.5.2 优势菌群丰度与烟草总糖、总N、K、Ca和Mg含量相关性
为了进一步探究烟草化学成分与优势细菌菌群间的相关性,使用冗余分析来解释5种常规化学成分对优势微生物群落(属水平,Top 10)的影响。由图4可知,RDA1和RDA2解释的总变异度为66.33%。其中,烟株K和Mg含量显著影响不动杆菌()、泛菌()、肠杆菌()、金黄杆菌()和等优势细菌菌群的分布;Ca含量显著影响拟杆菌()、普拉梭菌()、瘤胃球菌()和乳杆菌()的菌群分布;而总N和总糖含量显著影响假单胞菌()的分布。结合蒙特卡罗置换检验的结果发现,烟株总N(2= 0.730,< 0.001)、总糖(2= 0.883,< 0.001)和Mg(2= 0.907,< 0.01)含量与内生优势细菌群落分布密切相关。

图4 优势细菌菌群丰度与烟草化学成分冗余分析
3 讨论
植物组织或植物器官对内生细菌群落结构与物种组成具有显著影响[23]。植物的根、茎、叶、花可以主动从种子(垂直方向)或环境(水平方向),或通过混合模式从邻近的微生物库中招募微生物群,在此过程中不同的微生物通常表现出对各组织、器官或区室明显的趋化性[24-25]。从拟南芥[26]、烟草[11]、葡萄藤[27]、番茄[28]和柑橘[29]等植物的根、茎、叶分析发现,植物不同组织器官的微生物群落构成普遍存在差异性。Maignien等研究认为,植物不同组织器官对优势细菌菌群具有明显的定向选择性,这可能与植物组织的微形态、生理特征和养分特征等密切相关[30]。前人研究证实,植物的养分特征能显著影响优势微生物的定殖、分布及其功能属性[31],尤其是植物可溶性糖、游离氨基酸、有机酸和矿质养分含量能显著影响根与叶的微生物群落结构及其组装[32]。本研究也获得了类似的结果,从RDA分析和蒙特卡洛置换检验的结果可知,中川208不同器官中的N、Mg和总糖含量存在极显著差异,进而可能介导内生优势细菌菌群在根、茎、叶、花器官内的特异性富集与差异性。
然而,尽管植物不同部位的优势微生物群落可能存在差异,但关键的微生物成员往往具有相似性与重叠性,这似乎是植物的一种保守现象[33-34]。前人研究一致认为,关键微生物与宿主植物在长期的协同进化中,能逐渐适应、克服植物的免疫系统,从而达到在植物体内稳定定殖与繁衍,并对形成整个圈层的微生物群落结构发挥核心作用[35]。这种趋势在本研究中也进一步得到了证实,尤其是烟株根与叶的内生细菌群落组成存在明显相似性。比较分析发现,芽孢杆菌、寡养单胞菌、肠杆菌、泛菌和假单胞菌为烟草根与叶内常见的优势细菌属[36-37]。事实上,植物叶内的微生物群落与根部密切相关,但在功能上又显著不同于根部,特别是对植物生长、发育和健康具有显著作用[33, 35]。例如前人研究发现,芽孢杆菌能产生ACC脱氨酶,同时释放植物激素与酶类物质,直接或间接地激活植物免疫系统,调节植物生长[38];肠杆菌通过产生植物激素,如吲哚-3-乙酸(IAA)和赤霉素,在重金属胁迫下赋予植物抗性[39]。
前期研究发现,植物遗传性状(植物基因型)能明显调控植物组织化学和表面拓扑结构(如粗糙度),从而影响微生物的定殖、分布与多样性[40]。黄晓辉等通过分离计数法,发现净叶黄内生细菌分布表现为根>叶>茎,G80和红花大金元为根≥茎>叶,而K326不同器官的内生细菌分布无显著性差异[41]。在本研究中,中川208根内细菌群落多样性显著最高,茎和花次之,叶最低。另外,本研究发现,在烟草中川208中存在内生另枝菌、异根瘤菌、普拉梭菌、乳杆菌、瘤胃球菌、和_,这可能与生物(植物基因型和表型、病原菌、食草动物和昆虫活动)、非生物(地理位置、气候、土壤类型和养分特征)及人类活动(如除草剂、土壤改良剂和耕作方式)干扰有关[27, 33]。比较分析发现,这些微生物并不是随机定殖在某一植株上,而是具有普遍性,这可能是植物与微生物长期协同进化的结果。研究认为,另枝菌、普拉梭菌、毛螺菌和瘤胃球菌等细菌常见于健康人体的肠道或动物粪便中,且具有显著的免疫调节、抗炎和抗氧化性[42],而烟草花内显著富集这些微生物,很可能与微生物在花与环境中频繁的物种交换有关。
4 结论
中川208不同器官中的内生细菌群落在物种组成上具有明显差异性。总体而言,根与叶的内生细菌群落组成较相似,但与花和茎有明显区别。因此,深入探究中川208内生微生物组与宿主植物间的互作机制、建立与拓展烟草中川208优良性状(抗病、耐盐、耐旱和耐养分胁迫)的生物学调控途径,将有利于促进烟草产业发展,开发创制新型烟草促生、抗逆微生物肥料,实现生态和经济效益双赢。
[1] Hunter P. Plant microbiomes and sustainable agriculture[J]. EMBO Reports, 2016, 17(12): 1696-1699.
[2] 黄化刚,吕立新,张艳茗,等. 微生物帮助烟草抗旱的机理及其应用[J]. 应用生态学报,2017,28(9):3099-3110.
HUANG Huagang, LV Lixin, ZHANG Yanming, et al. Microbe- assisted drought resistance for tobacco plants: mechanisms and applications[J]. Chinese Journal of Applied Ecology, 2017, 28(9): 3099-3110.
[3] Mastretta C, Taghavi S, Vander-Lelie D, et al. Endophytic bacteria from seeds ofcan reduce cadmium phytotoxicity[J]. International Journal of Phytoremediation, 2009, 11(3): 251-267.
[4] 张天栋,李庚,汤丹瑜. 降低烟叶烟碱和亚硝酸盐的烟草内生菌筛选及代谢产物应用[J]. 食品工业,2011, 32(4): 6-8.
ZHANG Tiandong, LI Geng, TANG Danyu. Studies on reducing the contents of nicotin and nitrite in tobacco leaves by the metabolite of endophytic fungi (sp.)[J]. Food Industry, 2011, 32(4): 6-8.
[5] 姜乾坤,彭阁,王瑞,等. 抗青枯内生细菌的筛选及其对烟草青枯病的防治效果[J]. 中国烟草科学,2017, 38(5): 13-17, 31.
JIANG Qiankun, PENG Ge, WANG Rui, et al. Selection of endophytic antagonistic bacteria for control of tobacco bacterial wilt[J]. Chinese Tobacco Science, 2017, 38(5): 13-17, 31.
[6] 张玉,刘杨,王元英,等. 烤烟新品种中川208的选育及特征特性[J]. 中国烟草科学,2019, 40(5): 1-7.
ZHANG Yu, LIU Yang, WANG Yuanying, et al. Breeding and characterization of a new flue-cured tobacco variety Zhongchuan 208[J]. Chinese Tobacco Science, 2019, 40(5): 1-7.
[7] 钱进,邓涛,李先才,等. 中川208烤烟品种在宣威不同海拔烟区的适应性[J]. 湖南农业科学,2021(8): 10-13.
QIAN Jin, DENG Tao, LI Xiancai, et al. Study on adaptability of flue-cured tobacco variety Zhongchuan 208 in Xuanwei Tobacco- growing Areas at different altitude[J]. Huanan Agricultural Sciences, 2021(8): 10-13.
[8] 徐慧,杨根华,张敏,等. 云南烟草叶片内生及叶际细菌、真菌多样性研究[J]. 云南农业大学学报(自然科学),2014, 29(2): 149-154.
XU Hui, YANG Genhua, ZHANG Min, et al. Analysis of diversity of endophytes and phyllospheric microorganism from Yunan tobacco leaves[J]. Journal of Yunnan Agricultural University (Natural Science), 2014, 29(2): 149-154.
[9] 陈泽斌,夏振远,雷丽萍,等. 烟草可培养内生细菌的分离及多样性分析[J]. 微生物学通报,2011, 38(9): 1347-1354.
CHEN Zebin, XIA Zhenyuan, LEI Liping, et al. Diversity of cultivable endophytic bacteria isolated from tobacco[J]. Microbiology China, 2011, 38(9): 1347-1354.
[10] 焦蓉,刘剑金,杨焕文,等. 抑制烟草黑胫病菌和促烟草幼苗生长内生菌的分离与鉴定[J]. 云南农业大学学报(自然科学),2018, 33(6): 1037-1045.
JIAO Rong, LIU Jianjin, YANG Huanwen, et al. Isolation and identification of endophytic bacteria inhibitingand promoting tobacco seedling growth[J]. Journal of Yunnan Agricultural University (Natural Science), 2018, 33(6): 1037-1045.
[11] LEI Liping, XIA Zhenyuan, LIU Xingzhong, et al. Occurrence and variability of tobacco rhizosphere and phyllosphere bacterial communities associated with nicotine biodegradation[J]. Annals of Microbiology, 2015, 65(1): 163-173.
[12] LI Juan, ZHENG Bufan, HU Ruiwen, et al.species isolated from tobacco seed promote root growth and reduce lead contents inK326[J]. Canadian Journal of Microbiology, 2019, 65(3): 214-223.
[13] 王珂依. 西南干热河谷酿酒葡萄时域延迟萌芽的气候资源配置与区划[D]. 中国农业科学院,2021.
WANG Keyi. Climate resource allocation and regionalization for regional delay germination of wine grape in Southwest Hot-dry Valley[D]. Chinese Academy of Agricultural Sciences Thesis, 2021.
[14] 张宗锦,余伟,胡建新,等. 攀枝花烟区不同类型土壤主要肥力特征分析[J]. 中国农学通报,2017, 33(12): 58-62.
ZHANG Zongjin, YU Wei, HU Jianxin, et al. Anaysis of major fertility characteristic of different tobacco cultivation soils in Panzhihua City[J]. Chinese Agricultural Science Bulletin, 2017, 33(12): 58-62.
[15] 陈泽斌,代方平,寸林江,等. 烟草内生细菌分离方法的优化研究[J]. 中国烟草学报,2014, 20(1): 90-95, 102.
CHEN Zebin, DAI Fangping, CUN Linjiang, et al. Characteristic analysis of endophytic bacteria population in tobacco[J]. Acta Tabacaria Sinica, 2014, 20(1): 90-95, 102.
[16] Gobbi A, Santini R G, Filippi E, et al. Quantitative and qualitative evaluation of the impact of the G2 enhancer, bead sizes and lysing tubes on the bacterial community composition during DNA extraction from recalcitrant soil core samples based on community sequencing and qPCR[J]. PLoS One, 2019,14(4): e0200979.
[17] Saghaï A, Wittorf L, Philippot L, et al. Loss in soil microbial diversity constrains microbiome selection and alters the abundance of N-cycling guilds in barley rhizosphere[J]. Applied Soil Ecology, 2022, 169: 104224.
[18] Ramette A. Multivariate analyses in microbial ecology[J]. FEMS Microbiology Ecology, 2007, 62(2), 142-160.
[19] Segata N, Izard J, Waldron L, et al. Metagenomic biomarker discovery and explanation[J]. Genome Biology, 2011, 12(6): R60.
[20] Ali M M, Al-Ani A, Eamus D, et al. Leaf nitrogen determination using non-destructive techniques: A Review[J]. Journal of Plant Nutrition, 2017, 40(7): 928-953.
[21] 程利侠,郝华玲,吕长平. 微波消解-ICP-MS法快速测定卷烟烟丝中钾、钙和镁的含量[J]. 安徽农业科学,2018, 46(34): 164-165.
CHENG Lixia, HAO Hualing, LV Changping. Rapid determination of potassium, calcium and magnesium in cigarette cut filler with microwave digestion-ICP-MS[J]. Journal of Anhui Agricultural Sciences, 2018, 46(34): 164-165.
[22] Machado R, Fábio H W, Marco F F. Determination of total sugar content in soy-based drinks using infrared spectroscopy and chemometrics[J]. Food Analytical Methods, 2018, 11(7): 1986-1993.
[23] Hamonts K, Trivedi P, Garg A, et al. Field study reveals core plant microbiota and relative importance of their drivers[J]. Environmental Microbiology, 2018, 20(1): 124-140.
[24] Samreen T, Naveed M, Nazir M Z, et al. Seed associated bacterial and fungal endophytes: Diversity, life cycle, transmission, and application potential[J]. Applied Soil Ecology, 2021, 168: 104191.
[25] Bright M, Bulgheresi S. A complex journey, transmission of microbial symbionts[J]. Nature Reviews Microbiology, 2010, 8(3): 218-230.
[26] BAI Yang, Muller D B, Srinivas G, et al. Functional overlap of theleaf and root microbiota[J]. Nature, 2015, 528: 364-369.
[27] Wagner M R, Lundberg D S, Del-Rio T G, et al. Host genotype and age shape the leaf and root microbiomes of a wild perennial plant[J]. Nature Communications, 2016, 7: 12151.
[28] Bendaha M E A, Belaouni H A. Effect of the endophytic plant growth promotingEB4B on tomato growth[J]. Hellenic Plant Protection Journal, 2020,13(2): 54-65.
[29] Araujo W L, Marcon J, Maccheroni W, et al. Diversity of endophytic bacterial populations and their interaction within citrus plants[J]. Applied and Environmental Microbiology, 2002, 68(10): 4906-4914.
[30] Maignien L, Deforce E A, Chafee M E, et al. Ecological succession and stochastic variation in the assembly ofphyllosphere communities[J]. mBio, 2014, 5(1): e00682-00613.
[31] Thapa S, Prasanna R, Ranjan K, et al. Nutrients and host attributes modulate the abundance and functional traits of phyllosphere microbiome in rice[J]. Microbiological Research, 2017, 204: 55-64.
[32] YANG Wenling, GONG Tao, WANG Jiwen, et al. Effects of compound microbial fertilizer on soil characteristics and yield of Wheat (L.)[J]. Journal of Soil Science and Plant Nutrition, 2020, 20(4): 2740-2748.
[33] Vorholt, J A. Microbial life in the phyllosphere[J]. Nature Reviews Microbiology, 2012, 10: 828-840.
[34] Grady K L, Sorensen J W, Stopnisek N, et al. Assembly and seasonality of core phyllosphere microbiota on perennial biofuel crops[J]. Nature Communications, 2019, 10(1): 4135.
[35] Carlstrom C I, Field C M, Bortfeld-Miller M, et al. Synthetic microbiota reveal priority effects and keystone strains in thephyllosphere[J]. Nature Ecology & Evolution, 2019, 3: 1445-1454.
[36] 吕优优. 环秦岭地区烟叶微生物功能评价及优势增香微生物菌库构建[D]. 西北农林科技大学,2017.
LV Youyou. Evaluation of microbial function of tobacco leaves around Qinling Mountains and establishment of microbial library for dominant aroma enhancing microorganism[D]. Northwest A&F University, 2017.
[37] 陈永珍,杨义,卢燕回,等. 广西烟草内生细菌的动态分布及其对烟草疫霉的拮抗作用[J]. 中国烟草学报,2012, 18(4): 51-55.
CHEN Yongzhen, YANG Yi, LU Yanhui, et al. Dynamic distribution of endophytic bacteria and their antagonism toin tobacco plant in Guangxi[J]. Acta Tabacaria Sinica, 2012, 18(4): 51-55.
[38] Sattar A, Naveed M, Ali M, et al. Perspectives of potassium solubilizing microbes in sustainable food production system: A review[J]. Applied Soil Ecology, 2019, 133: 146-159.
[39] Mastretta C, Taghavi S, Vander-Lelie D, et al. Endophytic bacteria from seeds ofcan reduce cadmium phytotoxicity[J]. International Journal of Phytoremediation, 2009, 11(3): 251-267.
[40] Bodenhausen N, Bortfeld-Miller M, Ackermann M, et al. A synthetic community approach reveals plant genotypes affecting the phyllosphere microbiota[J]. PLoS Genet, 2014, 10: e1004283.
[41] 黄晓辉,杨友才,谭周进,等. 四个品种烟草内生微生物的分布特征[J]. 生态学报,2009, 29(12): 6827-6833.
HUANG Xiaohui, YANG Youcai, TAN Zhoujin, et al. Distribution characteristic of endophytic microbes in four different tobacco species[J]. Acta Ecologica Sinica, 2009, 29(12): 6827-6833.
[42] 胡日查,孙志宏,张和平. 普拉梭菌的生物学特性及其与宿主的相互作用[J]. 中国食品学报,2020, 20(7): 307-316.
HU Richa, SUN Zhihong, ZHANG Heping. Biological characteristics ofand its interaction with the host[J]. Journal of Chinese Food Science, 2020, 20(7): 307-316.
Community structure and diversity of endophytic bacteria in tobacco variety Zhongchuan 208
GAO Jianing1, ZHANG Dan2*, YANG Junwei3
1 College of Tourism and Geographical Science, Leshan Normal University, Leshan 614000, China;2 Institute of Mountain Hazards and Environment, Chinese Academy of Sciences, Chengdu 610041, China;3 Panzhihua Branch of Sichuan Tobacco Company, Panzhihua 617061, China
Zhongchuan 208 is a novel flue-cured tobacco variety with good quality, economic prospects, and disease and stress resistance, which is predominantly grown in Southwest and central parts of China. This study aims to investigate the bacterial community structure and species diversity constituents in Zhongchuan 208’s four organs: namely, roots and above ground parts (stem, leaf and flower), and establish a basis of tobacco microbiome, in order to provide a knowledge base of exploiting and utilizing endophytic bacterial resources.The aforementioned parts of Zhongchuan 208 were used as research materials, and their high-throughput amplicon sequencing of V3-V4 fragment of bacterial 16S rRNA genes was conducted using the Illumina NovaSeq 6000 platform. The bacterial community structure and species diversity of different organs as well as the effects of plant nutrition on bacterial community were examined using bioinformatics.(1)There were 5460 amplicon sequence variants (ASVs) obtained from four samples of Zhongchuan 208, belonging to 19 phyla, 72 classes, 161 orders, 285 families and 389 genera. (2)The bacterial community diversity of different organs could be ranked in the order of root>stem≥flower>leaf. The Beta diversity analysis and clustering analysis indicated a high degree of similarity in the community composition of endophytic bacteria between root and leaf of Zhongchuan 208, but a significant difference was observed in that between flower and stem. (3) Proteobacteria and Actinobacteria were the dominant phyla of endophytic bacterial communities in roots, stems and leaves, while Firmicutes and Bacteroidetes had the highest relative abundance in flowers. LEfSe analysis showed that the bacterial community composition of Zhongchuan 208 was significantly different at the genus level, the bacterial community was mainly characterized by different endophytic bacteria such as,,,,,,,,,_UCG_014 andin stem, leaf and flower. (4) Redundancy analysis showed that the contents of total N (2= 0.730,< 0.001), total sugar (2= 0.883,< 0.001) and Mg (2= 0.907,< 0.01) in Zhongchuan 208 were strongly associated with the dominant bacterial communities found in these organs.The bacterial community diversity in Zhongchuan 208 decreased from roots to flowers, stem and/or leaves, and the species composition of endophytic bacterial communities in different organs was significantly different. There are many significantly enriched bacterial flora in plant organs of Zhongchuan 208, which are worthy of further research and exploitation.
Zhongchuan208; endophytic bacteria; community structure; diversit; plant compartment differentiation
. Email:daniezhang@imde.ac.cn
烟草钾素利用率提升关键技术及新型钾肥创制(SCYC202105)
高嘉宁(1993—),讲师,博士,主要研究领域:土壤微生物,Tel:13696145775,Email:2664259441@qq.com
张丹(1962—),研究员,博士,主要研究领域:环境微生物与土壤污染修复,Email:daniezhang@imde.ac.cn
2022-03-14;
2023-08-01
高嘉宁,张丹,杨军伟. 中川208烟草内生细菌微生物群落结构及其多样性[J]. 中国烟草学报,2024,30(1).GAO Jianing, ZHANG Dan, YANG Junwei. Community structure and diversity of endophytic bacteria in tobacco variety Zhongchuan 208[J]. Acta Tabacaria Sinica, 2024,30(1). doi:10.16472/j.chinatobacco.2023.031

