PCR法快速检测肉食品污染沙门菌的实验研究
赵玉玲,张天生,张巧艳
(1.河南省沁阳技术监督局检验测试中心,河南沁阳 454550;2.广西大学动物科学技术学院,广西南宁 530005)
沙门菌属(Salmonella)是肠杆菌科中一大类重要致病菌,感染畜禽后可引起一系列的疾病,成为畜禽肉胴体、畜禽产品污染的重要来源[1],并可通过各种途经传染给人,引起人的食源性疾病。在我国70%~80%细菌性食物中毒事件是由沙门菌引起,而引起沙门菌中毒的食品中,约90%是肉、蛋、奶等畜产品[2]。传统的检测方法是先采用非选择性和选择性培养基增菌,然后分离培养、生化反应和血清学鉴定等,检验程序十分繁琐,且肠杆菌科细菌间的生化反应多有交叉,需4~7 d才能完成,因此传统的检测方法在快速、敏感与特异性等方面有自身的局限性[3]。本研究应用传统的生化鉴定的方法对受试菌株进行了鉴定,同时根据编码沙门菌毒力蛋白基因结构特点,成功地建立了沙门氏菌的PCR检测方法,通过对比为沙门菌的检测提供了更快速、敏感的方法。
1 材料与方法
1.1 材料
1.1.1 受试菌株 来自某生猪屠宰场生猪胴体体表和肌肉样品中分离的可疑沙门菌4株。
1.1.2 对照菌株 本研究室保存的鼠伤寒沙门菌C77-31菌株。
1.1.3 试剂及培养基 buffer、dNTPs、Taq酶、低分子量PCR Marker,购自广州东盛生物工程公司。细菌培养基包括肉汤增菌液、三糖铁琼脂、选择培养基和生化鉴定管等,均按国标配制或购自上海生工公司。
1.1.4 仪器 自动摇床(ZD-9556ZD)、电泳仪(B IORAD PowerPacBasicT M)凝胶成像分析系统(uV I)、PCR仪(PE2400)。
1.1.5 引物的设计 根据已发表的鼠伤寒沙门菌侵袭基因invA的核苷酸序列,应用AB I公司提供的Pr imer express 2.0软件设计出引物,上游的引物:5′-GTGAAATTATCGCCACGTTCGGGCAA-3′;下游的引物:5′-TCATCGCACCGTCAAAGGAACC-3′。引物扩增片段的理论跨幅大小为284 bp,引物由上海生工公司合成。
1.2 方法
1.2.1 沙门菌的初步鉴定试验 从BS平板上挑取可疑菌落,革兰染色、镜检,并接种三糖铁琼脂(TSI)(先在斜面上划线,再穿刺底层)、尿素酶琼脂和赖氨酸脱羧酶,在温度(36±1)℃下培养18~24 h。
1.2.2 生理生化试验 挑取TSI培养物,接种ONPG、氰化钾、尿素、枸橼酸盐、丙二酸盐、赖氨酸脱羧酶、鸟氨酸脱羧酶、葡萄糖、蔗糖、木糖、甘露醇、乳糖等微量发酵管,在温度(36±1)℃下培养24~48 h。
1.2.3 PCR鉴定 取待检菌株和对照菌株于肉汤增菌液1 mL置于Eppendorf管中,37℃摇床3 h后,离心收集菌体,用灭菌蒸馏水洗涤2次,最后用1 mL蒸馏水悬浮,隔水煮沸15 min,8 000 r/min离心15 min,取上清,即成DNA模板溶液。PCR反应体积50μL,10×PCR buffer 5μL,dNTPs(2.5 mol/L)4μL,上游引物和下游引物(5 mol/L)各2.5μL,模板溶液7.5μL,Taq酶(3 U/μL)0.7μL,三蒸水27.8μL。PCR循环参数:94℃预变性5 m im;94℃变性45 s,60℃返火45 s,72℃延伸5 min,经32个循环,最后72℃保温10 min。配制1%琼脂糖溶液,按0.5 mg/L加溴化乙啶(EB)制胶,取5μL PCR产物点样,用PCR Marker作对照,40 V电泳1 h。取出凝胶,置紫外灯下观察,用uV I凝胶成像分析系统进行分析[4-6]。
2 结 果
2.1 培养及菌体形态特征
在普通琼脂培养基上生长良好,培养24 h后,形成中等大小、圆形、表面光滑、无色半透明、边缘整齐的菌落,在鉴别培养基上(麦康凯、SS、伊红美兰)为无色菌落,在三糖铁琼脂斜面:斜面为红色,底部变黑并产气,该分离菌在BS琼脂上呈黑色,带有金属光泽。菌落周围的培养基呈褐色,伴随培养时间的延长而变为黑色,并有所谓的晕环效应。
2.2 生理生化试验
从平板上挑去对照菌落和可疑的待检菌落(编号分别为1、2、3、4),将菌落接种于生化鉴定管中于37℃恒温箱中培养1~7 d,结果如表1。参照《临床细菌学》(李仲兴等主编)具体指标,可推断该4株菌均为沙门菌阳性。
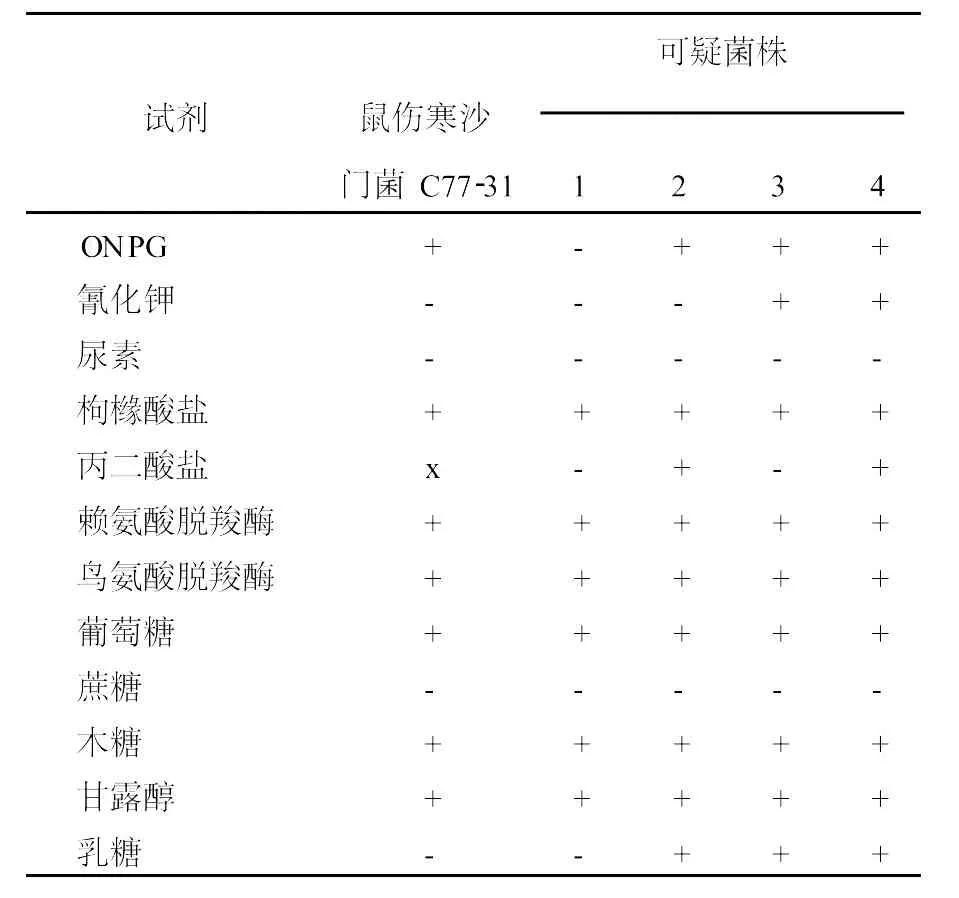
表1 沙门氏菌生化试验结果Table 1 Biochemical characteristics of theBacterialstrain
2.3 沙门菌侵袭性基因invA的PCR扩增
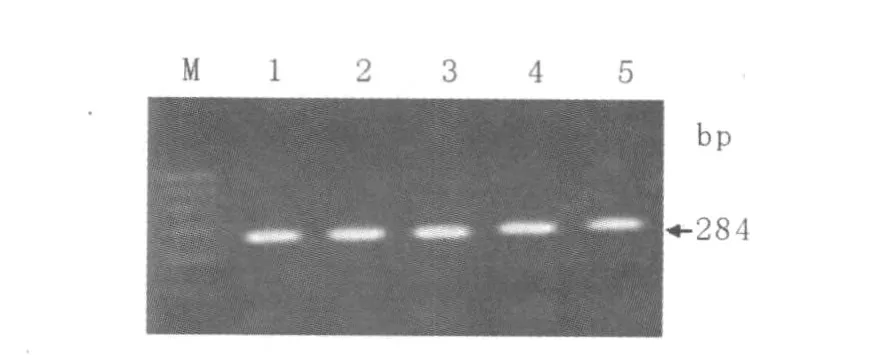
图1 沙门菌invA基因片段扩增产物电泳图谱Fig.1 Agrose electrophoresis of invA in Salmonella
检测了鼠伤寒沙门菌C77-31菌株(1)和4株可疑沙门菌菌株(2、3、4、5),图1显示了引物的特异性实验结果,invA扩增片段为284 bp。结果均出现了与理论值大小相等的条带。
3 讨 论
沙门菌是肠杆菌科中的一个重要菌属,是人和动物的常见病原菌,可引起人类多种疾病。如食物中毒、胃肠炎、菌血症、肠热症等。随着社会的发展和人类文明的进步,人们对食物品质的要求越来越高,因此准确、快速地检测食品中的沙门菌,对于预防人类沙门菌污染具有十分重要的意义。
本研究中沙门菌检验方法首先是依靠传统的方法,采用细菌分离、生化鉴定等表型方法,所需试剂繁多、过程烦琐、费时费力,并且肠杆菌科细菌间的生化反应多有交叉,因此,表型检测方法在快速、敏感与特异性等方面有自身的局限性。为了有效地预防和控制食品传播疾病,建立快速、敏感及特异性地检测食品中沙门菌的方法,就显得非常必要了。
对比传统方法,本研究检测采用PCR检测方法,大大节约了检测时间。在检测沙门菌的灵敏度时用所提取的DNA样品,便于灵敏度分析。用PCR技术检测猪肉中的沙门菌,结果具有高度的特异性和敏感性。本试验对可疑被沙门菌污染的样品都可检测出来;说明PCR方法用于检测猪肉中的沙门菌,结果可靠。同时DNA模板浓度只有0.01 pg还能扩增出特异带,说明PCR方法灵敏度高。
自从PCR及其改进技术用于微生物检测以来,这一快速、灵敏且特异的方法从DNA分子水平的角度为检测致病菌提供了有效的手段。在今后的应用中,可进一步完善,结合其他技术以提高其敏感性和特异性,可与免疫磁珠颗粒分离技术结合;也可与PCR有关的分型鉴定技术结合,使结果的判定更为精确。总之,随着这一方法的不断完善,其研究会更深入,应用范围会更加广泛,在微生物检测领域将发挥更大的作用[7]。
[1] 郭胜利.136起食物中毒分析[J].海峡预防医学杂志,1999,3(1):32.
[2] 赵贵,张华.畜产品中沙门氏菌的危害及检测方法概述[J].贵州畜牧兽医,2004,28(3):21-22.
[3] 陈金顶,索青利,廖明,等.沙门氏菌的invA基因的序列分析与分子检测[J].中国人畜共患病杂志,2004,20(10):868-871.
[4] 文其乙.沙门氏菌的基因分型和指纹图谱分析及其在分子流行病学中的应用[J].中国畜禽传染病,1994,6:57-59.
[5] 黄金林,焦新安,文其乙,等.应用聚合酶链反应快速检测沙门氏菌[J].扬州大学学报(农业与生命科学版),2002,23(3):5-7.
[6] 黄金林,焦新安,刘佩红,等.PCR快速检测沙门氏菌试剂盒的研制与应用[J].中国公共卫生,2004,20(4):451-452.
[7] 杨小鹃,吴清平,张菊梅,等.畜禽肉沙门菌和大肠杆菌O157多重PCR检测研究[J].微生物学通报,2008,35(3):470-474.

