单核细胞增生李斯特菌精氨酸脱亚胺酶基因的克隆及原核表达*
程昌勇,陈健舜,赵寒昕,白 帆,方维焕
(浙江大学动物预防医学研究所,浙江省动物预防医学重点实验室,浙江杭州 310029)
单核细胞增生李斯特菌精氨酸脱亚胺酶基因的克隆及原核表达*
程昌勇,陈健舜,赵寒昕,白 帆,方维焕*
(浙江大学动物预防医学研究所,浙江省动物预防医学重点实验室,浙江杭州 310029)
精氨酸脱亚胺酶(AD I)可能介导单核细胞增生李斯特菌抗酸应激,由arcA基因编码。利用分子克隆技术从单核细胞增生李斯特菌10403S扩增得到AD I基因,测序正确后将其插入p ET30a表达载体中,构建该基因的原核表达质粒p ET30a-AD I,并转化入大肠埃希菌Rosetta中进行诱导表达。核苷酸序列分析显示,AD I基因的完整开放阅读框为1 233 bp,编码410个氨基酸。SDS-PAGE表明:该基因在大肠埃希菌中成功表达,重组蛋白的分子质量约为52.5 ku。为进一步研究精氨酸脱亚胺酶的活性提供了条件,同时也为探索单核细胞增生李斯特菌抗酸应激的机理奠定了重要的基础。
单核细胞增生李斯特菌;arcA基因;精氨酸脱亚胺酶;原核表达
单核细胞增生李斯特菌(Listeria m onocy togenes)是重要的食源性人兽共患病原菌,可引起脑膜炎、败血症、流产等症状,死亡率高达30%。单核细胞增生李斯特菌为世界公共卫生学上最重要的食源性病原菌之一。
低p H环境是食源性病原菌最常遇到的不利因素之一,如酸性食品、消化道、巨噬细胞的吞噬体以及外界环境的p H变化。因此,抗酸应激能力是单核细胞增生李斯特菌建立感染的前提,进而侵入细胞并在胞内生存和增殖。
铜绿假单胞菌[2]、乳酸乳球菌、化脓链球菌、肺炎链球菌与口腔链球菌等均存在精氨酸脱亚胺酶(A rginine deiminase,AD I)系统。AD I能够催化精氨酸水解成瓜氨酸和氨,接着瓜氨酸经AD I系统中另外两个酶——鸟氨酸氨甲酰转移酶(OTC)和氨甲酰激酶(CK)的催化而转化成鸟氨酸、氨和CO2。氨与 H+结合为NH4+,提高细菌胞质中的p H,从而在一定程度上保护细胞免受胞外酸性因素的刺激。
Ryan S等[6]发现单核细胞增生李斯特菌亦含有AD I系统(lmo0036-lmo0043),并在细菌水平上验证了精氨酸脱亚胺酶的活性。本课题组[7]发现除AD I外,该系统的其他成员(如OTC、CK)特异性存在于单核细胞增生李斯特菌谱系Ⅰ和Ⅱ以及伊氏李斯特菌(Listeria ivanoii)中。其中lmo0038已被证明与细菌抵抗酸、热应激相关。
本实验室针对AD I代谢途径中的核心酶AD I,进行分子克隆与表达,构建高效重组表达载体,以期为研究单核细胞增生李斯特菌的AD I生物学活性并探索细菌抗酸应激机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 单核细胞增生李斯特菌标准菌株10403S、大肠埃希菌DH5α和 Rosetta均由本实验室保存;pMD18-T质粒购于宝生物工程(大连)有限公司;p ET30a表达载体质粒由本实验室保存。1.1.2 酶及相关试剂TaqDNA polymerase、DNA连接酶、限制性内切酶、IPTG均购至宝生物工程(大连)有限公司;DNA Ladder M arker购自广州东盛生物科技有限公司;dN TP M ix购自上海申能博彩生物科技有限公司;质粒抽提试剂盒、DNA割胶回收试剂盒购自上海生工有限公司;核酸电泳染料Goldview购自塞百盛生物公司;引物合成和测序均由上海英骏生物技术有限公司完成。
1.1.3 培养基 LB培养基(10 g/L胰蛋白胨,5 g/L酵母提取物,10 g/L氯化钠,p H7.4)。
1.2 方法
1.2.1 基因组DNA的制备 基因组抽提采用煮沸法。5 000 rpm离心收集细菌沉淀后用等体积的TZ和蒸馏水重悬,-20℃静置45 min,接着沸水中煮10 min,立即置冰浴冷却10 min,离心后取上清保存于-20℃以备用。
1.2.2 AD I基因引物设计及 PCR扩增 根据GenBank中发布的 AD I基因序列(Gene ID:985417),运用DNA Star软件设计针对该基因ORF的特异性引物,并在上、下游引物分别引入EcoRⅠ和SalⅠ酶切位点。上下游引物序列如下(下划线部分表示酶切位点):

PCR扩增体系和程序:采用30μL反应体系:10×PCR Buffer(M g+2Plus)3μL,dN TP M ix 0.6μL,上下游引物各0.6μL,TaqDNA Polymerase 0.8μL,加双蒸水补齐体积。反应条件:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸70 s,30个循环;72℃延伸10 min。PCR产物回收、纯化均按照试剂盒说明进行操作。
1.2.3 PCR产物的克隆与鉴定 将回收的AD I基因片段与pMD18-T载体于4℃C连接过夜,转化感受态DH5α中。抽提质粒后用 PCR方法筛选和鉴定阳性重组质粒,并命名为pMD18-T-AD I。选取阳性质粒送往上海英骏生物技术有限公司测序,测序结果与 GenBank中发布的AD I基因序列进行比较分析。
1.2.4 重组ADI基因表达载体的构建与表达分析
用EcoRⅠ和SalⅠ分别酶切阳性重组质粒pMD18-TADI和表达载体p ET30a,并进行纯化。回收的ADI片段与表达载体加入DNA连接酶,于4℃反应过夜。连接产物转化E.coliDH5α感受态细胞,筛选出阳性重组表达质粒,命名为p ET30a-ADI。
1.2.5 AD I基因在大肠埃希菌中的诱导表达 将构建好的重组表达质粒p ET30a-AD I及空质粒p ET30a分别转化E.coliRosetta中,筛选单个阳性克隆37℃过夜培养;过夜培养细菌以1∶100扩大培养于200 m L LB培养基(含100μg/m L卡那霉素)中,OD600达0.4~0.6时,加入 IPTG至终浓度为0.4 mM,37℃继续培养,诱导表达3 h~4 h。同时以诱导含空质粒p ET30a的E.coliRosetta作为对照。
1.2.6 SDS-PAGE分析 分别取1 m L含重组表达质粒p ET30a-AD I和含空质粒p ET30a的表达产物,6 000 r/min离心10 min收集菌体。加入适量PBS(50 mmol/L,p H7.4)洗涤2次后,再用 PBS重悬细菌,超声破碎细胞(300 W,4 s/4 s,99次)后,12 000 r/m in离心10 m in,分别取上清和沉淀进行SDS-PA GE试验。
2 结果
2.1 目的基因AD I的PCR扩增
以单核细胞增生李斯特菌标准菌株10403S为模板,PCR扩增AD I基因,获得大小为1 200 bp左右的特异性条带,与已知的AD I基因片段大小一致(图 1)。
2.2 AD I序列测定与分析
测序结果表明,扩增得到的AD I基因片段大小为1 233 bp,包括了起始密码子A TG和终止密码子TAG的完整ORF,编码410个氨基酸,分子质量约为47.1 ku。与 GenBank中发布的单核细胞增生李斯特菌EGD-e的AD I基因序列进行比较,两者的核苷酸同源性为99.8%,氨基酸同源性亦为99.8%。
2.3 重组质粒pMD18-T-AD I的鉴定
构建好的重组质粒pMD18-T-AD I通过 PCR扩增和酶切分析进行鉴定。PCR扩增得到1 200 bp左右的特异性条带;用EcoRⅠ和SalⅠ双酶切得到大于2 000 bp的pMD18-T载体的片段和1 200 bp左右的AD I片段(图2)。
2.4 重组表达载体p ET30a-AD I的鉴定
构建好的重组表达质粒p ET30a-AD I随机挑取3个~4个阳性克隆,试剂盒抽取质粒后进行 PCR鉴定。PCR扩增得到1 200 bp左右的特异性条带,与前期的鉴定结果一致(图3)。
2.5 重组菌表达表达产物的SDS-PA GE分析
单核细胞增生李斯特菌 EGD-e的AD I分子质量约为47.1 ku,与 His标签融合后的表达产物约为52.5 ku。SDS-PAGE分析结果表明:阳性重组质粒p ET30a-AD I转化菌经0.4 mM IPTG诱导后,超声破碎细胞,分别收集上清和沉淀做可溶性分析,蛋白电泳显示,在约50 ku处表达出很浓的条带(箭头标出),与预期重组蛋白的大小基本一致,并且该重组蛋白主要以不溶性包涵体形式存在,上清中几乎看不到条带;以含空质粒p ET30a的重组菌做对照,经IPTG诱导后则无目的蛋白的表达(图4)。
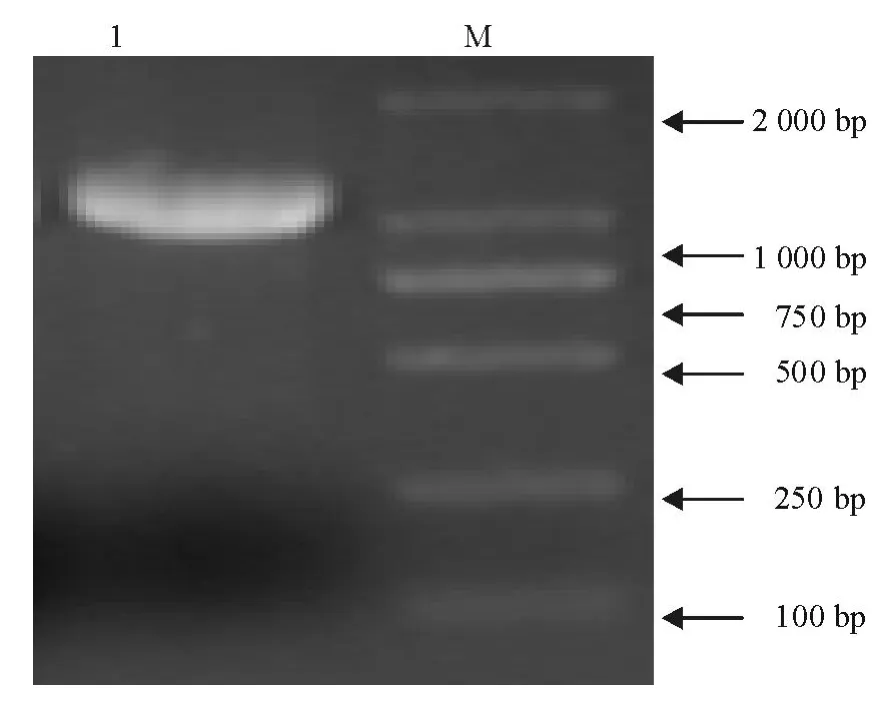
图1 AD I基因扩增电泳图Fig.1 Amplification of ADIgene by PCR

图2 重组质粒pMD18-T-AD I的PCR及酶切鉴定Fig.2 Identification of recombinant plasmid pMD18-T-ADIby PCR and enzyme restriction

图3 重组表达质粒p ET30a-AD I的PCR鉴定Fig.3 Identification of recombinant exp ression plasmid p ET30a-ADIby PCR

图4 重组精氨酸脱亚胺酶的SDS-PAGE分析 Fig.4 SDS-PAGE analysis of recombinant arginine deiminase
3 讨论
单核细胞增生李斯特菌对环境耐受性强,可在较高的盐浓度(10%NaCl)以及宽泛的p H(p H4.5-9)和温度范围(0℃~45℃)内生长,因而单核细胞增生李斯特菌广泛存在于自然界(包括土壤、水源、植物及动物体等),易污染各种食品(肉、奶、海产品及蔬菜等)。从上世纪80年代起,欧洲、北美等地多次因食品污染而暴发人李斯特菌病。针对单增李斯特的抗应激特别是抗酸应激的研究日益成为热点。
AD I系统存在于多种革兰阳性菌与革兰阴性菌中[6]。Degnan B A等[9]以及 Gruening PM等[10]推断该系统可能与细菌抗酸应激相关。张金秋等[11]、李振伟等[12]也分别报道了猪链球菌和变性假单胞菌中AD I的存在,并在体外表达了该酶以研究其活性。在精氨酸脱亚胺酶系统中,AD I发挥着重要的作用,它能够催化精氨酸转化为瓜氨酸,同时生成NH 3和A TP。N H3可提高环境中p H值从而增强细菌抵抗酸性环境的能力,而此过程中产生的A TP则可以为细菌的生命活动提供能量。
单核细胞增生李斯特菌的AD I系统也被推测与抗酸应激有关。本课题组[7]发现了lmo0038基因(AD I系统中的一个基因)在抗酸、热应激方面有着重要作用。但在国内外迄今未有体外表达单核细胞增生李斯特菌的AD I并研究其生物学活性的报道。本试验选择p ET质粒对编码精氨酸脱亚胺酶的AD I基因进行原核表达,SDS-PAGE证实了该基因在大肠埃希菌中获得高效表达,但是表达产物主要以没有生物活性的包涵体形式存在。我们尝试改变诱导温度、IPTG浓度等条件都不能改善该蛋白的可溶性表达,这对进一步探索该酶活性造成了一定的影响。但根据报道,已有多种不同来源的AD I通过原核表达并经蛋白复性测得该类酶的活性[13-15],我们尝试在单核细胞增生李斯特菌中利用蛋白复性的方法对表达出来的AD I进行复性,以深入研究该酶的特性和功能,为揭示单核细胞增生李斯特菌的抗酸应激机制奠定基础。
[1] Low J C,Donachie W.A review ofListeria monocytogenesand listeriosis[J].Vet J,1997,153(1):9-29.
[2] Bourdineaud J P,HeierliD,Gamper M,et al.Characterization of the arcD arginine:ornithine exchanger ofPseudomonas aeruginosa.Localization in the cytop lasmic membrane and a topologicalmodel[J].J Biol Chem,1993,268(8):5417-5424.
[3] Budin-Verneuil A,Maguin E,Auffray Y,et al.Genetic structure and transcriptional analysis of the arginine deiminase(ADI)cluster inLactococcus lactisM G1363[J].Can J Microbiol,2006,52(7):617-622.
[4] Dong Y,Chen Y Y,Snyder J A,et al.Isolation and molecular analysis of the gene cluster for the arginine deiminase system from Strep tococcus gordonii DL 1[J].App l Environ M icrobiol,2002,68(11):5549-5553.
[5] Zuniga M,Perez G,F Gonzalez-Candelas.Evolution of arginine deiminase(AD I)pathway genes[J].Mol Phylogenet Evol,2002,25(3):429-444.
[6] Ryan S,Begley M,Gahan C G,et al.Molecular characterization of the arginine deiminase system inListeria monocytogenes:regulation and role in acid tolerance[J].Environ Microbiol,2009,11(2):432-445.
[7] Chen J,Jiang L,Chen Q,et al.lmo0038 is involved in acid and heat stress responses and specific forListeria monocytogeneslineages I and II,and Listeria ivanovii[J].Foodborne Pathog Dis,2009,6(3):365-376.
[8] Gandhi M,Chikindas M L.Listeria:A foodborne pathogen that know s how to survive[J].Int J Food M icrobiol,2007,113(1):1-15.
[9] Degnan B A,Fontaine M C,Doebereiner A H,et al.Characterization of an isogenic mutant ofStreptococcus pyogenesManf redo lacking the ability to make streptococcal acid glycop rotein[J].Infect Immun,2000,68(5):2441-2448.
[10] Gruening P,Fulde M,Valentin-Weigand P,et al.Structure,regulation,and putative function of the arginine deiminase system ofStrep tococcus suis[J].J Bacteriol,2006,188(2):361-369.
[11] 张金秋,陆承平.猪链球菌国内分离株精氨酸脱亚氨酶的克隆表达及其活性分析[J].微生物学报.2007,47(5):860-864.
[12] 李振伟,倪 晔,郑 璞,等.变形假单胞菌精氨酸脱亚胺酶基因序列分析及其表达载体构建[J].工业微生物,2008(4):1-6.
[13] Misawa S,Aoshima M,Takaku H,et al.High-level exp ression ofM ycop lasma argininedeiminase inEscherichia coliand its efficient renaturation as an anti-tumo r enzyme[J].J Biotechnol,1994,36(2):145-155.
[14] Park IS,Kang SW,Shin Y J,et al.A rginine deim inase:a potential inhibitor of angiogenesis and tumour grow th[J].Br J Cancer,2003,89(5):907-914.
[15] Beloussow K,Wang L,Wu J,et al.Recombinant arginine deiminase as a potential anti-angiogenic agent[J].Cancer Lett,2002,183(2):155-162.
Clon ing and Prokaryotic Expression of Argin ine Deim inase fromListeria m onocy togenes
CHENG Chang-yong,CHEN Jian-shun,ZHAO Han-xin,BA IFan,FAFNGWei-huan
(Institute of Preventive Veterinary M edicine of Zhejiang University and Zhejiang
Provincial Key Laboratory of Preventive Veterinary M edicine,Hangzhou,Zhejiang,310029,China)
A rginine deim inase(AD I),encoded by arcA,is one of the most impo rtant enzymes involved in acid tolerance ofListeria m onocy togenes.The AD Igene was amp lified fromL.monocy togenes10403S and cloned into pMD18-T vecto r.Sequence analysis show ed that the full length AD Igene w as 1 233 bp,encoding 410 amino acids.The gene fragment was then subcloned into p rokaryotic exp ression vector p ET30a,yielding recombinant exp ression p lasmid p ET30a-AD I,and transformed into competentE.coliRosetta cells.Exp ression of the target p rotein was induced w ith IPTG.SDS-PAGE showed a specific p rotein band w ith a mass w eight of 55.2 ku.Successful exp ression of AD I inE.colip rovides possibilities fo r further study of the enzyme activity and its role in acid tolerance mechanism ofL.monocytogenes.
Listeria monocytogenes;arcA gene;arginine deim inase;p rokaryotic exp ression
Q789
A
1007-5038(2010)04-0070-04
2010-03-23
“十一五”国家科技支撑计划重点项目(2009BADB9B09)
程昌勇(1988-),安徽绩溪人,硕士研究生,主要从事微生物与食品安全研究。*通讯作者

