一株致仔猪关节炎粪肠球菌的鉴定*
王亚宾,胡清林,陈丽颖,程金平,陈小丽,崔保安
(河南农业大学牧医工程学院,河南郑州450002)
肠球菌是一种重要的条件致病菌[1]。近年来,由于肠球菌感染动物报道不断增多[2-10],尤其是耐药性的不断增加[11-12],该细菌逐渐引起人们的重视。以前的研究发现猪感染粪肠球菌主要引起败血症,但国内外尚未见有引起关节炎的报道。2008年10月,我们接检了河南洛阳送检的一头仔猪,病猪除了跗关节肿大外,饮食、精神状况和体温等均未见异常,剖开患猪的发病关节,可见有多量的稀薄脓液。经细菌分离纯化、生化特性鉴定及16 S rRNA序列测定,最终确定为粪肠球菌感染,现将结果报告如下。
1 材料与方法
1.1 菌株
临床分离株为2008年10月河南洛阳送检的一例关节肿大的病猪,无菌采取其关节液分离纯化后,命名为HE43。粪肠球菌参考菌株ATCC29212、ATCC33186和CMCC(B)32223均由广东环凯微生物科技有限公司惠赠,所有菌株加入50%甘油后由本实验室于—70℃保存备用。
1.2 主要仪器和试剂
Vitek-32全自动细菌鉴定系统、革兰氏阳性细菌鉴定卡(GPI;生产批号:B56K),均为法国生物梅里埃中国有限公司产品。PCR仪:Bio-rad:PTC—200型扩增仪;DYY-6C型电泳仪,北京市六一仪器厂产品。溶菌酶购自上海伯奥生物科技有限公司;2×PCR TaqMix购自北京美莱博医学科技有限公司;pTG19-T载体购自上海捷瑞生物工程有限公司;胶回收试剂盒、Proteinase K、琼脂糖、X-gal、IPTG、限制性内切酶BamHⅠ和DNA Marker均购自宝生物工程(大连)有限公司;酚∶氯仿∶异戊醇(25∶24∶1)购自瑞兴科技有限公司;基因工程菌E.coli DH5α由河南农业大学微生物实验室保存。胰蛋白胨大豆肉汤(TSB;生产批号200704038)、脑心萃取液态培养基(BHI;生产批号:200704102),均系广东环凯微生物科技有限公司产品,均按说明书配制;胰蛋白胨大豆鲜血琼脂平板,按5%的鲜血量加入到胰蛋白胨大豆琼脂培养基自配而成。
1.3 药敏纸片
青霉素(10单位/片)、氨苄西林(10 μ g/片)、红霉素(15 μ g/片)、诺氟沙星(10 μ g/片)、万古霉素(30 μ g/片)、替考拉宁(30 μ g/片)、卡那霉素(30 μ g/片)、四环素(30μ g/片)、头孢噻肟(30 μ g/片)、利富平(5 μ g/片)、左氟沙星(5 μ g/片)、呋喃妥因(300 μ g/片)、先锋霉素V(30 μ g/片)、新霉素(30 μ g/片)、强力霉素(30 μ g/片)、氯霉素(30 μ g/片)、丙氟哌酸(5 μ g/片)、多黏菌素B(300单位/片)、磷霉素(200μ g/片)、链霉素(300 μ g/片)、庆大霉素(120 μ g/片),系杭州微生物试剂有限公司产品。
1.4 细菌特性观察
无菌取病猪的关节液直接接种于普通琼脂平板和脑心萃取液琼脂平板,37℃温箱微厌氧培养24 h。同时取病关节液和琼脂平板上培养的细菌典型菌落涂片,革兰染色后镜检。细菌纯化后,接种6.5%NaCl肉汤、pH9.6肉汤,观察其耐盐和耐酸碱度情况;并同时将纯培养物培养于10℃、45℃和60℃30 min的条件下,观察对温度的敏感情况。
1.5 溶血和明胶溶解试验
将分离纯化的各菌株分别划线接种于50 mL/L兔鲜血平板上,37℃培养24 h后观察结果。明胶溶解试验:将各菌株点种在30 g/L的明胶琼脂平板上,35℃培养24 h后观察结果。
1.6 Vitek-32全自动生化鉴定
取保存菌种接种到BHI中增菌培养后,再接种到BHIA平板上,经24 h培养后挑取典型菌落用4.5 g/LNaCl灭菌盐水配制成0.6~0.7麦氏单位,利用负压进样到革兰阳性细菌鉴定卡中,并放入Vitek-32全自动细菌鉴定系统的孵化箱中,进行鉴定。
1.7 药敏试验
采用纸片扩散法。将各菌株接种于TSA琼脂平板,37℃培养18 h,然后用4.5 g/L的盐水冲洗TSA琼脂平板上的纯培养菌落,并调整浊度到0.5麦氏单位。用无菌棉拭子蘸取菌液,在管壁上挤压去掉多余菌液。用棉拭子涂布整个BHIA培养基表面,待菌液稍干燥后,将药敏制片紧贴平板表面,每个平板5张药敏片,37℃培养24 h,观察结果。
1.8 16 S rRNA基因的PCR扩增与测序
参照文献[13-14]设计通用引物,正向引物F为5′-CCGAAT TCGTCGACAACAGAGT TTGATCATGGCTCAG-3′,反向引物R为5′-CCC GGGATCCAAGCTTACGGT TACCT TGTTACGACTT-3′,其中正向引物F含有EcoRⅠ和SalⅠ酶切位点,反向引物R含有BamHⅠ和HindⅢ酶切位点,预计扩增片段为1 500 bp。PCR反应按照Messick[15]的方法进行,反应体系的总体积为50 μ L(2×PCR TaqMix 10 μ L(0.2U Taq DNA Polymerase/μ L;400 μ mol/L dNTP each;20 mmol/L T ris-HCl,pH8.7;100 mmol/L KCl;3 mmol/L MgCl2);正向、反向引物(20 pmol/μ L)各1 μ L;模板DNA 5 μ L,最后补充双蒸去离子水至50 μ L)。扩增程序如下:95℃预变性5 min;94℃30 s,54℃30 s,72℃2 min,35个循环;最后于72℃延伸10 min。用蒸馏水作为阴性对照。取10 μ L PCR产物,经琼脂糖凝胶电泳后用DNA凝胶回收试剂盒回收目的片段。
16 S rRNA扩增产物用pTG19-T载体连接,转化E.coli DH5α后,由北京博尚生物技术有限公司进行测序,测定的DNA序列以双链碱基互补的结果为准。测得的分离株16 S rRNA序列在NCBI上进行BLAST后,并同时与3株标准株和GenBank中已登陆的相关菌株的16 S rRNA基因序列进行同源性比较,采用基因分析软件DNAStar Version 5.0中的MegAlign进行同源性比较并绘制系统发育进化树。
1.9 仔猪的感染试验
试验仔猪购自郑州市某规模化猪场20日龄的6头健康仔猪,购回后随机分成2组,分别用于HE43的攻毒和对照试验。所有仔猪按要求进行饲养,经观察正常后进行试验。HE43分离菌首先接种兔鲜血平板,37℃24 h培养后,4℃条件下离心制成5×1010cfu/mL的菌液,用灭菌生理盐水稀释成1×1010cfu/mL浓度的菌液后,每只仔猪耳静脉注射3 mL,对照组注射3 mL的灭菌生理盐水
2 结果
2.1 分离菌的形态与培养特性
分离菌为卵圆形、G+,单个、成对或链状排列。关节液直接涂片镜检可见分离菌形态较小,链较长,可达20个~30个;而分离菌经培养后则形态较大,一般呈短链状,链的长度多为3个~4个。分离菌在BHIA琼脂平板上生长良好,37℃培养24 h即能长出灰白色、不透明、圆形、微凸、湿润、表面光滑、边缘整齐的露珠状小菌落,直径1.5 mm~2 mm;在普通琼脂平板上生长贫瘠,24 h后仅长出有针尖大小的菌落。分离菌可在65 g/L NaCl、pH 9.6的肉汤中以及10℃、45℃条件下生长,并可以耐受60℃、30 min的极端环境条件。
2.2 溶血和明胶溶解结果
分离株在30 g/L的明胶琼脂平板上35℃24 h培养,菌落周围均可以形成清楚的晕环。在兔血琼脂平板上,细菌可以溶解兔红细胞,并呈现α型溶血。
2.3 Vitek-32生化鉴定结果
分离菌经Vitek-32全自动细菌鉴定系统鉴定为粪肠球菌(E.faecalis),具体结果详见表1。
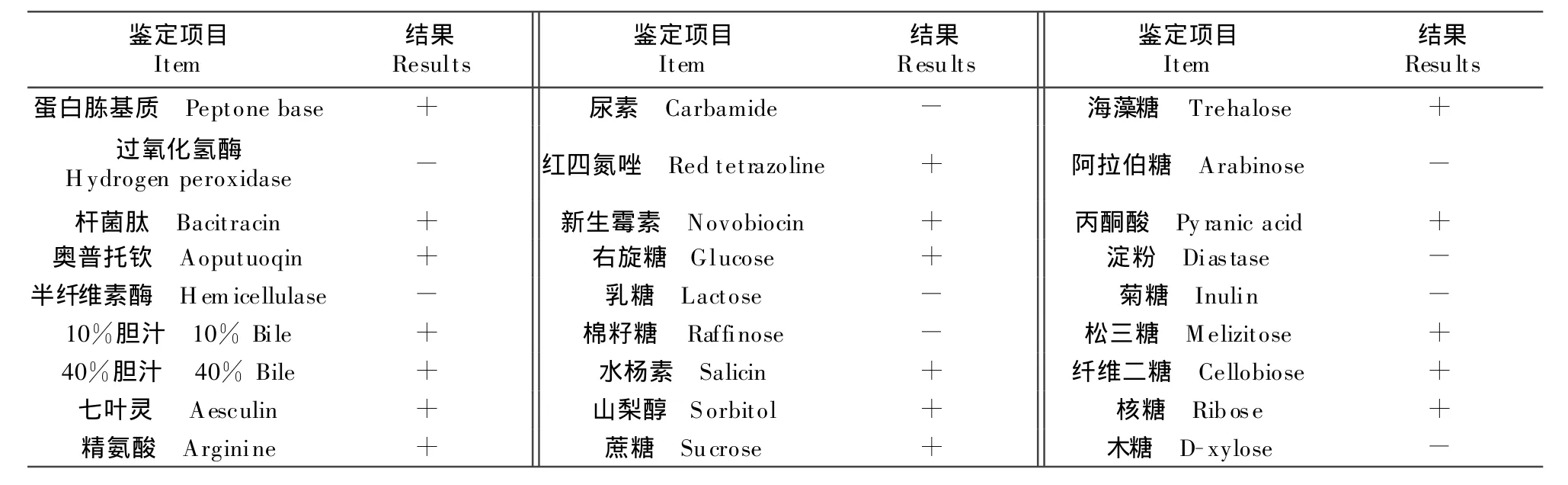
表1 分离菌株的Vitek-32全自动生化鉴定结果Table 1 The biochemical properties of the isolates identified by Vitek-32 automated sy stem
2.4 药敏试验
分离株的药物敏感试验结果见表2。药敏结果按美国临床实验室标准化协会(CLSI,2006)的标准进行判断。其中,卡那霉素判断标准参照红霉素,头孢唑林和头孢噻肟参照青霉素的标准。在21种临床常用药物中(氯霉素在兽医临床上已禁用,本次主要是根据CLSI建议做敏感性分析使用),分离株对包括万古霉素和替考拉宁在内的13种药物敏感,但对包括四环素、红霉素和卡那霉素在内的7种药物产生了耐药性。庆大霉素和链霉素高水平耐药现象虽未出现,但分离株对链霉素药物敏感性为中等。

表2 药敏试验结果Table 2 The results of drug sensitivity test
2.5 分离株16 S rRNA扩增和酶切鉴定
分离株及3株粪肠球菌标准菌株16 S rRNA基因PCR扩增及酶切鉴定结果见图1和图2。图1中可见分离株及3株标准菌株DNA均扩增到1 500 bp左右的16 S rRNA基因片段,与预期片段大小相符;图2中显示的是重组质粒BamHⅠ结果。
2.6 同源性分析和系统发育树构建
分离菌16S rRNA序列在GenBank中进行BLAST,结果分离菌与3株标准菌株和GenBank中登陆的粪肠球菌的16S rRNA序列同源性均在99.5%~100%之间,提取GenBank中部分粪肠球菌及与粪肠球菌生化分群在一群的相关肠球菌和3株粪肠球菌标准菌株16 S rRNA基因序列与分离菌构建系统发育树(图3),可见分离菌与GenBank中粪肠球菌和3株标准菌株同在一分支中,而与同群(生化分群)其他菌株亲缘关系较远。
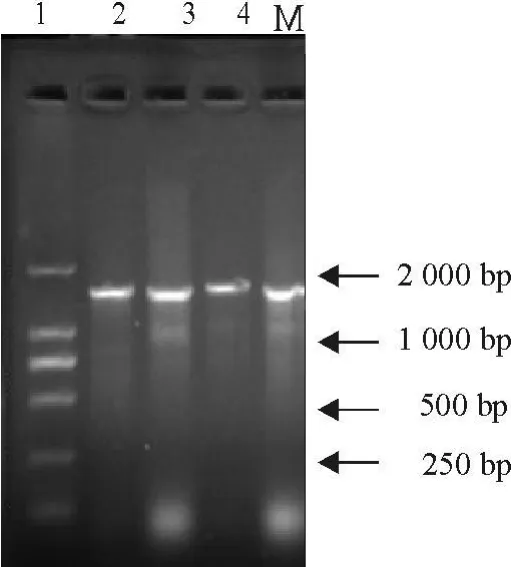
图1 分离菌及3株标准菌株PCR扩增结果Fig.1 PCR amplification results of 16 S rRNA of the isolates and 3 standard strains

图2 分离菌和3株标准菌株重组质粒鉴定结果Fig.2 Recombinant plasmid identification results of 16 S rRNA of the isolates and 3 standard strains
2.7 仔猪的感染试验
仔猪接种后,于第6天开始出现食欲减少,精神沉郁,呼吸困难,体温高达40.5℃~41℃,站立不稳,左后侧跗关节处手感稍热。至发病后第4天,未见试验猪死亡,随机将一头试验猪剖检,可见肝、肾、脾及淋巴结肿大、出血,左后侧跗关节有多量稀薄渗出液。从剖检猪关节渗出液和各实质脏器中均分离到了与接种菌一致的细菌。
3 讨论
本次从送检病猪的肿大的关节液中分离的一株菌株通过细菌涂片染色镜检、培养特性和耐性实验结果,均符合肠球菌的生理特征[16],经过Vitek-32生化试验鉴定和16 S rRNA基因序列分析证实该起仔猪关节炎是由粪肠球菌(E.faecalis)引起的。
16 S rRNA基因序列已被用作分子钟(molecular clock)来评估细菌间的相关性及鉴定未知细菌到属和种水平的手段[17],Vitek-32在鉴定非人源粪肠球菌中具有较高的准确性[18]。本次测定的分离株的16 S rRNA基因序列在NCBI上进行BLAST,其与NCBI上登载的粪肠球菌16S rRNA的序列同源性均在99%以上,包括ATCC29212在内的4株肠球菌通过16 S rRNA基因序列分析全部鉴定到种的水平,其中粪肠球菌分离株与3株标准菌株以及与GenBank公布的粪肠球菌序列同源性均在99.5%~100%之间。但在Vitek-32生化试验中,分离株与以前从感染猪内脏中分离的其他粪肠球菌对棉子糖、蔗糖、松三糖、乳糖和淀粉等反应结果不一致。

图3 16 S rRNA序列系统发育树Fig.3 Phylogenetic tree of 16 S rRNA sequence
肠球菌具有天然耐药和获得性耐药的能力,其对外界环境具有的较高抵抗能力和对药物的耐药性能力使其获得了在各种环境中较高的生存能力[19]。根据对21种临床药物的敏感性试验,分离株对7种药物产生了耐药性,但值得注意的是本分离株对同一类药物的耐药性也不相同,如对β-内酰胺类青霉素耐药,但对氨苄青霉素敏感;对四环素类的四环素耐药,但对强力霉素敏感;对氟喹诺酮类的诺氟沙星耐药,对左氟沙星和丙氟哌酸敏感等。因此,临床上治疗肠球菌感染时一定要进行药物的敏感性试验,以确定最佳治疗药物和避免更多的药物耐受性菌株产生。
肠球菌为一种重要的机会致病菌,主要存在于人和动物的肠道中。近几年来,由于免疫抑制性病毒如PRRSV和PCV-2感染的广泛性和抗生素使用的频繁性,使得肠球菌感染的机会逐渐增多。但以往报道粪肠球菌主要引起感染仔猪的败血症[20],未见引起关节炎的病例,本次引起仔猪关节炎的粪肠球菌的致病机理以及它的流行病学有关知识还有待于进一步研究。
[1] Kayaoglu G,O rstavik D.Virulence factors of Enterococcus faecalis:relationship toendodontis disease[J].Crit Rev Oral Biol Med,2004,15(5):308-320.
[2] Cheon D S,Chae C.Outbreak of diarrhea associated with Enterococcus durans in piglets[J].Journal of Veterinary Diagnostic Investigation,1996,8:123-124.
[3] Collins G E,Bergeland M E,Lindeman C J,et al.Enterococcus(Streptococcus)durans adher-ence in the small intestine of a diarrheic pup[J].Veterinary Pathology,1988,25:396-398.
[4] Devriese L A,Ducatelle R.,Uyttebroek E,et al.Enterococcus hirae infection and focal necrosis of the brain of chicks[J].Veterinary Record,1991a,129:316-317.
[5] KondoH,Abe N,Tsukuda K,etal.Adherenceof Enterococcus hirae to the duodenal epithelium of chicks with diarrhea[J].Avian Pathology,1997,26:189-194.
[6] Rogers D G,Zeman D H,Erickson E D.Diarrhea associated with Enterococcus durans in calves[J].Journal of Veterinary Diag nostic Investigation,1992,4:471-472.
[7] 陈一资,蒋文灿,胡 滨.对鸭场爆发罕见粪肠球菌病的研究[J].中国兽医学报,2003,23(4):324-325.
[8] 韩梅红,谷长勤,胡薛英,等.4株鸭源肠球菌的鉴定和致病性[J].中国兽医学报,2007,27(6):821-829.
[9] 齐亚银,剡根强,王静梅,等.致羔羊脑炎型粪肠球菌的分离及鉴定[J].石河子大学学报,2005,23(2):200-202.
[10] 华文久,耿民新,邱国璜,等.接触病猪引起屎肠球菌感染暴发流行40例临床报告[J].南通医学学报,1999,19(4):493.
[11] Brown D F J,Brown N M,Cookson B D,et al.National glycopeptide-resistant enterococcal bacteraemia surveillance[J].J Hosp Infect,2006,62:1-27.
[12] Peters J,Mac K,Wichmann-Schauer H,et al.Species distribution and antibiotic resistance patte-rns of enterococci isolated from food of animal origin in Germany[J].Int J Food Microbial,2003,88:311-314.
[13] Shukla J.16SrRNA PCR for differentiation of pathogenic and non-pathogenic leptospira isol-ate[J].Indian J Med Microbial,2003,21:25-30.
[14] Weisburg W G,Barns S M,Pelletier D A,et al.16S ribosomal DNA amplification for phylogen-etic study[J].Bacterial,1991,173(2):697-703.
[15] Messick J B,CooperS K,Huntley M.Development and evaluation of a ploymerase chain rea-ction assay using the 16S rRNA gene for detection of Epery throzoon suis infection[J].J Vet Diagn Invest,1999,11(3):229-236.
[16] Katie Fisher,Carol Phillips.The ecology,epidemiology and virulence of enterococcus[J].Microbiology,2009,155:1749-1757.
[17] Sacchi C T,Whitney A M,Mayer LW,et al,Sequencing of 16S rRNA gene:a rapid tool for identification of bacillus anthracis[J].Emerg Infect Dis,2002,8(10):1117-1123.
[18] 王亚宾,张红英,陈丽颖,等.16S rRNA与Vitek-32对临床感染猪肠球菌鉴定结果比较[J].中国农学通报,2009,25(6):9-12.
[19] Jett B D,Huy cke M M,Gilmore M S.Virulence of enterococci[J].Clin Microbiol Rev,1994,7:462-478.
[20] 王亚宾,陈丽颖,张红英,等.仔猪感染粪肠球菌的病原鉴定及病原特性初报[J].中国农学通报,2008,24(5):39-43.

