膜分离技术纯化花生衣中的原花色素
刘志强,张初署,孙 杰,于丽娜,张 岩,王世清,杨庆利,*
(1.山东省花生研究所,山东 青岛 266100;2.青岛农业大学食品科学与工程学院,山东 青岛 266109)
膜分离技术纯化花生衣中的原花色素
刘志强1,2,张初署1,孙 杰1,于丽娜1,张 岩2,王世清2,杨庆利1,*
(1.山东省花生研究所,山东 青岛 266100;2.青岛农业大学食品科学与工程学院,山东 青岛 266109)
以花生衣的原花色素提取液为原料,研究不同孔径的膜组件(NF-500、HPS-1、PS-5、PS-10)纯化原花色素提取液的效果。确定最佳纯化效果的膜组件,以及其不同操作压力、操作温度对纯化花生衣中原花色素得率和纯度的影响。结果表明:最佳纯化膜组件为HPS-1超滤组件,其操作压力0.54MPa,操作温度25℃,在此条件下,原花色素得率13.3%、纯度85.8%。
原花色素;花生衣;膜分离
花生衣为豆科植物花生种皮,红棕色膜质,味甘、微苦、性平,有止血散瘀和消肿之功效,在《本草纲目》和《中华药典》等书中均有记载[1-3]。花生衣中含有丰富的原花色素,其中50%左右为生物活性较高的低聚物[4]。原花色素作为天然抗氧化剂,以其极强的清除自由基能力和心血管系统活性在药品、保健品和化妆品中越来越受到人们的欢迎[5-6]。但是花生衣原花色素粗提液中含有蛋白质、糖类等杂质[7-9],这些成分的存在不仅影响色素的纯度,还影响其储藏的稳定性;同时未经纯化的花生衣原花色素达不到食品加工对其纯度要求。因此对原花色素提取液进行纯化才能达到贮藏和食品加工的要求。
膜分离是一种新兴的生化分离技术,是指借助膜的选择渗透作用,在外界能量或化学位差的推动下对混合物中溶质和溶剂进行分离、分级、提纯和富集,广泛应用于化工、食品、医药及废水处理等领域[10-12]。与传统分离技术相比,膜分离法不会发生相变,耗能少,不消耗化学试剂和添加剂,不会污染产品,而且膜分离生产过程可在常温封闭回路中进行,适合处理热敏性物质同时避免氧气氧化有效物质。该法在天然色素的提取中得到应用[13-15]。本研究以花生衣的原花色素提取液为原料,从膜组件的膜通量、原花色素得率和纯度角度出发,探讨膜分离的过程所需最佳膜孔径及该孔径下分离的最佳工作条件,为花生衣中原花色素的提取提供参考。
1 材料与方法
1.1 材料、试剂与仪器
花生衣 青岛东生集团股份有限公司;原花色素(≥98%) 上海融禾医药科技有限公司;香草醛(分析纯)天津博迪化工;盐酸、甲醇、无水乙醇(均为分析纯)。
RO-NF-UF-4050/4100/4010实验用膜分离装置/超滤器 上海摩速科学器材有限公司;膜组件(NF-500芳香聚酰胺膜、HPS-1聚砜膜、PS-5聚砜膜、PS-10聚砜膜、截留分子质量分别为500、1000、5000、10000D,膜面积为0.1m2);冷冻干燥机 北京博医康实验仪器有限公司;SHZ-3循环水多用真空泵 上海沪西分析仪器厂;SHA-B双功能水浴恒温振荡器 金坛市杰瑞尔电器有限公司;VDRTEX-5漩涡混合器 海门市其林贝尔仪器制造有限公司;FZ102型微型植物粉碎机 天津市泰斯特仪器有限公司;TU-1800S紫外分光光度计 北京普析通用仪器有限公司;TE212-L电子天平 德国赛多利斯股份有限公司;HH-4数显恒温水浴锅 国华电器有限公司。
1.2 方法
1.2.1 原花色素提取液制备
将花生衣在粉碎机中粉碎,按照1:20(g/mL)的比例加入石油醚30℃恒温水浴脱脂5h,之后进行抽滤,将得到的滤渣在通风橱中除去残留的石油醚,得脱脂花生衣[16]。采用超声波辅助法提取脱脂花生衣中原花色素,提取条件:超声波功率120W、提取温度35℃、提取时间5min、料液比9.24(g/mL)、乙醇体积分数55%。
将得到的原花色素提取液减压过滤除去残渣,滤液在30℃下真空旋转蒸发,待浓缩液的体积为原体积的1/5时,对其进行冷冻,之后进行真空冷冻干燥得到原花色素粉末。
1.2.2 原花色素测定及标准曲线的制作
采用香草醛-盐酸法测定提取液中的原花色素。取样液1.0mL,放入试管中,加入4g/100mL香草醛-甲醇溶液3.0mL混合,再加入1.5mL浓盐酸(质量分数为36%~38%),立即混匀。室温下显色15min左右,在500nm波长处测定吸光度,4g/100mL香草醛-甲醇溶液做空白对照,避光保存。
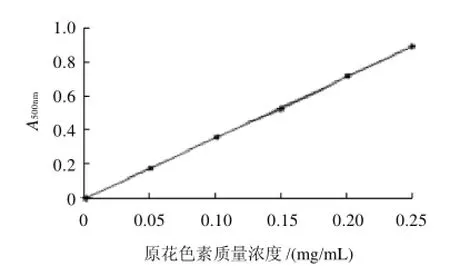
图1 原花色素标准曲线图Fig.1 Standard curve of proanthocyanidins
精确称取原花色素标准品10.0mg,定容于10mL容量瓶中,再进行一定倍数的稀释,配制出0.05、0.10、 0.15、0.20、0.25mg/mL质量浓度原花色素标准液。采用香草醛-盐酸法测定吸光度,绘制出原花色素质量浓度与吸光度的关系曲线,见图1。并计算出回归方程:A=3.5018C-0.0025(R2=0.9998),式中:A为吸光度;C为原花色素质量浓度(mg/mL)。
1.2.3 膜分离装置
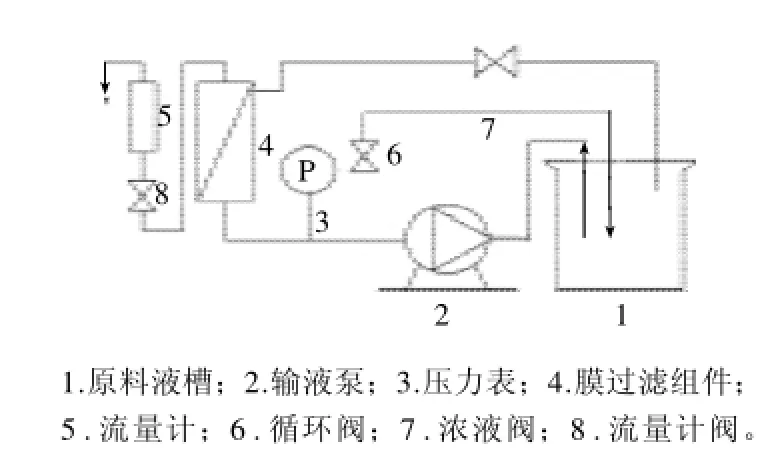
图2 RO-NF-UF-4050/4100/4010实验用膜分离装置/超滤器Fig.2 RO-NF-UF-4050/4100/4010 laboratory membrane separation device/ultra-filtration instrument
本实验采用上海摩速科学器材有限公司生产的RONF-UF-4050/4100/4010实验用膜分离装置/超滤器(图2)。操作方法为样品液经输液泵输入膜分离组件,以切向流的方式通过膜组件,分为透过液和截留液,在压力驱动下分别从膜分离柱外腔的透过口和循环口流出。
1.2.4 原花色素得率及纯度的计算
原花色素得率计算:W=m1/m2
式中:W为原花色素得率/%;m1为纯化后原花色素质量/mg;m2为称量脱脂花生衣的质量/mg。
原花色素纯度计算:n=CVN/m1
式中:n为原花色素纯度/%;C是原花色素质量浓度/(mg/mL);V为溶液体积/mL;N为稀释倍数;m1为纯化后原花色素质量/mg。
1.2.5 膜通量的计算
膜通量的计算式:J=ΔV/(S·Δt)
式中:J为膜通量/(L/(m2·h));ΔV为取样时间内渗透液体积/L;S为膜面积/m2;Δt为取样时间/h。
2 结果与分析
2.1 膜组件的选择
采用4种不同规格的膜组件(NF-500、HPS-1、PS-5、PS-10,截留分子质量分别为500、1000、5000、10000D)对相同温度、相同体积、相同浓度的原花色素提取液进行浓缩纯化实验。从表1可以看出,4种不同规格的膜组件对花生衣原花色素提取液纯化效果。原花色素提取液经过4种膜组件纯化后所得原花色素纯度均大于未经纯化处理的45.6%,因为4种膜组件孔径不同,对原花色素提取液除杂效果不同,孔径越小,纯化效果越好,但是得率也会随之变小。PS-10纯化原花色素得率最高为19.6%,但是纯度最低,为58.6%,得到的原花色素含有较多杂质;PS-5和HPS-1纯化原花色素的得率相近分别为12.1%和14.2%,而HPS-1所得原花色素纯度为84.5%,远高于PS-5所得原花色素的纯度为68.4%,说明HPS-1将一部分分子质量在1000~5000D一些糖类、色素等杂质有效地去掉,原花色素得率没有发生明显变化,可以推测花生衣中原花色素分子质量小于5000D。NF-500和HPS-1纯化原花色素的纯度相近为86.7%,说明两种膜组件都可以除去绝大部分大分子蛋白质、多糖等,由于提取液中含有一些小分子糖类等物质,所以进一步显著提高原花色素的纯度有难度,而HPS-1原花色素得率为12.1%,显著高于NF-500的8.1%,说明花生衣中原花色素的分子质量在1000D左右,膜组件NF-500的原花色素得率明显较低,是因为其截留分子质量过小,将一部分原花色素截留下。从原花色素得率和纯度总体角度进行选择,所以HPS-1为纯化原花色素最佳膜组件。

表1 不同孔径膜组件纯化原花色素效果Table1 Effect of membrane modules with different pore sizes on purification efficiency of proanthocyanidins
2.2 膜分离工艺参数的确定
2.2.1 操作压力的确定
对20℃、800mL、质量浓度5.90mg/mL的原花色素提取液在不同压力下进行浓缩、纯化,考察不同操作压力对提取液膜通量、原花色素得率和纯度的影响。结果见图3。

图3 操作压力对膜通量、原花色素得率和纯度的影响Fig.3 Effect of trans-membrane pressure on membrane flux, yield and purity of proanthocyanidins
超滤过程是以压力为驱动力,其大小会直接影响膜组件的通透性。图3数据表明,操作压力在0.50~0.54MPa时,膜通量由7.27L/(m2·h)上升至12.1L/(m2·h),在0.54MPa之后膜通量略有下降。因为在开始阶段随操作压力增大,膜通量随之增大;操作压力继续增加,经过超滤浓缩使原料溶液的浓度加大,致使浓差极化加剧,逐步形成凝胶层,膜通量趋于极限值,所以不再随压力的增大而增大,另一方面,随着凝胶层的积蓄加厚,阻力增大,致使膜通量反而会有下降的趋势,而且压力越高,凝胶层形成的速度越快,压力过大,膜甚至会被挤压而导致严重堵塞。尽管较低的压力能减缓堵塞,但是膜通量过小会影响生产效率。综合考虑各项因素,操作压力选择0.54MPa。
从图3可知,膜组件操作压力对花生衣中原花色素得率和纯化效果。操作压力在0.50~0.54MPa原花色素的得率随之压力的增加有由12.3%上升至13.4%,在0.54MPa之后略有下降,可能因为随着压力增加,浓差极化加剧,凝胶层出现及固化,导致原花色素透过率降低。原花色素纯度在82.1%~85.3%之间,在0.52MPa处最大为85.3%,当操作压力为0.54MPa时纯度为84.6%,呈降低趋势。原花色素的纯度在0.52MPa和0.54MPa处相差很小,同时从提取液膜通量和原花色素得率角度考虑,故操作压力为0.54MPa最为合适。
2.2.2 操作温度的确定
对0.52MPa、800mL、质量浓度5.90mg/mL的色素提取液在不同温度下进行浓缩,考察不同操作温度对提取液膜通量、原花色素得率和纯度的影响。结果见图4。

图4 操作温度对膜通量、原花色素得率和纯度的影响Fig.4 Effect of operating temperature on membrane flux, yield and purity of proanthocyanidins
从图4可知,操作温度在20~40℃,膜通量由11.8 L/(m2·h)上升至13.7L/(m2·h),呈逐渐增加趋势,因为温度升高时,扩算系数和传质系数增大,相应会减弱膜表面的浓差极化,故膜通量增加;但是原花色素是一类温度过高易分解的物质,高温可以使膜通量增加,同时也会使原花色素发生分解,使有效成分减少。综合考虑膜的性能,料液稳定性以及操作方便,采用25℃。
从图4可知,膜组件操作温度对花生衣中原花色素得率和纯化效果的影响。操作温度为20~25℃时,原花色素得率12.4%升至为13.3%,上升趋势明显,可能因为温度升高,膜表面的浓差极化减弱,膜材料微观布朗运动加剧,透过物增加,所以原花色素得率增加;在25℃后,原花色素得率趋于平缓。操作温度为20~25℃时,原花色素的纯度由84.1%升至85.8%,之后呈下降趋势,可能因为随着温度继续升高,膜材料布朗运动加剧,使瞬间单位体积的小孔机率增加,造成膜的截留性能下降,一些分子质量较大的物质没有被膜组件截留下来,所以原花色素的纯度降低。从提取液膜通量、原花色素得率及纯度的角度考虑,故采用25℃。
2.2.3 膜分离法与传统溶剂萃取法纯化花生衣中原花色素的比较
膜分离法:超声波辅助提取法得到花生衣原花色素提取液,采用膜组件为HPS-1超滤组件,在其操作压力0.54MPa,操作温度25℃条件下对花生衣中原花色素提取液进行纯化,得到滤液真空旋转蒸发到其原体积的1/5,再进行真空冷冻干燥,原花色素得率为13.3%,纯度为85.8%。
传统溶剂萃取法:超声波辅助提取法得到花生衣原花色素提取液,对提取液进行真空旋转蒸发(经蒸发去掉乙醇),再用乙酸乙酯在酸性环境下(pH3.5~4.0)对浓缩液浸提(3次)后进行干燥,原花色素得率为3.2%,纯度为59.6%。
与传统溶剂萃取法相比,膜分离法比传统溶剂萃取法原花色素得率提高了10.1个百分点,纯度提高了26.2个百分点。
3 结 论
采用膜分离技术对花生衣原花色素提取液进行处理,纯化花生衣中的生物活性物质——原花色素,研究4种不同截留分子质量的膜过滤组件对原花色素的纯化效果,从原花色素得率和纯度角度考虑,HPS-1(截留分子质量1000D)纯化效果最好。
研究了膜组件HPS-1操作压力、操作温度对膜通量及对原花色素得率和纯度的影响,结果表明:膜过滤最佳条件为压力0.54MPa、温度25℃,花生衣原花色素得率13.3%,其纯度85.8%。与传统溶剂萃取法相比,原花色素得率提高了10.1个百分点,纯度提高了26.2个百分点。膜分离纯化原花色素在得率和纯度都得到显著增高,纯化效果明显。
[1]赵志强, 万书波, 束春德. 花生加工[M]. 北京: 中国轻工业出版社, 2001.
[2]曹凯光, 潜学基, 史建红. 从花生红衣皮中提取红衣粉的研究[J]. 食品工业科技, 1995, 17(5): 21-23.
[3]陈杰, 徐鹤龙, 方志伟. 花生红衣的研究与开发应用[J]. 广东农业科学, 2007(8): 80-81.
[4]王峰. 黑花生衣色素的研究[D]. 长沙: 湖南农业大学, 2007.
[5]SANONER P, GUYOT S, MARNET N, et al. Polyphenol profiles of French cider apple varieties (Malus domestica sp.)[J]. J Agric Food Chem, 1999, 47(12): 4847-4853.
[6]PATAKI T, BAK I, KOVACS P, et al. Grape seed proanthocyanidins improved cardiac recovery during reperfusion after ischemia in isolated rat hearts[J]. Am J Clin Nutr, 2002, 75(5): 894-899.
[7]张红梅. 花生衣红色素的提取、性质及其应用的研究[D]. 无锡: 江南大学, 2005.
[8]王峰. 黑花生衣色素的研究[D]. 长沙: 湖南农业大学, 2007.
[9]张秀尧, 凌罗庆, 戴荣兴. 花生衣的化学成分研究[J]. 中国中药杂志, 1990, 15(6): 36-38.
[10]陈少洲, 陈芳. 膜分离技术与食品加工[M]. 北京: 化学工业出版社, 2005.
[11]孟祥河, 潘秋月, 邵平, 等. 酶解膜分离两步分离乳清中β-乳球蛋白的研究[J]. 农业工程学报, 2008, 24(5): 280-283.
[12]张晓平, 董银卯, 刘永国, 等. 中空纤维膜分离燕麦蛋白工艺及膜清洗方案[J]. 农业工程学报, 2010, 26(3): 332-340.
[13]李媛媛, 高彦祥. 膜分离技术纯化栀子黄色素的研究[J]. 食品科学, 2006, 27(6): 113-117.
[14]陈渝, 李志远, 侯小桢. 膜分离技术在菠萝汁澄清中的应用研究[J].食品工业科技, 2005, 26(9): 63-66.
[15]卢艳民, 周梅村, 郑华, 等. 超滤膜精制胭脂虫红色素的研究[J]. 食品科学, 2008, 29(9): 196-198.
[16]朱凤, 张初署, 杨庆利, 等. 微波辅助提取花生衣原花色素工艺优化[J]. 食品科学, 2009, 30(20): 89-93.
Membrane Separation Technique for Purifying Proanthocyanidins from Peanut Skin
LIU Zhi-qiang1,2,ZHANG Chu-shu1,SUN Jie1,YU Li-na1,ZHANG Yan2,WANG Shi-qing2,YANG Qing-li1,*
(1. Shandong Peanut Research Institute, Qingdao 266100, China;2. College of Food Science and Engineering, Qingdao Agricultural University, Qiangdao 266109, China)
The proanthocyanidin-rich extract from peanut skin was purified and condensed by membrane separation technique. The purification effects of membrane modules with different pore sizes (NF-500, HPS-1, PS-5 and PS-10) on the extract were assessed. Collectively considering product yield and purity, the optimal purification conditions were using HPS-1 module at a trans-membrane pressure of 0.54 MPa and an operating temperature of 25 ℃. Under such purification conditions, the yield and purity of purified proanthocyanidin were up to 13.3% and 85.8%, respectively.
proanthocyanidin;peanut skin;membrane separation
TS202.3
A
1002-6630(2010)20-0183-04
2010-06-21
国家“863”计划项目(2007AA10Z189;2006AA10A114);农业部公益性行业(农业)科研专项(nyhyzx07-0140);山东省自主创新重大科技专项(2006GG1107009)
刘志强(1984—),男,硕士研究生,主要从事农产品加工及贮藏研究。E-mail:liuzhiqiang_1984@126.com
*通信作者:杨庆利(1979—),男,副研究员,博士,主要从事功能食品研究。E-mail:rice407@sohu.com

