共固定化酶提取花生多糖工艺优化
苗敬芝,吕兴军*,董玉玮,高明侠,曹泽虹
(徐州工程学院食品工程学院,江苏省食品生物加工工程技术研究中心, 江苏 徐州 221008)
共固定化酶提取花生多糖工艺优化
苗敬芝,吕兴军*,董玉玮,高明侠,曹泽虹
(徐州工程学院食品工程学院,江苏省食品生物加工工程技术研究中心, 江苏 徐州 221008)
以花生粕为原料,采用共固定化酶提取花生多糖,并对其工艺条件进行优化试验。结果表明:花生多糖的最佳提取条件为酸性蛋白酶和木瓜蛋白酶各10%、固液比1:20(g/mL)、时间5h、pH5.0。采用共固定化酶提取花生多糖提取率为10.88%,共固定化酶重复使用7次,酶活力仍保持50%以上。
共固定化酶;提取;花生;多糖
花生(Arachis hypogaed)是世界上的四大油料作物之一,约占世界油料的14%[1]。我国花生的产量居世界第一位,花生榨油后的花生粕中含有40%以上的蛋白质,碳水化合物和多糖等物质,目前人们对花生粕提取蛋白质工艺研究较多[2-3],但对从花生粕中提取多糖的研究仅刚开始[4-5]。多糖作为药物进行研究和开发起始于20世纪40年代,由于多糖具有独特的生物活性,近年来,对植物多糖的研究发展很快,其中对多糖的免疫机理,抗肿瘤、抗衰老和降血糖等功效的研究以达到分子水平[6-7]。多糖的提取方法很多,主要有水提取[8]、酸提取、碱提取和酶法提取等[9],其中酶法[10]提取对多糖的结构破坏性小、提取率高。本实验尝试利用共固定酶提取花生粕多糖,探讨其提取的最佳工艺条件,为后续对花生粕中多糖的开发和利用提供理论参考。
1 材料与方法
1.1 材料与试剂
花生粕由徐州新沂崇本堂农产品开发有限公司提供,粗蛋白含量44.75%。
酸性蛋白酶(5万U/g)、木瓜蛋白酶(65万U/g) 天津市诺实科技发展有限公司;海藻酸钠 国药集团上海化学试剂有限公司;戊二醛 天津福晨化学试剂厂;无水氯化钙 天津基准化学试剂有限公司;其他试剂均为国产分析纯或生化试剂。
1.2 仪器与设备
TU-1810PC型紫外分光光度计 北京普析通用仪器有限公司;7230型可见分光光度计、DZF6020型真空干燥箱 上海精密科学有限公司; HYG-1 转式恒温调速
柜 上海欣蕊自动化设备有限公司;DL-5大容量离心机上海安亭科学仪器厂;1700型高效液相色谱仪 Agilent公司。
1.3 方法
1.3.1 共固定化酶制备的方法
参照高明侠等[11]的实验方法,取酸性蛋白酶和木瓜蛋白酶各250mL(酸性蛋白酶质量分数10%、木瓜蛋白酶质量分数10%),按1:1体积比加入到3g/100mL的海藻酸钠溶液中,充分混合后,在振荡器上振荡30min,用4号针头注入500mL 0.2g/100mL的CaCl2溶液中,4℃冰箱硬化2h,滤出小球体,加入到戊二醛溶液中交联6h,用蒸馏水洗掉小球体上未固定化的酶类,然后用230nm波长检测吸收峰,印三酮反应无色,用滤纸吸干,放置4℃冰箱保存备用。其他固定化酶制备与此相同。共固定化酶中酸性蛋白酶比活力为22.77U/mg,木瓜蛋白酶比活力为249.80U/mg。
1.3.2 共固定化酶活力测定[12]
以苯甲酰-L-精氨酸乙酯(BAEE)为底物,用紫外分光光度法测定。在具塞试管中加入固定化酶0.3g,酶激活剂3mL,37℃水溶中预热10min,加入酪蛋白溶液10mL,搅匀后在37℃水溶中精确反应10min,然后加入10mL三氯醋酸溶液,剧烈摇动后,37℃水溶放置30min,在275nm处测定吸光度。
1.3.3 多糖含量测定
采用苯酚-硫酸法[13]进行,在490nm波长处测定吸光度,同时做空白实验,计算多糖提取率。
1.3.4 共固定化酶提取花生多糖工艺流程
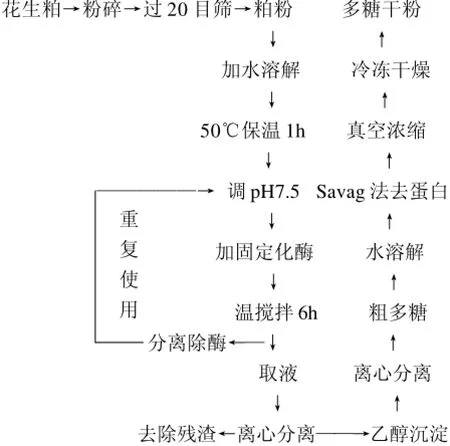
其中,Sevag法脱蛋白需多次重复,直至紫外分光光度计在260、280nm处无吸收为止。
1.3.5 共固定化酶提取花生多糖工艺条件选择[14-15]
为了获得花生粕多糖提取的最佳工艺条件,本实验选择pH值、时间、固液比和加酶量4因素3水平进行正交试验,见表1。根据固定化酶小球中的酶含量,根据加酶量,称取一定量固定化酶小球加入到花生粕液中,酶解。在2.2节中因加入的共固定化酶两种酶的浓度相同,简写为一个百分比。

表1 正交试验因素水平表Table 1 Factors and levels in the orthogonal array design
1.3.6 共固定化酶稳定性实验[16]
采用共固定化酶提取花生多糖,重复使用后,测定多糖提取率,观察酶活力保持50%以上时的最高使用次数。
2 结果与分析
2.1 共固定化酶组合对多糖提取的效应
在固液比1:20(g/mL)、加酶量10%、温度和pH值按每组酶的最适温度和pH值调节,共酶解5h,结果见表2。

表2 共固定化酶组合对多糖提取的影响Table 2 Effect of different enzyme combinations on polysaccharide yield
由表2可见,选用酸性蛋白酶加木瓜蛋白酶的组合,提取花生多糖的效果最好,提取率为9.18%。
2.2 共固定化酶量对多糖提取的影响
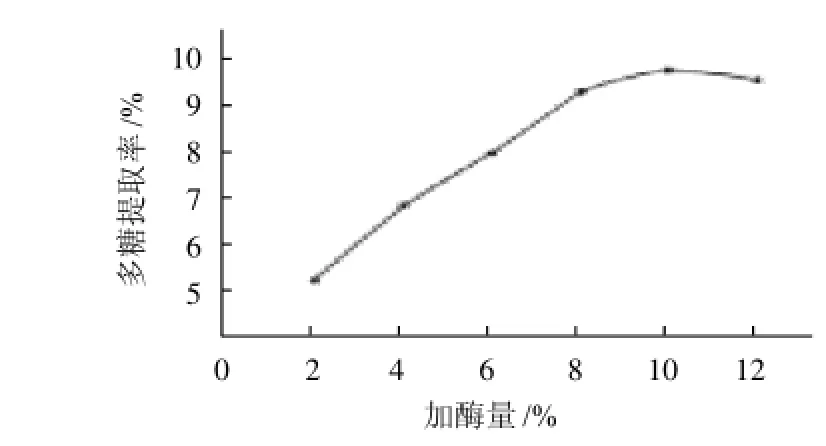
图1 加酶量对多糖提取率的影响Fig.1 Effect of enzyme concentration for immobilization on polysaccharide yield
共固定化酶中酸性蛋白酶和碱性蛋白酶加酶量为2%、4%、6%、8%、10%和12%,酶解温度50℃,pH5.0,固液比1:20,酶解时间5h,结果见图1。
由图1可知,随着共固定化两种加酶量的增加,多糖提取率也逐渐增加,当酶添加量大于10%时,多糖提取率最高,酶添加量确定为10%。
2.2.1 固液比对共固定化酶提取多糖的影响
在加酶量10%、pH5.0、温度50℃、时间5h条件下,选用花生粕与水不同固液比提取多糖,结果见图2。
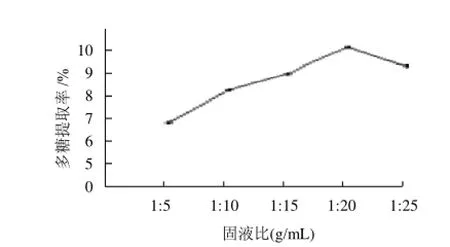
图2 固液比对多糖提取的影响Fig.2 Effect of solid/liquid ratio on polysaccharide yield
由图2可知,随着固液比的增加,多糖的提取率也逐渐增加,当固液比为1:20时,多糖的提取率最高为10.12%,当固液比再增加时,多糖的提取率逐渐降低,固液比确定为1:20。
2.2.2 反应温度对共固定化酶提取多糖的影响
在pH5.0、固液比1:20、加酶量10%、酶解时间5h条件下,选用不同的温度提取多糖,结果见图3。
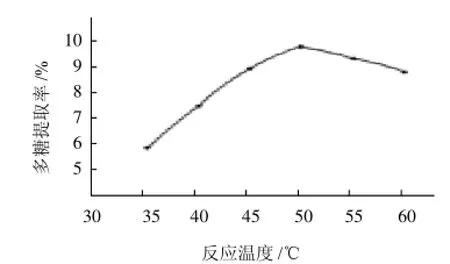
图3 共固定化酶反应温度对多糖提取的影响Fig.3 Effect of hydrolysis temperature on polysaccharide yield
由图3可知,共固定化酶解花生粕反应温度在50℃时,多糖提取率最高为9.85%,确定提取温度为50℃。
2.2.3 共固定化酶反应时间对多糖提取的影响
在共固定化酶加酶量10%、pH5.0、50℃条件下分别反应2、3、4、5、6h和7h,结果见图4。
由图4可知,随着共固定化酶反应时间的延长,多糖的提取率也随之增加,当酶解时间为5h时,多糖的提取率最高为9.80%,确定酶解时间为5h。
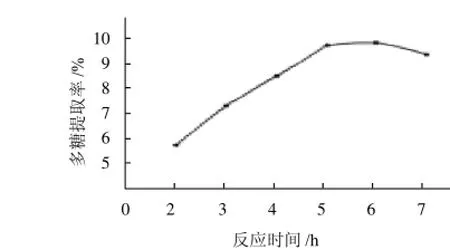
图4 共固定化酶反应时间对多糖提取的影响Fig.4 Effect of hydrolysis duration on polysaccharide yield
2.2.4 共固定化酶反应pH值对多糖提取的影响
在共固定化酶加酶量10%、温度50℃、时间5h条件下pH值分别控制在2、3、4、5、6和7,结果见图5。
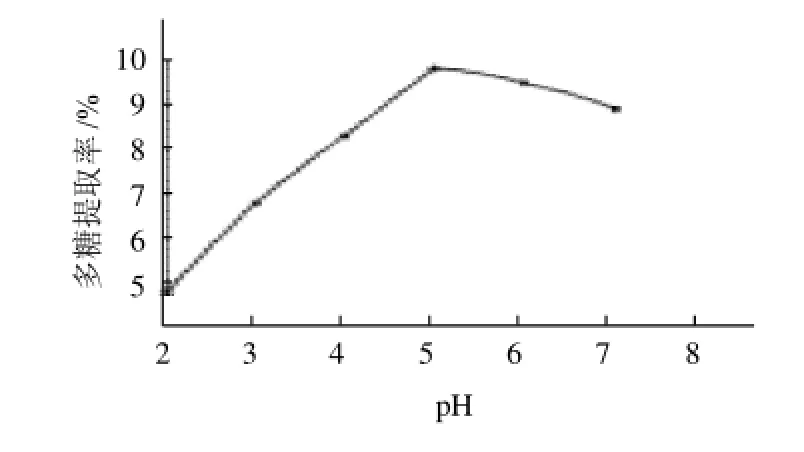
图5 共固定化酶反应pH值对多糖提取的影响Fig.5 Effect of hydrolysis pH on polysaccharide yield
由图5可知,共固定化酶反应的pH值对花生粕提取多糖有较大的影响,当pH值小于5时,随着pH值的升高,多糖的提取率也逐渐增加,当pH值超过5时,多糖的提取率逐渐降低,可见pH5时是最佳提取条件。
2.3 共固定化酶提取花生多糖正交试验
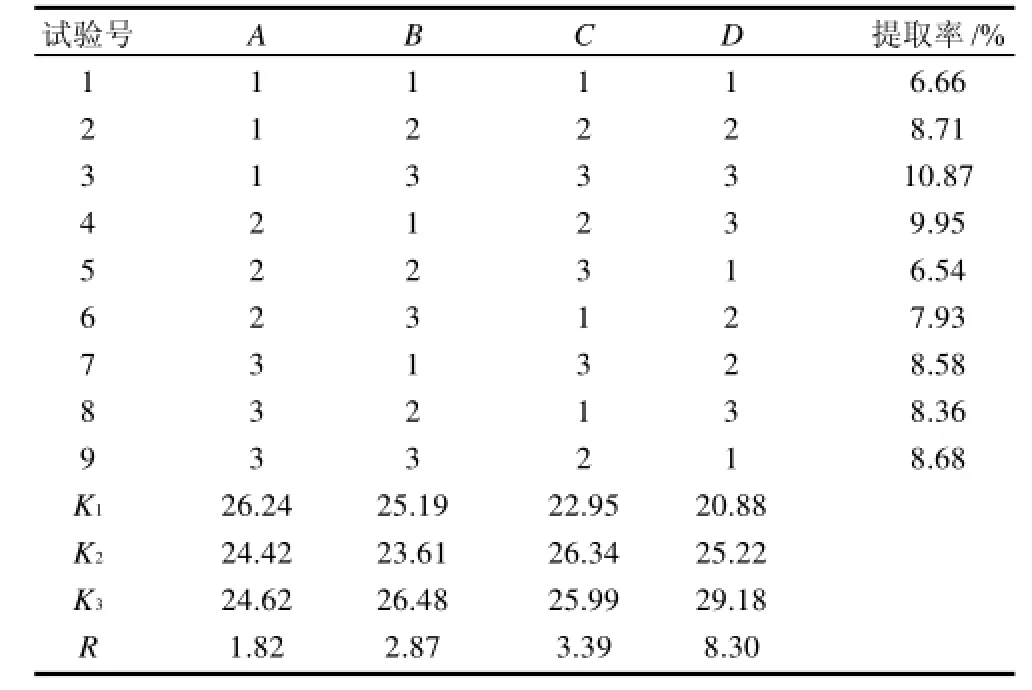
表3 正交试验设计及结果Table 3 Orthogonal array design arrangement and experimental results
采用正交试验优化共固定化酶提取花生多糖,筛选
最佳条件组合,结果见表3。
由表3可以看出,在4个因素中对多糖提取率影响顺序为即:D>C>B>A,加酶量对花生多糖的提取率影响最大,其次是固液比、时间和pH值,按照极差分析所得的最佳工艺条件为A1B3C2D3,即pH5、时间5h、固液比1:20、加酶量酸性蛋白酶和木瓜蛋白酶各10%。根据此工艺条件进行验证实验,3次验证实验结果多糖提取率平均值为10.88%,可以认为极差分析所获得的条件是多糖提取的最佳工艺条件。
2.4 共固定化酶稳定性实验
采用共固定化酶提取花生多糖,重复使用后,考察对多糖提取保持50%,酶活力的使用次数,结果见图6。

图6 共固定化酶的稳定性实验Fig.6 Repeated usability evaluation for co-immobilized acidic protease and papain
由图6可知,使用共固定化酶提取花生多糖,第1次提取率为10.88%,当使用到第7次后多糖的提取率仍为5.40%,共固定化酶的活力仍保持在50%左右。说明共固定化酶具有良好的稳定性,此种结果与苗敬芝等[17]用固定化酶水解乌鸡肉制备功能肽的研究相似。
3 结 论
利用共固定化酶提取花生多糖的最佳工艺条件:酸性蛋白酶和木瓜蛋白酶各10%,固液比1:20,时间5h, pH5.0,花生多糖提取率为10.88%。共固定化酶重复使用7次,共固定化酶的活力仍保持在50%以上。
[1]温士谦. 食用脱脂花生粕的制备和应用[J]. 中国油脂, 1987, 12(5): 17-22.
[2]李明妹, 姚开, 贾冬英, 等. 花生功能成分及其综合利用[J]. 中国油脂, 2004, 29(9): 13-15.
[3]张伟, 徐志宏, 孙智达, 等. 花生粕提取蛋白质工艺的优化研究[J].食品工业科技, 2006, 27(12): 125-131.
[4]任初杰, 姚华杰, 王承明, 等. 酸提花生粕多糖工艺研究[J]. 食品科学, 2007, 28(9): 128-132.
[5]薛芳, 颜瑞, 王承明. 超声辅助提取花生多糖的研究[J]. 食品科学, 2008, 29(8): 158-163.
[6]王一飞, 吕玉民. 中药与肿瘤免疫研究[M]. 北京: 中国医药科学出版社, 1996: 278-290.
[7]方积年. 多糖研究的现状[J]. 药学学报, 1986(2): 944-947.
[8]HUANG Shengquan, NING Zhengxiang. Extraction of polysaccharide from Ganoderma lucidum and its immune enhancement activity[J]. International Journal of Biological Macromolecules, 2010, 47(3): 336-341.
[9]LIANG Renjie. Orthogonal test design for optimization of the extraction of polysaccharides from Phascolosoma esulenta and evaluation of its immunity activity[J]. Carbohydrate Polymers, 2008, 73(4): 558-563.
[10]MISSANG C E, MASSIOT P, BARON A, et al. Effect of oxidative browning of apple pulp on the chemical and enzymatic extraction of cell wall polysaccharides[J]. Carbohydrate Polymers, 1993, 20(2): 131-138.
[11]高明侠, 苗敬芝, 曹泽虹, 等. 共固定化双酶水解芝麻粕蛋白制备复合氨基酸研究[J]. 扬州大学学报: 农业与生物版, 2008, 29(4): 95-98.
[12]何杰. 胰蛋白酶活力的快速测定[J]. 中国生化药物杂志, 1994, 15(1): 54-55.
[13]张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1999: 11-12.
[14]OOSTERVEL A, HARMSENJS, VORAGENAG J, et al. Extraction and characterization of polysaccharides from green and roasted coffea Arabica beans[J]. Carbohydrate Polymers, 2003, 52: 285-296.
[15]RUAN Zheng, SU Jie, DAI Hanchuan, et al. Characterization and immunomodulating activities of polysaccharide from Lentinus edodes [J]. Interational Immunopharmacology, 2005, 5(5): 811-820.
[16]高明侠, 苗敬芝, 曹泽虹, 等. 固定化胰蛋白酶水解花生蛋白制备多肽的研究[J]. 食品科学, 2008, 29(8): 164-168.
[17]苗敬芝, 吕兆启, 高明侠, 等. 固定化胰蛋白酶水解乌鸡肉制备功能肽的研究[J]. 食品科学, 2009, 30(21): 324-327.
Orthogonal Array Optimization of Extraction of Peanut Polysaccharides Based on the Use of Co-Immobilized Enzymes
MIAO Jing-zhi,LXing-jun*,DONG Yu-wei,GAO Ming-xia,CAO Ze-hong
(Jiangsu Food Bioprocessing Engineering Research Center, School of Food Engineering, Xuzhou Institute of Technology, Xuzhou 221008, China)
Eight common proteases of the same concentrations were co-immobilized pairwise into sodium alginate beads at a volume ratio of 1:1 in order to provide co-immobilized enzymes for hydrolyzing peanut meal to obtain polysaccharides. The hydrolysis process of peanut meal based on the use of co-immobilized enzymes was optimized. Combination of acidic protease and papain gave a maximum polysaccharide yield among six combinations and the optimal conditions for hydrolyzing peanut meal with this combination were as follows: enzyme concentration for immobilization 10%; solid/liquid ratio 1:20; pH 5.0; and hydrolysis duration 5 h. A polysaccharide yield of 10.88% was achieved under these conditions. After repeated use for 7 times, the co-immobilized enzymes still had an activity exceeding 50% of the original activity.
co-immobilized enzymes; extraction;peanut;polysaccharides
Q814.2;S565.2
A
1002-6630(2010)18-0157-04
2010-06-19
江苏省科技发展计划项目(BE2006308)
苗敬芝(1964—),女,副教授,本科,主要从事食品生物技术研究。E-mail:miaojingzhi6466@163.com
*通信作者:吕兴军(1958—),男,高级工程师,本科,主要从事食品工程研究。E-mail:miaojingzhi6466@163.com

