黑米花色苷的提取及纯化
侯召华,翟虎渠,万建民,任贵兴*
(中国农业科学院作物科学研究所,北京 100081)
黑米花色苷的提取及纯化
侯召华,翟虎渠,万建民,任贵兴*
(中国农业科学院作物科学研究所,北京 100081)
目的:得到黑米花色苷最佳提取工艺,建立应用大孔吸附树脂纯化花色苷的方法。方法:以矢车菊素-3-葡萄糖苷为跟踪指标,通过单因素试验和正交试验,对影响黑米花色苷提取的各因素进行研究,比较9种大孔吸附树脂对花色苷的静态吸附和解吸性能。结果:黑米花色苷最佳提取条件,提取液乙醇-水-盐酸体积比为50: 50:0.5,温度50℃,固液比为1:10(g/mL),提取时间为1h,提取次数为3次。通过对9种大孔吸附树脂的比较,确定AB-8为纯化黑米的理想吸附树脂,80%乙醇为洗脱剂,上样流速为1.0BV/h,解吸流速为2.0BV/h。结论:测定经树脂纯化后提取物中花色苷的含量达到22.59%(粗提物中花色苷含量为3.448%),树脂富集倍数为 6.02,此工艺条件纯化效果显著。
黑米;大孔吸附树脂;花色苷;提取;纯化
黑米(Oryza sativa L)作为重要的优异稻种资源,因其糙米(颖果)的果皮和种皮内富集有天然花色苷类化合物而得名[1]。花色苷是水溶性黄酮类色素中最重要的一类,赋予水果、蔬菜、花卉等五彩缤纷的颜色[2],其保健作用越来越受到人们的重视,近10年来国内外对其生理功能进行了大量的研究,结果表明花色苷可与活性氧反应,减少和消除活性氧对生物体的伤害[3-4];花色苷具有强抗氧化性[5-6]、抗动脉硬化的作用,可以降低高血脂大鼠的甘油脂水平,改善高甘油脂脂蛋白的分解代谢[7];抑制胆固醇吸收,降低低密度脂蛋白胆固醇含量;降低血清及肝脏中脂肪含量、抗发炎性、抗变异、调节免疫功能、预防心血管疾病等多种功能。
黑米花色苷主要集中在黑米皮中,从黑米中提取花色苷属于固液浸提过程,由于该过程受到溶剂、温度、时间、物料比等多种因素的影响,优化其最佳的因素与水平是提高黑米花色苷提取率的基础。目前对花色苷类化合物的提取纯化方法主要有大孔树脂法、CO2超临界萃取法和高速逆流色谱技术法等[8-9]。其中,大孔树
脂法是近年来国内外新发展的处理技术,简单易行,且具有成本低、效率高、稳定性好和容易再生等特点[10]。因此,在分离中,用大孔树脂作为吸附剂已成为主流,广泛应用于天然产物的分离纯化[11]。
本实验以矢车菊素-3-葡萄糖苷含量为跟踪指标,比较9种不同大孔吸附树脂对花色苷纯化效果,旨在优化黑米花色苷提取条件,筛选合适的大孔吸附树脂及其应用条件,获得纯度较高的黑米花色苷提取物,为生产及进一步研究提供依据。
1 材料与方法
1.1 材料、试剂与仪器
黑米品种为新鲜的龙锦1号黑米,市场购得。用粉碎机破碎,过6 0目筛。
矢车菊素-3-葡萄糖苷(Cyanidin-3-glucopyranoside,AR) 挪威Polyphenols实验室;乙醇、盐酸、NaOH等(均为国产分析纯)。
大孔吸附树脂:NKA-9、ADS-5、ADS-17、AB-8、ADS-7、S-8、D4020、ADS-F8、NKA 天津南开大学化工厂。具体型号及物理结构参数见表1。
R210旋转蒸发仪 瑞士Buchi公司。
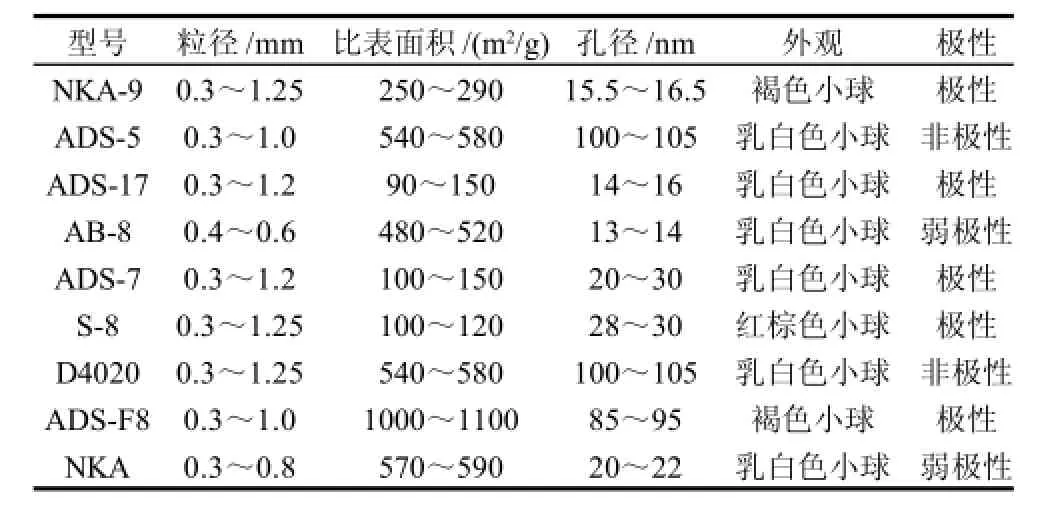
表1 吸附树脂的型号及物理结构Table 1 Physical properties, appearance and polarity of 9 macroporous resins tested in this study
1.2 方法
1.2.1 浸提条件单因素试验

表2 黑米花色苷提取单因素试验设计Table 2 One-factor-at-a-time design for the investigations of 5 main technological parameters
根据预实验结果可知,影响乙醇提取效果的主要因素有温度、提取时间、料液比和乙醇体积分数等,实验分别进行了单因素试验,提取液中加入0.5%盐酸,设置了提取液乙醇体积分数;提取温度、提取时间、料液比、提取次数以确定各因素的影响效果和适宜的参数范围。
1.2.2 浸提条件正交试验
以黑米为材料,破碎过60目筛,根据单因素试验结果。按提取次数(A)、浸提温度(B)、料液比(C)、浸提时间(D)和乙醇体积分数(E),五因素四水平的正交试验,因素水平见表3。

表3 正交试验水平表Table 3 Factors and levels in orthogonal array design
1.2.3 黑米花色苷含量的测定方法及提取物的制备
采用HPLC方法,以矢车菊素-3-葡萄糖苷为总花色苷的标准物。
10mg矢车菊素-3-葡萄糖苷,加10mL甲醇溶解,过0.45μm微孔滤膜,即得供试品溶液。色谱条件为:Alltima C18色谱柱 (5μm,4.6mm×250mm),流动相A为水(含0.1%三氟乙酸),流动相B为乙腈(CH3CN);梯度洗脱程序:0~5min(10% B),5~20min(10% B~15% B),20~25min(15% B),25~30min (15% B~18% B),30~50min (18% B~35% B),50~55min (35% B~10% B);检测波长520nm,样品进样量为30μL。
黑米粉提取液经滤纸过滤后,利用旋转蒸发仪浓缩,低温干燥得粗提物。粗提物利用AB-8型大孔树脂过滤后,浓缩干燥,得纯化花色苷提取物。粗提物和纯化后花色苷提取物利用甲醇溶解,过0.45μm微孔滤膜,即可进行检测。
乙醇粗提取物得率的计算:

式中:A为乙醇粗提物得率/%;Ac为粗提物的质量/mg;G为黑米质量/mg。
AB-8纯化提取物得率的计算:

式中:B为AB-8纯化提取物得率/%;Bc为AB-8
纯化提取物质量/mg;G为黑米质量/mg。
花色苷提取率的计算:

式中:M为花色苷提取率/%;X为花色苷提取量/mg;Y为黑米花色苷总质量/mg。
1.2.4 大孔吸附树脂的选型实验
大孔吸附树脂预处理:取一定量树脂用95%乙醇浸泡24h,用乙醇洗涤,直至洗出液中无白色或褐色浑浊为止,再用去离子水洗至无醇味,滤出树脂。用相对于大孔吸附树脂4倍体积 的5%的HCl溶液,以每小时相对于大孔吸附树脂5倍体积(5BV/h)的流速通过树脂层,并浸泡3h,用去离子水以5BV/h的流速洗至流出液的pH值为中性;再用4BV的2% NaOH溶液,以5BV/h的流速通过树脂层,并浸泡3h,用去离子水以5BV/h的流速洗至流出液的pH值为中性止。
静态吸附量及解吸率的测定:准确称取处理好的湿树脂(用滤纸吸干表面水)2.0g,装入100mL具塞锥形瓶中,加入花色苷提取液50mL,室温振荡24h,使树脂充分吸附后,测定剩余溶液的浓度,按下式计算各树脂室温下对花色苷的吸附量Q。
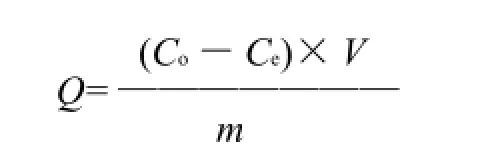
式中:Q为吸附量/(mg/g);Co为起始质量浓度/ (mg/mL);Ce为平衡质量浓度/(mg/mL);V为吸附液体积/mL;m为树脂质量/g。
吸附饱和的树脂,利用80%乙醇进行解析,充分解析后,测滤液中花色苷的含量。按下列公式计算解吸率D。

式中:D为解吸率/%;Cd为解吸液质量浓度/(mg/mL),Vd为解吸液体积/mL。
1.2.5 大孔吸附树脂对黑米花色苷的静态吸附实验
准确称取筛选出来的大孔吸附树脂2.0g(使用前用滤纸吸干树脂表面的水分),置于三角瓶中,加入一定浓度的花色苷溶液50mL,封口置于摇床中,室温条件下振荡24h。分别在吸附时间为20、40、60、80、100、120、140、160min时测定溶液中花色苷的浓度,计算大孔吸附树脂对花色苷随着时间变化的吸附量,做出大孔树脂的静态吸附曲线,确定大孔树脂最佳静态吸附时间。
1.2.6 不同乙醇体积分数对大孔吸附树脂解吸特性的影响
吸附饱和的AB-8树脂5份,分别用20%、40%、60%、80%、95%的乙醇溶液进行解吸,计算不同体积分数度乙醇溶液对黑米花色苷的解吸率。
1.2.7 上样流速对AB-8型大孔吸附树脂的吸附率的影响
黑米花色苷粗提液,分别采用0.5、1.0、1.5、2.0、2.5、3.0BV/h的流速,分析不同流速下的AB-8型大孔吸附树脂对黑米花色苷吸附率的影响。
1.2.8 解吸流速对AB-8型大孔吸附树脂的解吸率的影响
用80%乙醇溶液洗脱,分别采用0.5、1.0、1.5、2.0、2.5、3.0BV/h的流速,把黑米花色苷洗脱出来。分析流速对花色苷解吸率的影响。
1.2.9 大孔吸附树脂对花色苷提取的纯化效果
经过单因素试验、正交试验确定了黑米花色苷的最佳提取工艺。筛选出最佳大孔吸附树脂,利用其进行花色苷纯化富集,将黑米花色苷提取液在大孔树脂上进行富集,以得到纯度较高的花色苷提取物。
2 结果与分析
2.1 黑米花色苷浸提条件
2.1.1 单因素试验结果
2.1.1.1 提取次数的影响

图1 提取次数对花色苷提取量的影响Fig.1 Effect of extraction times on anthocyanins yield
在提取温度为30℃、固液比为1:10、乙醇体积分数为85%、提取时间为2h的条件下,分析提取次数对提取黑米花色苷的影响。由图1可知,随提取次数增加,花色苷的提取量逐步增加,尤其两次提取比一次提取有显著增加。
2.1.1.2 提取温度的影响
在乙醇体积分数为85%、提取时间为2h、固液比为1:10、提取次数为2次的条件下,分析提取温度对提
取黑米花色苷的影响。从图2可以看出,随提取温度的升高,花色苷提取量相应增加,当温度达到60℃时,提取量达最高值,此后,随温度继续升高,花色苷含量开始降低。因此,选择提取温度为6 0℃。

图2 提取温度对花色苷提取量的影响Fig.2 Effect of extraction temperature on anthocyanins yield
2.1.1.3 固液比的影响

图3 固液比对花色苷提取量的影响Fig.3 Effect of solid/liquid ratio on anthocyanins yield
在提取温度为30℃、提取时间为2h、乙醇体积分数为85%、提取次数为2次的条件下,分析固液比对提取黑米花色苷的影响。由图3显示,当固液比为1:8和1:10时,花色苷提取量较高。当继续降低固液比时,提取量反而下降,分析原因可能是,当固液比降低到一定程度时,原料内部与溶剂之间溶质已经达到平衡,反而使杂质溶解增加,相应减少花色苷的提取量。
2.1.1.4 提取时间的影响

图4 提取时间对花色苷提取量的影响Fig.4 Effect of extraction time on anthocyanins yield
在提取温度为30℃、固液比为1:10、乙醇体积分数为85%、提取次数为2 次的条件下,分析提取时间对提取黑米花色苷的影响。结果如图4所示,随提取时间的延长,花色苷提取量迅速增加,但1.5h以后增加量不显著。当提取时间为2h时,花色苷的提取量基本持平,从节约时间和能耗角度分析,选择提取时间1.5h为宜。
2.1.1.5 乙醇体积分数的影响

图5 乙醇体积分数对花色苷提取量的影响Fig.5 Effect of ethanol concentration on anthocyanins yield
在提取温度为30℃、提取时间为2h、固液比为1:10、提取次数为2次的条件下,分析乙醇体积分数对提取黑米花色苷的影响。从图5可以看出,在乙醇体积分数为55%时,花色苷提取量显著增加,随后增加乙醇体积分数,提取量增加不显著。表明55%的乙醇体积分数为宜。
2.1.2 正交试验结果

表4 正交试验方案及其结果Table 4 Orthogonal array design matrix and experimental values of anthocyanins yield
单因素试验表明,利用溶液进行花色苷提取时,提取时间、提取温度、固液比、乙醇体积分数和提取次数对提取率均有不同程度的影响。因此在单因素试验的基础上,通过L16(45)五因素四水平正交试验来进一步优化花色苷的提取工艺参数,每组正交试验重复处理3次。应用SAS6.0统计分析软件进行数据处理,正交试验结果见表4。
从表4可以看出,每个因素对花色苷的提取效果的影响不同。由极差分析可知,对花色苷提取效果影响的主次顺序为:提取次数>固液比>提取温度> 提取时间> 乙醇体积分数。经表5方差分析表明,提取次数对黑米花色苷的提取效果有显著影响,其他因素水平的改变对提取率影响不显著。

表5 方差分析表Table 5 Analysis of variance for anthocyanins yield with various extraction conditions
最佳优化组合为A4B1C4D2E1,即溶剂乙醇-水-盐酸体积比为50:50:0.5、温度50℃、固液比为1:10、每次提取时间为1h。
2.1.3 黑米花色苷的提取率
取新鲜黑米100g(总花色苷含量为787.67mg/100g,此为在上述最佳条件下提取5次所得花色苷总和),对其进行提取,分取3次提取液,检测提取液中花色苷的提取率。

表6 黑米花色苷提取率Table 6 Anthocyanins yields from black rice extracted under optimized conditions for the first, second and third time
由表6可知,以提取率为指标,3次合计提取率达84.72%,表明最佳浸提条件效果是较理想, 最终确定提取次数为3次。
2.2 大孔吸附树脂柱层析对黑米花色苷的纯化
2.2.1 大孔吸附树脂的选型
9种不同型号的大孔吸附树脂对花色苷的静态吸附及解吸实验结果表明,不同型号的大孔树脂对黑米花色苷的吸附效果明显不同,在所选择的9种树脂中,D4020、ADS-5、AB-8、NKA型大孔吸附树脂对花色苷都有较高的吸附性能。

表7 不同大孔树脂对花色苷的吸附率及解吸率Table 7 Adsorption and desorption rates of different macroporous resins towards black rice anthocyanins
大孔吸附树脂在分离有效成分方面是利用其吸附的可逆性(即解吸性)。由于树脂极性不同,吸附作用力的强弱也有差别,因而解吸难易也不同,所以较高解吸率也是树脂筛选的重要环节。利用8 0%乙醇进行解析,NKA-9,ADS-7都具有较高的解吸率,但其吸附率较低。
综上分析各因素,确定AB-8型大孔吸附树脂用于黑米花色苷的纯化。
2.2.2 AB-8型大孔吸附树脂对黑米花色苷的静态吸附分析

图6 AB-8型大孔树脂对黑米花色苷的静态吸附曲线Fig.6 Static adsorption curve of black rice anthocyanins onto AB-8
由图6可知,在静态吸附过程的前2h内,AB-8大孔吸附树脂对黑米花色苷吸附量迅速增加。在吸附时间达到2h后,AB-8型大孔吸附树脂对黑米花色苷的静态吸附基本达到饱和。在2h之后随着吸附时间的增加,吸附量增加基本不变。
2.2.3 乙醇体积分数对大孔树脂的解吸率的影响

图7 乙醇体积分数对花色苷解吸率的影响Fig.7 Effect of ethanol concentration on desorption rate of black rice anthocyanins
把已经吸附好的树脂先用6BV的蒸馏水以2BV/h的流速洗脱,再用6BV的20%、40%、60%、80%、95%乙醇洗脱,收集洗脱液,计算解吸率。
由图7可知,20%和40%的乙醇解吸率低,随着乙醇体积分数的增加,解吸率逐渐上升。 80%乙醇可把大孔树脂上约80%的花色苷解吸下来,从经济角度考虑,没有必要使用更高体积分数的乙醇。
2.2.4 上样流速对黑米花色苷吸附率的影响

图8 上样流速对吸附率的影响Fig.8 Effect of flow rate for sample loading onto AB-8 on adsorption rate of black rice anthocyanins
由图8可知,随着上样流速的增加,大孔树脂对黑米花色苷的吸附性能下降,流速不同,花色苷与树脂的接触时间不同,吸附率也会发生变化。当流速达到1BV/h后,树脂的吸附率明显下降,流速降低,树脂的吸附率也较高,但导致实验的周期延长,所以把吸附流速控制为1BV/h。
2.2.5 解吸流速对解吸率的影响
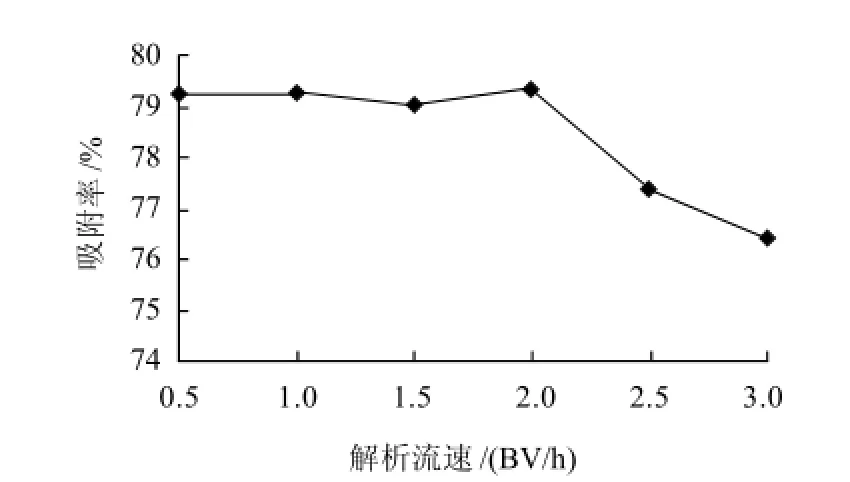
图9 洗脱剂流速对解析率的影响Fig.9 Effect of elution solvent flow rate on desorption rate of black rice anthocyanins
由图9可知,随着洗脱液流速的增加,大孔树脂对黑米花色苷的解吸性能呈下降趋势,说明流速增加不利于树脂对花色苷的解吸,可能是若流速过快,洗脱剂不能与被吸附的花色苷充分作用而将其从树脂上洗脱出来。但流速过低,导致实验的周期延长,所以把解吸流速控制为2BV/h。
2.2.6 大孔吸附树脂对花色苷提取纯化效果
根据大孔吸附树脂的选型结果,用AB-8作为分离纯化花色苷的吸附剂,上层析柱,用80%乙醇溶液进行洗脱。收集洗脱液后,减压浓缩后,干燥,分析其花色苷含量。

表8 AB-8对花色苷提取的效果Table 8 Anthocyanins contents in crude and purified extracts from black rice and corresponding yields
由图8可知,黑米花色苷提取物经过大孔吸附树脂处理后,其纯度大大提高,花色苷纯度提高了6.02倍,表明用大孔吸附树脂对黑米花色苷提取纯化效果是较理想的。
3 讨 论
酸性乙醇溶液法是提取色素最常用的一种方法,其方便、快捷、简单。文献报道,酸化水溶液对黑米中的花色苷类物质也具有相当好的萃取能力,可以提高色素的纯度[12]。为得到黑米色素提取的最佳工艺条件,不少学者对其做了大量的研究。
张福娣等[13]对浸提时间、浸提温度、料液比、浸提剂的体积分数4个因素进行正交试验,表明浸提剂(乙醇)和浸提温度对色素的浸提率有显著的影响,料液比和浸提时间对浸提率影响不显著,最佳的浸提工艺条件为浸提温度80℃、浸提时间30min、料液比1:10,浸提剂体积分数为50%的乙醇溶液。张名位[14]通过正交试验优化出黑米色素的最佳浸提条件为:以60%乙醇为溶剂,黑米皮料液比为1:4,60℃,浸提4h。 本研究确定了50%乙醇溶液 (含有0.5% HCl)作为浸提剂,料液比为1:10,浸提温度50℃,浸提时间1h,3次提取,浸提率达到了84.72%。Cacace等[15]认为,提高浸提温度会导致黑醋栗花色苷降解增加,从而降低提取物中花色苷的含量,所以本实验采用了较低的浸提温度,每次提取时间为1h,这样可以缩短花色苷的受热时间。
大孔吸附树脂是一类非离子型高分子吸附剂,能够借助范德华力和氢键从溶液中吸附各种有机物[16],具有简单易行、成本低、效率高、稳定性好和容易再生等优点,因此,大孔树脂广泛应用于天然产物的分离制备。侯方丽等[17]对分离黑米皮的大孔吸附树脂进行了筛选,确定AB-8为最佳树脂,黑米皮经AB-8大孔树脂纯化后,其总花色苷含量较纯化前的提高2.38倍。本实验结果显示,AB-8大孔树脂对黑米皮花色苷具有较好的吸附和解吸能力,上样流速1BV/h,以体积分数为80%乙醇为解吸剂,洗脱速度为2BV/h,经AB-8大孔
树脂纯化后,其总花色苷含量较纯化前的提高6.02倍,得含22.59%花色苷的提取物。说明该方法具有收率高、成本低、操作简单等特点,易于实现黑米的工业化生产,推动功能性黑米食品的发展。
4 结 论
通过正交试验优化出最佳提取工艺为乙醇-水-盐酸比例50:50:0.5、温度50℃、固液比1:10、提取时间为每次1 h、提取次数3次。
通过大孔吸附树脂吸附及解吸能力比较,筛选出AB-8为最佳树脂,洗脱剂为80%乙醇溶液,上样流速为1BV/h,解吸流速为2BV/h。
测定经(AB-8)树脂纯化后提取物中花色苷的含量达到22.59% (粗提物中花色苷含量为3.448%)。实验表明,经过大孔树脂纯化,可去除了大量杂质,提高黑米花色苷的含量。
[1]张名位, 郭宝江, 张瑞芬, 等. 黑米抗氧化活性成分的分离纯化和结构鉴定[J]. 中国农业科学, 2006, 39(1): 153-160.
[2]SULLIVAN J. Anthocyanin[J]. CPNewsletter, 1998, 27(3): 26-28.
[3]YAO Lihu, JIANG Yueming, SHI J, et al. Flavonoids in food and their health benefits[J]. Plant Foods Human Nutriton, 2004, 59(3): 113-122.
[4]WANG Hong, CAO Guohua, PRIOR R L. Oxygen radical absorbing capacity of anthocyanins[J]. Journal of Agricultural and Food Chemistry, 1997, 45(2): 304-309.
[5]TAMURA H, YANGGAMI A. Antioxidant activity of monoacylated anthocyanins isolated from muscat bailey a grape[J]. Journal of Agricultural and Food Chemistry, 1994, 42(3): 1612-1615.
[6]LAPIDOT T, HAREL S, AKIRI B, et al. PH-dependent forms of red wine anthocyanins as antioxidants[J]. Journal of Agricultural and Food Chemistry, 1999, 47(1): 67-70.
[7]夏效东, 凌文华, 夏敏, 等. 黑米花色苷提取物对apoE基因缺陷小鼠动脉粥样硬化晚期斑块的影响[J]. 食品科学, 2006, 27(3): 213-215.
[8]谭仁祥. 植物成分分析[M]. 北京: 科学出版社, 2002: 67-87.
[9]高孔荣, 黄惠华, 梁照为. 食品分离技术[M]. 广州: 华南理工大学出版社, 1998: 5-7.
[10]麻秀萍, 蒋朝晖, 杨玉琴, 等. 大孔吸附树脂对银杏叶黄酮的吸附研究[J]. 中国中药杂志, 1997, 22(9): 539-542.
[11]罗艳玲, 欧仕益. 大孔树脂在食品活性成分分离中的应用[J]. 食品与机械, 2005, 21(5): 81-83.
[12]张晴. 黑米色素提取精制工艺的研究[J]. 青岛大学学报, 2000, 15(2): 24-26.
[13]张福娣, 苏金为, 蔡碧琼. 黑米色素提取工艺及其性质表征[J]. 福建农林大学学报: 自然科学版, 2006, 35(1): 93-97.
[14]张名位. 黑米抗氧化与降血脂的活性成分及其作用机理[D]. 广州: 华南师范大学, 2003.
[15]CACACE J E, MAZZA G. Optimization of extraction of anthocyanins from blackcurrants with aqueous ethanol[J]. Journal of Food Science, 2003, 68: 240-248.
[16]吴梧桐. 生物制药工艺学[M]. 北京: 中国医药科技出版社, 1998.
[17]侯方丽, 张名位, 苏东晓, 等. 黑米皮花色苷的大孔树脂吸附纯化研究[J]. 华南师范大学学报: 自然科学版, 2009(1): 100-104.
Extraction and Purification of Anthocyanins from Black Rice
HOU Zhao-hua,ZHAI Hu-qu,WAN Jian-min,REN Gui-xing*
(Institute of Crop Science, Chinese Academy of Agricultural Sciences, Beijing 100081, China)
To maximize anthocyanins yield from black rice extracted with ethanol solution, one-factor-at-a-time and orthogonal array design methods were used to examine the optimal values of 5 main technological parameters. Cyanidin-3-glucoside was served as the
ubstance for the quantification of anthocyanins. Subsequently, the crude anthocyanin extract obtained was purified by macroporous resin absorption. Results showed that an optimal anthocyanins yield was achieved through extracting the material with a 10-fold (mL/g) volume of a mixture composed of absolute ethanol, water and hydrochloric acid (50: 50:0.5, V/V) for 1 h 3 times each time at 50 ℃. Among 9 macroporous resins tested, AB-8 exhibited the best compromise between high adsorption and high desorption rates so as to be used to purify the crude anthocyanin extract from black rice. In the purification, the optimal elution solvent was 80% aqueous ethanol and the optimal values of flow rate for sample loading onto AB-8 and elution solvent flow rate were 1.0 and 2.0 BV/h, respectively. The purified anthocyanin extract was determined to have 22.59% anthocyanins content (the value in the crude anthocyanin extract 3.448%) with a 6.02-fold enrichment, which demonstrated an effective purification.
black rice;macroporous resins;anthocyanins;extraction;purification
TS218
A
1002-6630(2010)10-0053-07
2009-08-03
农业部公益性行业(农业)科研专项经费项目(200803056)
侯召华(1982—),男,博士研究生,研究方向为粮食功能成分。 E-mail:kevin19820427@163.com
* 通信作者: 任贵兴(1963—),男,研究员,博士,研究方向为粮食作物功能成分的开发利用。E-mail:renguixing@caas.net.cn

