松仁蛋白多肽对小鼠免疫功能的影响
张立钢,赵玉红,李 莉
(1.东北农业大学食品学院,哈尔滨 150030;2.东北林业大学林学院,哈尔滨 150040)
红松(Pinus koraiensis Sieb.et Zucc)为松科,松属,常绿针叶乔木,是主产于中国小兴安岭的珍贵树种。红松籽又称为海松籽、新罗(朝鲜)松籽[1]。红松松仁蛋白质含量在13%~20%,氨基酸种类齐全,是一种优良的植物蛋白源[2],以红松松仁为原料生产既有营养性,又有功能性的产品具有广阔的前景。利用酶水解蛋白质生产生物活性肽是蛋白质利用的有效手段之一。生物活性肽具有易消化吸收的特点,不仅能提供人体生长发育所需的营养成分,还可调节机体的免疫功能、促进矿物质的吸收、调节神经系统、并有抗氧化、降血压、降血脂、降胆固醇、护肝、抗菌等作用[3-4]。研究表明,多种蛋白水解获得的多肽都具有良好的免疫调节功能,能调动机体自身免疫系统,促进自身免疫能力的提高。多肽以其分子质量低、活性强、用量少的独特优势,越来越多地引起人们的重视,其工业化生产也成为当前食品和医药行业发展的大趋势[5]。
目前,对多种不同来源的蛋白酶解获得生物活性肽进行免疫功能研究的报道较多[6-8],但对松仁蛋白肽相关研究未见报道。本文研究松仁蛋白多肽对小鼠免疫功能的影响,通过测定免疫器官重量、细胞免疫功能、体液免疫功能、单核-巨噬细胞的吞噬功能,测定松仁多肽对小鼠的免疫调节作用,以此作为松仁多肽功能性食品产品开发利用的基础。
1 材料与方法
1.1 材料与试剂
松仁多肽精制品(Pine kernel polypeptide,PKP)实验室自制;昆明种雄性小鼠购自黑龙江省哈尔滨铁路局肿瘤医院;绵羊红细胞(SRBC);印度墨汁购自上海长江日用粘合材料厂;其他试剂均为分析纯。
1.2 仪器与设备
722S可见分光光度计,上海精密科学仪器有限公司;BPN恒温培养箱,上海一恒科学仪器有限公司;游标卡尺,哈尔滨量具刃具厂;微量注射器,江西侨明医疗器械有限公司;微量血凝试验板、血色素吸管、计时器等。
1.3 方法
1.3.1 松仁多肽制备工艺流程
松仁粗蛋白→脱脂→酶解→灭酶(100℃,5 min)→离心(4 500 r·min-1,5 min)→上清液→真空冷冻干燥→松仁多肽粗品→复溶→Sephadex G-25凝胶过滤层析(以0.02 mol·L-1pH 7的磷酸盐缓冲液洗脱)→冷冻干燥→松仁多肽精制品(PKP)。
1.3.2 试验动物及分组
昆明种雄性小鼠,体重18~20 g。按体重随机分为对照组、低剂量组、中剂量组及高剂量组各40只,分别将松仁多肽精制品以150、300、600 mg·kg-1·d-13 个剂量灌胃 3 个试验组,对照组给以同等体积蒸馏水。各组均自由饮水、摄食。
1.3.3 脏器/体重的测定
小鼠饲喂30 d后,称重,处死,取其肝、脾和胸腺,用滤纸吸干表面血污,称重,记录数据。按照公式(1)和(2)进行计算[9]。

1.3.4 细胞免疫功能的测定
采用DTH-足跖增厚法(迟发型变态反应)对小鼠细胞免疫功能进行检测[10]。
小鼠饲喂30 d后,用体积分数为2%SRBC免疫,每只鼠腹腔注射 0.2 mL(约 1.00×108个SRBC)。免疫后4 d,测量左后足跖部厚度,然后在测量部位皮下注射体积分数为20%SRBC,每只鼠注射 20 μL(约 1.00×108个 SRBC),于注射后24 h分别测量左后足跖部厚度,同一部位测量3次,取平均值。以处理前后足跖厚度差值(足跖肿胀度)来表示DTH程度。
1.3.5 体液免疫功能的测定
采用血凝法(血清溶血素的测定)对小鼠体液能免疫功能进行检测[11]。
小鼠饲喂30 d后,每只鼠腹腔注射0.2 mL的2%SRBC进行免疫,4~5 d后,摘除眼球取血于离心管内,放置约1 h,将凝固血与管壁剥离,使血清充分析出,2 000 r·min-1离心 10 min,收集血清。用生理盐水将血清倍比稀释,将不同稀释度的血清分别置于微量血凝试验板内,每孔100 μL,再加入100 μL 0.5%的SRBC悬液,混匀,装入湿润的平盘内加盖,于37℃温箱孵育3 h,观察血球凝集程度。
血清凝集程度分5级(0-Ⅳ) 记录,按公式(3)计算抗体积数,比较受试组和对照组的抗体积数差异。
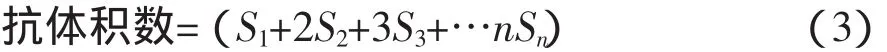
式中,1,2,3,……,n代表对倍稀释的指数,S代表凝集程度的级别,抗体积数越大,表示血清抗体越高。
0级-红细胞全部下沉,集中在孔底部形成致密的圆点状,四周液体清晰。
Ⅰ级-红细胞大部分沉集在孔底成圆点状,四周有少量凝集的红细胞。
Ⅱ级-凝集的红细胞在孔底形成薄层,中心可以明显见到一个疏松的红点。
Ⅲ级-凝集的红细胞均匀地铺散在孔底成一薄层,中心隐约可见一个小红点。
Ⅳ级-凝集的红细胞均匀地铺散在孔底成一薄层,凝块有时成卷折状。
1.3.6 单核-巨噬细胞功能的测定
采用小鼠碳廓清试验对小鼠单核-巨噬细胞的吞噬功能进行检测[12]。
将饲喂30 d的小鼠称重,尾静脉注射稀释的墨汁(每10 g体重注射0.1 mL),立即计时,2 min后用毛细管从眼眶静脉丛取血20 μL,迅速将其加入到2 mL Na2CO3溶液中,混匀。以Na2CO3溶液作为空白对照,在600 nm处测定光吸收值(OD1);10 min后,再次从眼眶静脉丛取血20 μL,将其加入到2 mL Na2CO3溶液中,测定光吸收值(OD2)。由公式(4)和(5)计算吞噬指数α值:
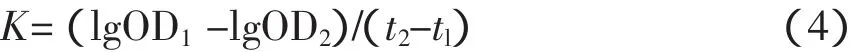
式中,t2-tl代表测定的间隔时间(min)。

1.3.7 氨基酸组成的测定
用氨基酸自动分析仪进行氨基酸组成分析,由黑龙江省农业科学院测试中心测定。
1.3.8 数据处理方法
采用SPSS13.0统计分析软件进行统计学处理,通过单因素方差分析(One-way ANOVA)来评价结果的统计差异性。
2 结果与分析
2.1 松仁肽组成分析
松仁蛋白经酶解制得松仁蛋白肽粗品后,利用层析技术(Sephadex G-25凝胶过滤)进行分离制备松仁蛋白多肽,图1为层析分离结果。
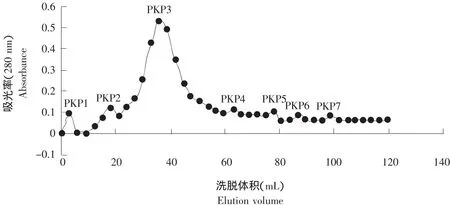
图1 Sephadex G-25分离松仁多肽洗脱图Fig.1 Elution curve of hydrolysates with Sephadex G-25 gel column
由图1可知,松仁蛋白多肽由PKP1-7共7个组分构成。通过对比同一条件下标准蛋白层析结果可知:PKP1、PKP2组分分子质量大于23 105 u,为未充分水解的松仁蛋白;PKP3组分分子质量大约为3 776 u,该组分是松仁蛋白多肽;PKP4-7组分分子质量低于249 u,由游离氨基酸、二肽或三肽构成。
氨基酸组成分析结果表明,PKP3组分谷氨酸和精氨酸这两种氨基酸含量相比其他氨基酸丰富,分别为19.98%和16.86%。精氨酸可有效地增强体液免疫,促进免疫球蛋白的产生,甚至可以对抗糖皮质激素的免疫抑制作用[13-14]。因此对PKP3组分进行小鼠免疫功能试验。
2.2 小鼠脏器/体重比
收集PKP3,冷冻干燥得到松仁多肽精制品(PKP)。按照公式(1)和(2)计算灌喂30 d后脏体比。结果见表1。由表1可知,松仁多肽对小鼠脏器重量和脏体比有影响。PKP高剂量组小鼠脾脏重和脾脏指数显著高于对照组(P<0.05),中剂量组脾脏指标高于对照组,但差异不显著;PKP中、高剂量组小鼠胸腺重和胸腺指数显著高于对照组(P<0.05),高剂量组胸腺指数与对照组相比具有极显著差异(P<0.01)。由试验结果可见,中剂量(300 mg·kg-1·d-1)摄入即可引起小鼠免疫器官的显著变化。
表1 PKP对小鼠免疫器官重量的影响Table 1 Effects of PKP on weights of immune organs in mice(±S,n=10)
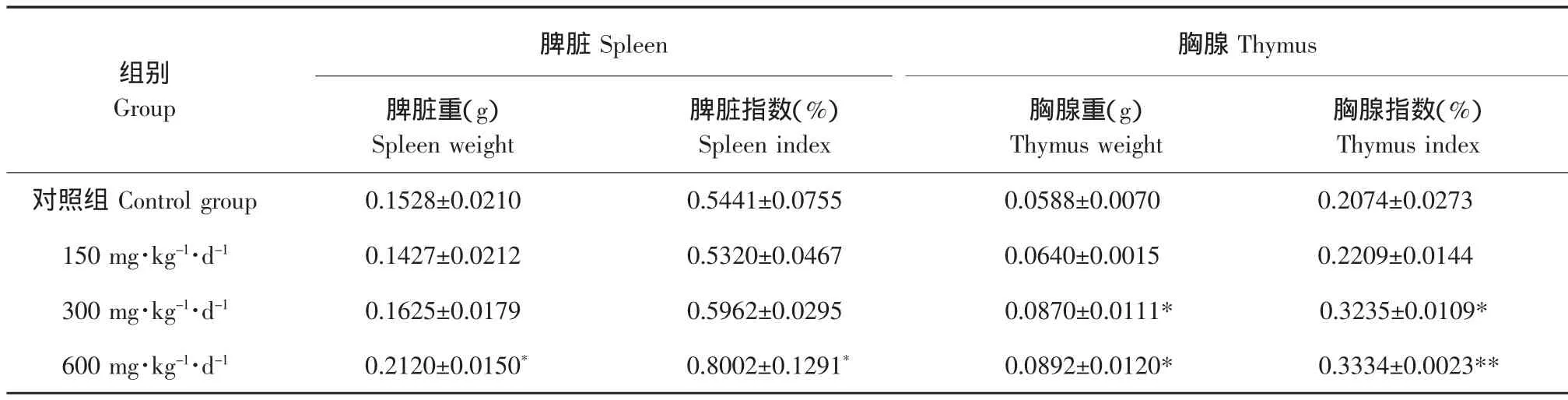
表1 PKP对小鼠免疫器官重量的影响Table 1 Effects of PKP on weights of immune organs in mice(±S,n=10)
注:*代表差异显著(P<0.05);**代表差异极显著(P<0.01)。以下同。Note:*denote significant difference at 0.05 level;**denote extremely significant difference at 0.01 level.The same as below.
脾脏Spleen组别Group对照组Control group 150 mg·kg-1·d-1脾脏重(g)Spleen weight 0.1528±0.0210 300 mg·kg-1·d-1 0.1427±0.0212 0.1625±0.0179 600 mg·kg-1·d-10.2120±0.0150*脾脏指数(%)Spleen index 0.5441±0.0755 0.5320±0.0467 0.5962±0.0295 0.8002±0.1291*胸腺Thymus胸腺重(g)Thymus weight 0.0588±0.0070 0.0640±0.0015 0.0870±0.0111*0.0892±0.0120*胸腺指数(%)Thymus index 0.2074±0.0273 0.2209±0.0144 0.3235±0.0109*0.3334±0.0023**
2.3 小鼠细胞免疫功能
采用DTH-足跖增厚法(迟发型变态反应)测定PKP对小鼠细胞免疫功能的影响,结果见表2。
表2PKP对小鼠迟发型变态反应(DTH)的影响Table 2 Effects of PKP on delayed type hypersensitivity reaction(DTH)in mice(±S,n=10)
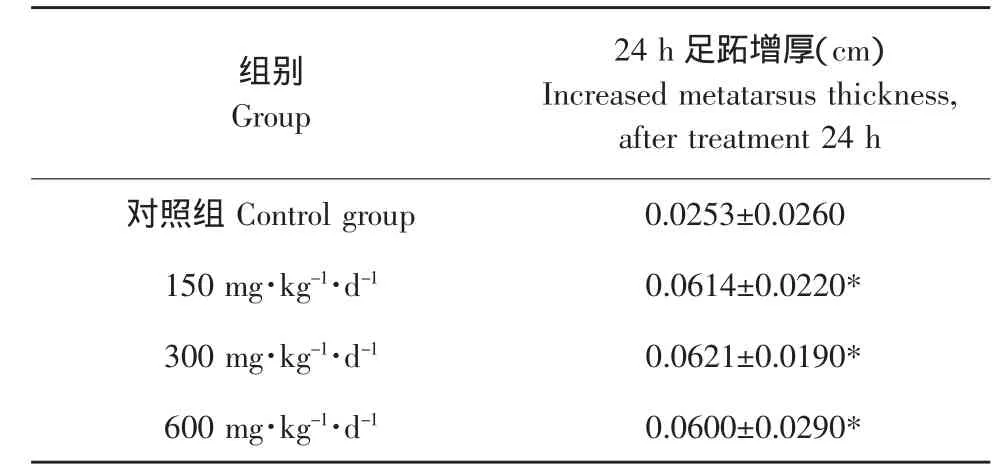
表2PKP对小鼠迟发型变态反应(DTH)的影响Table 2 Effects of PKP on delayed type hypersensitivity reaction(DTH)in mice(±S,n=10)
组别Group对照组Control group 150 mg·kg-1·d-1 24 h足跖增厚(cm)Increased metatarsus thickness,after treatment 24 h 0.0253±0.0260 300 mg·kg-1·d-1 0.0614±0.0220*0.0621±0.0190*600 mg·kg-1·d-10.0600±0.0290*
由表2可知,试验组小鼠在摄入PKP 30 d之后,表现出对SRBC诱发的迟发型变态反应的增强作用,表现在24 h后足跖的增厚,3个试验组中中等剂量组(300 mg·kg-1·d-1)足跖增厚最高。低剂量组(150 mg·kg-1·d-1)、中剂量组(300 mg·kg-1·d-1)和高剂量组(600 mg·kg-1·d-1)在处理 24 h 后足跖增厚高于对照组(P<0.05)。由试验结果可知,PKP对SRBC诱发的迟发型变态反应有促进作用,可作为免疫促进剂对小鼠的细胞免疫功能产生影响。
2.4 小鼠体液免疫功能
采用血凝法(血清溶血素测定)测定PKP对小鼠体液免疫功能的影响,根据血清凝集程度的级别,按公式(3)计算抗体积数,比较受试组和对照组的抗体积数差异。抗体积数越大,表示血清抗体越高。结果见表3。
表3 PKP对小鼠体液免疫功能的影响Table 3 Effects of PKP on humoral immunity function in mice(±S,n=10)
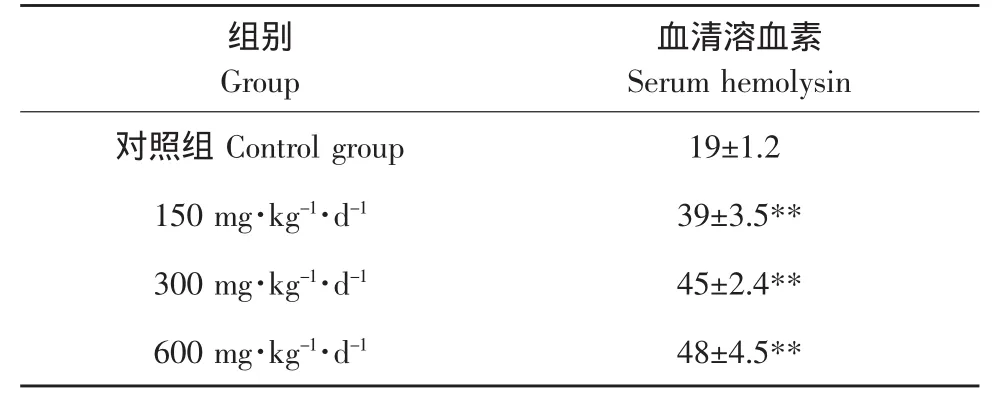
表3 PKP对小鼠体液免疫功能的影响Table 3 Effects of PKP on humoral immunity function in mice(±S,n=10)
组别Group对照组Control group 150 mg·kg-1·d-1血清溶血素Serum hemolysin 19±1.2 300 mg·kg-1·d-1 39±3.5**45±2.4**600 mg·kg-1·d-148±4.5**
由表3可知,PKP摄入使小鼠的血清在更高的稀释度下使SRBC凝集,即具有更高的抗体水平,随着剂量的增高,抗体积数增加。试验组(150、300 和 600 mg·kg-1·d-1)小鼠的抗体积数 (血清凝血素水平)高于对照组(P<0.01)。可见,PKP能增强小鼠的体液免疫功能。
2.5 小鼠单核-巨噬细胞功能
采用小鼠碳廓清试验测定PKP摄入对小鼠单核-巨噬细胞吞噬功能的影响。由公式(4)、(5)计算吞噬指数α值,以吞噬指数表示小鼠碳廓清能力,结果见表4。
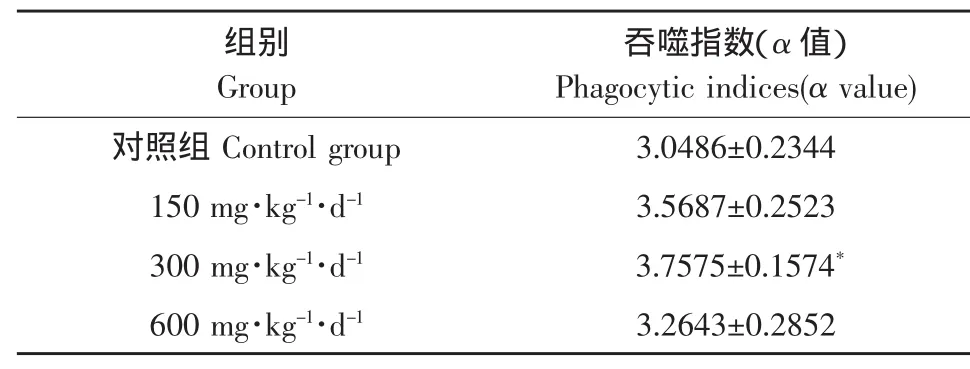
表4 PKP对小鼠巨噬细胞吞噬功能的影响Table 4 Effects of PKP on macrophage phagocytosis function of the mice(X¯±S,n=10)
由表4可知,PKP摄入对小鼠的单核-巨噬细胞的吞噬功能有影响,试验组吞噬指数高于对照组。中剂量组(300 mg·kg-1·d-1)小鼠的吞噬指数最高,吞噬功能最强,其次为低剂量组,再次为高剂量组。中剂量组(300 mg·kg-1·d-1)与对照组相比有显著性差异(P<0.05)。可见,中等剂量PKP可提高小鼠的单核-巨噬细胞的吞噬功能。
3讨 论
3.1 松仁多肽的构成与免疫功能的关系
松仁蛋白经酶解可以制得不同分子质量的肽,经凝胶过滤层析得到的松仁多肽,主要组分分子质量大约为3 776 u。多肽氨基酸构成与对于机体的免疫功能有关,精氨酸对机体免疫具有调节功能,主要是通过精氨酸-NO途径以及对内分泌激素的影响实现[14],精氨酸可促进细胞免疫功能,引起胸腺重量增加增强巨噬细胞吞噬能力,增强体液免疫,促进免疫球蛋白产生。松仁多肽的氨基酸分析结果表明,层析分离的7个组分中,松仁多肽PKP3中精氨酸含量高达16.86%,针对这一组分进行免疫功能研究,符合本研究的目标和进行深入研究松仁蛋白功能性实际意义。
3.2 松仁多肽对小鼠免疫器官的影响
免疫系统是机体内担负免疫功能的物质结构,由免疫器官、免疫细胞和免疫分子构成,它们是机体免疫应答的物质基础。免疫器官按作用不同,分为中枢免疫器官和外周免疫器官。胸腺是中枢免疫器官,脾脏是外周免疫器官,二者均是体内的主要免疫器官,与体液免疫和细胞免疫均有密切关系[15]。胸腺指数和脾脏指数的大小直接反映机体免疫水平的高低。
在本研究中,PKP的摄入能显著增大小鼠免疫器官,这与其他肽制备物对小鼠免疫功能的影响相似,如红三叶寡肽也使小鼠脾脏指数和胸腺指数增加[16]。中等剂量使小鼠胸腺指数增高,而高剂量同时增加脾脏指数和胸腺指数。这种现象可以看作松仁多肽对免疫器官直接刺激的结果。两指数都增加,说明PKP对细胞免疫和体液免疫都有促进作用。
3.3 松仁多肽对小鼠细胞免疫功能的影响
迟发型变态反应又称“迟发型超敏反应”,属IV型变态反应,是由T淋巴细胞介导的一种超敏反应,无需抗体或补体参加,在变应原作用下形成致敏淋巴细胞,当再次接触相同变应原时,表现出一种迟缓的、以单个核细胞浸润和细胞变性坏死为特征的局部变态反应性炎症,在24~48 h达到高峰然后逐渐消退。
本研究中以足跖厚度变化值来表示迟发型变态反应的程度,PKP的摄入使小鼠的迟发型变态反应增强,低、中和高剂量组小鼠的足跖变化显著高于对照组。各剂量组引起的迟发变态反应在中等剂量时最强。
3.4 松仁多肽对小鼠体液免疫功能的影响
抗体是机体免疫系统中的重要组成部分,具有结合抗原和激活补体等多种生物学功能,血清抗体水平可反映机体免疫力的高低。
血清中溶血素含量的高低是衡量体液免疫的重要指标[17-18]。通过测定血清中溶血素(抗体)含量即可反映出食源性生物活性肽对体液免疫的影响。在肽对于小鼠免疫功能研究中,红三叶寡肽可以显著提高小鼠体液免疫功能[16],本研究中,PKP的摄入使小鼠的体液免疫水平提高(P<0.01),表明PKP是调节体液免疫应答水平的重要物质,通过调节细胞因子的生成发挥调节机体免疫功能的作用。
3.5 松仁多肽对小鼠单核-巨噬细胞功能的影响
单核-巨噬细胞的吞噬能力是衡量机体非特异性免疫功能的标志之一[19]。当细菌、异物等抗原性物质进入机体后,可被单核-巨噬系统迅速吞噬和清除,因而巨噬细胞廓清指数可以反映其吞噬功能的强弱[8]。巨噬细胞有吞噬、处理和呈递抗原,激活淋巴细胞和分泌多种可溶性因子以加强淋巴细胞活性的功能,参与免疫反应的传入支;同时它也是免疫效应细胞,能杀死细菌和肿瘤细胞,引起组织损伤,而参与免疫反应的传出支。在免疫反应中,免疫细胞通过直接接触和它们分泌的可溶性因子发挥免疫调节和免疫效应作用。
本研究发现PKP摄入引起的小鼠单核-巨噬细胞的吞噬能力增强,表现出随着PKP摄入剂量升高而出现先升高再降低的趋势,具有剂量效应关系,这种变化趋势与酶解鸡蛋清小肽混合物对小鼠免疫功能的影响相似[20]。对于松仁多肽,在中等剂量时,单核-巨噬细胞功能增强相比对照组达到显著水平。这表明,适当剂量的松仁多肽对小鼠非特异免疫功能有提高作用。
4 结论
松仁蛋白多肽对小鼠具有免疫调节功能,表现出增加正常小鼠脾脏和胸腺指数,增强小鼠细胞免疫、体液免疫和单核-巨噬细胞的吞噬功能,由此可认为松仁蛋白多肽能增强小鼠免疫功能。
[1] 王振宇,杨立宾,魏殿文.红松松仁中天然产物的研究进展[J].国土与自然资源研究,2008(2):90-91.
[2] 韩宁林.值得重视的松籽资源[J].林业科技开发,1996(4):12-13.
[3] 崔洪斌.大豆生物活性物质的开发与应用[M].北京:中国轻工业出版社,2001:3.
[4] Clare D A,Swaisgood H E,Bioactive milk peptides,a prospectus[J].J Dairy Sci,2000,83(6):1187-1195.
[5] 王秋韫,庞广昌,陈庆森.免疫活性肽的研究进展与展望[J].食品科学,2002,23(7):136-139.
[6] 姜红,乐国伟,尹晓平,等.马鹿茸血酶解肽体内免疫功能及抗氧化功能关系的研究[J].天然产物研究与开发,2009,21(5):757-760.
[7] 谢永玲,张明月,张静,等.海参肽对小鼠的免疫调节作用[J].中国海洋药物,2009,28(4):43-45.
[8] 宋琳琳,陈立,陈五岭.食源性生物活性肽对小鼠免疫功能的影响[J].西北大学学报,2009,39(4):612-616.
[9] 毛根年,许牡丹.功能食品生理特性与检测技术[M].北京:化学工业出版社,2005:1.
[10]Corsini A C,Bellucci S B,Costa M G.A simple method of evaluating delayed typed hypersensitivity in mice[J].J Immunol Methods,1979,30(2):195-200.
[11]徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2005.
[12]徐叔云,卞如濂,陈修.药理实验方法学[M].北京:人民卫生出版社,1982.
[13]LeBien T W.Arginine:an unusual dietary requirement of pre-B lymphocytes[J].J Clin Invest,2002,110(10):1411-1413.
[14]李玉庆,张小平,程爱国.精氨酸的免疫调理作用[J].中国煤炭工业医学杂志,2007,10(2):121-122.
[15]张树清,李小成,孙玉华.大豆低聚糖对小鼠体液免疫功能的影响试验研究[J].微生物学杂志,2007,27(2):97-99.
[16]张勇,朱宇旌,刘勇,等.红三叶寡肽对小鼠免疫功能的影响[J].安徽农业科学,2007,35(35):11338-11339,11342.
[17]Bin-Hafeez B,Haque R,Parvez S,et al.Immunomodulatory effects of fenugreek(Trigonella foenum graecum L.)extract in mice[J].International Immunopharmacology,2003,3(2):257-265.
[18]余传霖,叶天星,陆德源,等.现代医学免疫学[M].上海:上海医科大学出版社,1998.
[19]杨铁虹,贾敏,梅其炳.当归多糖对小鼠免疫功能的调节作用[J].中成药,2005,27(5):563-565.
[20]田刚,陈代文,余冰,等.酶解鸡蛋清小肽混合物对小鼠免疫功能的影响[J].中国畜牧杂志,2005,41(5):14-17.

