吡格列酮对胰岛素抵抗细胞糖代谢糖异生的影响
韩坤 李德恒 袁磊
(漯河医学高等专科学校生理教研室,河南 漯河 462002)
胰岛素抵抗指胰岛素在周围组织摄取和清除葡萄糖的作用减低,在胰岛素抵抗状态下,肝糖原分解增加,糖异生作用增强,导致肝糖输出增多[1]。近年来,噻唑烷二酮类药物(Thiazolidinedionederivatives,TZDs)因其可改善组织的胰岛素抵抗状态,增强组织对胰岛素的敏感性而越来越受到重视[2,3]。
本研究采用3T3-L1脂肪细胞复制胰岛素抵抗模型[4],观察TZDs类药物吡格列酮对胰岛素抵抗3T3-L1脂肪细胞葡萄糖消耗及糖异生作用的影响,进一步在细胞水平明确吡格列酮对糖代谢影响的分子机制。
1 材料与方法
1.1 材料和试剂 3T3-L1小鼠前脂肪细胞(中科院上海细胞所),地塞米松与3-异丁基-1-甲基黄嘌呤均(Sigma),胰岛素注射液(诺和公司),DMEM培养基(Gibco),乳酸钠(上海化学试剂总厂上海试剂三厂),考马斯亮兰法总蛋白测定试剂盒(南京建成生物工程研究所),葡萄糖临床检测试剂盒(四川迈克公司)。
1.2 实验仪器 酶标仪(Thermo Electron),CO2培养箱(Forma Scientific),超净工作台(北京半导体厂),倒置显微镜(Olympus IX),BP210S电子天平(赛多利斯有限公司)。
1.3 方法
1.3.1 3T3-L1脂肪细胞细胞培养[5]参考AnilKumar[6]分化前脂肪细胞的方法,对细胞进行分化:将3T3-L1前脂肪细胞置于含10%小牛血清的DM EM 高糖培养基中,37℃、5%CO2、饱和湿度下培养。待细胞融合2d后,加入含0.5 mmol◦L-13-异丁基-1-甲基黄嘌呤、0.25μ mol◦ L-1地塞米松、10mg◦ L-1胰岛素以及10%小牛血清的DM EM高糖培养基培养48h,换含10 mg◦L-1胰岛素的培养基再培养 48 h,随后以 10%小牛血清的DMEM高糖培养基继续培养2d,换培养液1次,诱导分化8~12 d的3T3-L1细胞90%以上呈脂肪细胞表型可用于试验。
1.3.2 3T3-L1脂肪细胞胰岛素抵抗细胞模型的建立[7,8]将上述分化成熟的3T3-L1脂肪细胞调整细胞密度转入48孔细胞培养板中继续培养,分为空白组及模型组,空白组加入正常培养基,模型组加入含终浓度为 1μ mol◦L-1地塞米松的培养基,孵育48h,孵育结束后,弃去培养液,用PBS轻轻洗涤2次,即为正常对照3T3-L1脂肪细胞和胰岛素抵抗3T3-L1脂肪细胞模型。
1.3.3 吡格列酮对胰岛素抵抗3T3-L1脂肪细胞细胞葡萄糖消耗量的影响[9]将上述分化成熟的3T3-L1脂肪细胞调整细胞密度转入48孔细胞培养板中培养,细胞密度为3×105个◦孔-1,复制上述胰岛素抵抗模型。将细胞分为正常细胞对照组,模型组和吡格列酮组(浓度为 10-5mol◦L-1)孵育12h后,再按是否加入生理浓度的胰岛素(10-9mol◦L-1)将各组均分为两个平行组,继续温浴12h,并设无细胞培养基对照组,取各组上清液用GOD-POD法(葡萄糖氧化酶法)测定葡萄糖含量[10]。细胞所消耗的葡萄糖量(GC)=无细胞对照组培养液中葡萄糖含量-各组细胞培养液中葡萄糖含量。
1.3.4 吡格列酮对胰岛素抵抗3T3-L1脂肪细胞细胞糖异生作用的影响 同样复制上述胰岛素抵抗模型之后换以Krebs-Ringer缓冲液,将细胞分为正常细胞对照组,模型组和吡格列酮组(浓度为10-5mol◦L-1)加入10-5mol◦L-1吡格列酮,再按是否加入生理浓度的胰岛素(10-9mol◦L-1)以及是否含有底物(终浓度为10 mmol◦L-1的乳酸)将上述三组细胞各分一平行组,继续孵育2h。孵育结束后,取上清测定葡萄糖含量;板中下层细胞用200g◦L-1的KOH裂解,用考马斯亮兰法测定蛋白含量。糖异生量(μ mol◦mg-1)=葡萄糖生成量(μ mol)/蛋白含量(mg)
1.4 统计学处理 实验各组同批内重复6次,计量数值用表示。采用统计软件SPSS17.0行统计学分析,两组间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05为有统计学意义。
2 结果
2.1 吡格列酮对胰岛素抵抗3T3-L1脂肪细胞细胞葡萄糖消耗量的影响
在无生理浓度胰岛素存在条件下,胰岛素抵抗3T3-L1脂肪细胞组糖耗与对照组相比并无明显差异;给予生理胰岛素后,对照组和胰岛素抵抗3T3-L1脂肪细胞组糖耗均增加,但后者明显低于前者(0.85±0.03 vs 0.68±0.02,P<0.05)。给予吡格列酮后,仅与细胞孵育12h即可显著促进胰岛素抵抗3T3-L1脂肪细胞组糖耗,与模型组比较差异有统计学意义((0.6±0.01 vs 1.7±0.02,P<0.05);加入生理胰岛素时,吡格列酮表现出与胰岛素协同的促进胰岛素抵抗3T3-L1脂肪细胞糖耗的作用。(图1)
2.2 吡格列酮对胰岛素抵抗3T3-L1脂肪细胞糖异生作用的影响
在无底物乳酸和胰岛素存在条件下,吡格列酮对胰岛素抵抗3T3-L1脂肪细胞糖异生均没有表现出明显抑制作用。底物乳酸存在条件下,生理浓度胰岛素可显著抑制胰岛素抵抗3T3-L1脂肪细胞糖异生作用;给予吡格列酮后,胰岛素抵抗3T3-L1脂肪细胞的糖异生作用也受到明显抑制,且吡格列酮与胰岛素有协同抑制胰岛素抵抗3T3-L1脂肪细胞糖异生的作用(表1)。
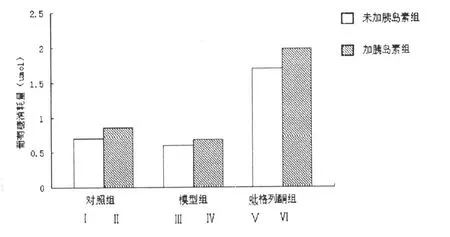
图1 吡格列酮对胰岛素抵抗3T3-L1脂肪细胞细胞葡萄糖消耗量的影响(,n=6)
表1 吡格列酮对胰岛素抵抗3T3-L1脂肪细胞细胞糖异生作用的影响(,n=6)

表1 吡格列酮对胰岛素抵抗3T3-L1脂肪细胞细胞糖异生作用的影响(,n=6)
注:VS模型组+乳酸,△P<0.05;VS模型组+乳酸+胰岛素,▲P<0.05
组别 糖异生量(umol◦mg-1)对照组8.3±0.05模型组10.2±0.13吡格列酮组 9.0±0.03△对照组+乳酸 12.0±0.15模型组+乳酸 14.5±0.11吡格列酮组+乳酸 12.2±0.08△对照组+乳酸+胰岛素 9.6±0.02模型组+乳酸+胰岛素 13.5±0.04吡格列酮组+乳酸+胰岛素 10.8±0.03▲
3 讨论
胰岛素抵抗是糖尿病、肥胖、冠心病、高血压及脂代谢异常等多种疾病发病的中心环节,IR的发病机理不明,研究其发生机制成为当今的重要课题。胰岛素抵抗可以发生在胰岛素信号传导和环境因素等各个环节,我们采用地塞米松诱导3T3-L1脂肪细胞构建的胰岛素抵抗模型,对胰岛素抵抗前提下细胞水平糖代谢过程中葡萄糖消耗糖异生做了进一步的研究,研究表明:吡格列酮可显著改善胰岛素抵抗状态下3T3-L1脂肪细胞的糖代谢作用,并且对糖代谢过程中糖异生有明显的抑制作用,并且该抑制作用在胰岛素存在的情况下表现的更明显,其详细的分子机制有待进一步的研究。
1 Hideyuki S,Takehide O,M otonobu A,et al.Dexamethasone-Induced insulin resistance in 3T3-L1 adipocy tes is due to inhibition of glucose transport rather than insulin signal transduction[J].Diabetes,2000,49(10):1700-1708.
2 Koh EH,Kim MS,Park JY,et al.Peroxisome proliferator activated receptor(PPAR)apha activation prevents diabetes in O LETF rats comparison with PPAR gamma activation[J].Diabetes,2003,52(9):2331-2337.
3 Guan Y.PPA R family and its relationship to renla complications of the metbaolic syndrome.[J].J Am Soc Nephro1,2004,15(11):2801-2815.
4 SoaresA F,Guichardant M,Cozzone D,et al.Effects of oxidative stress on adiponectin secretion and lactate production in 3T3-L1 adipocytes[J].Free Radic Biol Med,2005,38(7):882-889.
5 Nelson B A,Robinson K A,Buse M G.High glucose and g luosamine induce insulin resistance via different mechanisms in 3T3-L1 adipocytes[J].Diabetes,2000,49(6):981-991.
6 AnilKumarK L,Marita A R.T roglitazone prevents and reverses dexamethasone induced insulin resistance on glycogen synthesis in 3T 3 adipocyte[J].Br J Pharmacol,2000,130(2):351-358.
7 Xu A,Wong LC,Wang Y,et al.Chronic treatment with growth ho rmone stimulates adiponectin gene ex pression in 3T3-L1adipocy tes[J].FEBS Lett,2004,572(2-3):129-134.
8 Palmer RM,Bain PA,Southern BG.Dexamethasone-induced catabolism and insulin resistance in L6 my oblast are reversed by the removel of serum[J].Lomp Biochem physiol C,1990,97(2):369-372.
9 陈秋,夏永鹏,邱宗荫.吡格列酮对胰岛素抵抗 HepG2细胞模型的药理学评价[J].中国药理学通报,2006,22(2):248-251.
10 杨桂枝,高小平,晏菊芳,等.GOD-POD法微量化测定的方法建立以及在3T 3-L1脂肪细胞和 HepG2细胞糖摄取中的应用[J].四川解剖学杂志,2003,11(1):12-16.

