隐球菌性脑炎患者颗粒酶B、颗粒溶素、穿孔素的表达及临床意义
周 晔,邓安梅,谷明莉,陈 燕,陈 波,陈孙孝,仲人前*
(1.上海长征医院 实验诊断科;2.上海长征医院 皮肤科,上海200003)
新生隐球菌是一种具荚膜的酵母样真菌,最常侵犯中枢神经系统,引起隐球菌性脑膜炎。隐球菌性脑膜炎临床主要表现为亚急性或慢性脑膜炎、脑膜脑炎,少数可表现为颅内占位性病变[1-3]。近年来,由于大剂量糖皮质激素及抗肿瘤化疗药物的使用、肿瘤、AIDS、移植后抗排斥药物的使用等因素,隐球菌病的发病率呈明显上升的趋势[4-6]。据统计,美国约有5%-10%的AIDS患者发生隐球菌性脑膜炎,而我国以散发非AIDS人群为主,但也有AIDS并发隐球菌性脑膜炎的报告。
然而,临床治疗具有较大难度,通常采用的抗真菌药物具有较大毒性[7],因此迫切需要对隐球菌性脑膜炎的发病机制进行深入研究,以寻求更为有效的治疗途径。由于隐球菌性脑膜炎多发于免疫功能低下的个体,因此免疫失调可能是其发病机制中的重要因素之一[8],对隐球菌性脑膜炎患者中调节免疫功能的分子的研究,将为病情监控和有效治疗提供新的线索。
颗粒酶 B(granzyme B,GrB)、颗粒溶素(granulysin,GNLY)及穿孔素(perforin,又称pore-forming protein,PFP)是存在于细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)和自然杀伤细胞(natural killer,NK)细胞颗粒中的细胞免疫效应分子[9]。在CTL发挥胞吐颗粒作用时,PFP在靶细胞膜表面先构筑小孔,使GNLY、GrB易于进入细胞,通过激活caspase-3途径使DNA裂解,导致细胞凋亡[10]。本研究应用免疫印迹的方法检测隐球菌性脑膜炎患者PBMC中的GrB、GNLY及PFP的蛋白表达,用实时荧光定量PCR方法检测其中GrB、GNLY及PFP的mRNA基因表达,并且分析隐球菌性脑膜炎患者蛋白表达量与一些免疫指标的相关性,探讨免疫效应分子与隐球菌性脑膜炎发生发展的关系,以期为临床提供一些辅助诊断的依据。
1 材料和方法
1.1 研究对象 1999-2007年间在上海长征医院确诊的隐球菌性脑膜炎患者25例,男11例,女14例,平均年龄38(31-58)岁,所有病例均为脑脊液找到和(或)脑脊液培养出新型隐球菌。正常对照组30例,男12例,女18例,平均年龄 35(25-55)岁。所有标本均为HIV阴性。本研究得到患者同意和上海长征医院伦理委员会批准。
1.2 试剂和仪器 淋巴细胞分离液(Axis-Shield PoC AS,Oslo,Norway),DU640型紫外分光光度仪(Beckman,Fullerton,CA,USA),Trizol试剂,逆转录反应体系(Invitrogen,Carlsbad,CA,USA),TaqMan Universal PCR Master Mix,ABI prism 7500型荧光定量PCR仪(Prism 7500,Applied Biosystems,Foster City,CA,USA),DADE BEHRING BN2特定蛋白分析仪(BN2;Dade Behring,Deerfied,IL,USA),IL-4、IL-10、TNF-α、IFN-γ ELISA 试剂盒 (BIOSOURCE,Carlsbad,CA,USA)。GrB、PFP单克隆抗体(Abcamambridge,England,UK),GNLY单克隆抗体由美国斯坦弗大学惠赠,HRP标记的羊抗鼠抗体(KPL公司)。
1.3 引物和探针的设计合成 参照GENEbank中人18s rRNA、GrB、GNLY和PFP基因序列设计合成引物和探针,委托美国ABI生物公司合成。序列见表1。

表1 荧光定量RT-PCR的引物和探针序列
1.4 分离PBMC及抽提总RNA 无菌抽取静脉血3 ml注入枸橼酸钠抗凝管,加等量生理盐水稀释一倍后加于Ficoll淋巴细胞分离液上,以2 000转/分的速度水平离心20分钟后收集白细胞层细胞。用PBS洗涤两次后分装两管,一管用于western blot,另一管加入Trizol,提取细胞总RNA,操作按说明书进行,-70℃保存备用。
1.5 免疫印迹反应(Western blot)将分离到的患者和健康人的PBMC用超声破碎仪裂解细胞,离心后的上清液用考马斯亮蓝法检测蛋白浓度,保证每孔上样量的一致。经10%SDS-PAGE电泳后进行转印,200 mA,40V,2 h。将转印后的硝酸纤维素薄膜用含5%BSA的PBS封闭1 h,与1∶1 000稀释的GrB、GNLY和PFP、β-actin抗体反应2 h,充分洗涤后与1∶1 000稀释的HRP标记的羊抗鼠抗体反应2 h,ECL反应,X光片压片曝光,用凝胶成像分析系统测定其吸光度值。以β-actin为参照,计算各蛋白的吸光度值与对应的β-actin吸光度值,得到各蛋白相对水平。
1.6 反转录反应 取总RNA 2 μ g进行反转录反应 ,体系含 lxRT Buffer,0.5 mmol/L dNTPs,1 μ mol/L Oligo-dT引物,RNase抑制剂1O U,SuperseiptatTMⅡ反转录酶 4 U,反应条件为:25℃10 min;42℃50 min;85℃5 min;冰浴 5 min 后加入 1 μ l E.coli RNase H,37℃20 min。cDNA置-20℃保存。
1.7 定量PCR反应 20 μ l反应体系中含有模板cDNA 1 μ l,PCRMaster mix 10 μ l,Sense-primer 0.4 μ l,Anti-sense-primer 0.4 μ l,Probe 0.2 μ l,RNAase-free 水8 μ l,循环参数为:50℃2min;95℃10 min;95℃15 s,60℃1 min,40个循环;同时设RT质控和PCR扩增两个空白对照。根据目的基因与内参基因18s rRNA的Ct差值,求出两组标本TRAIL的相对表达量。
1.8 IgG、IgA、IgM采用 DADE BEHRING BN2全自动特定蛋白分析仪检测 血清IL-4、IL-10、TNF-α、IFN-γ浓度采用ELISA试剂盒检测,步骤参照相关试剂盒说明书。
1.9 数据处理及统计分析 靶基因的相对定量按公式得出:靶基因 =2-(△△Ct)。其中 ΔΔ Ct=Δ Ct,Q-Δ Ct,C。Δ Ct,Q为疾病组靶基因的Ct值与管家基因Ct值之差;Δ Ct,C为对照组靶基因的Ct值与管家基因Ct值之差。测定 Δ Ct值以±s表示,组间差异采用成组t检验,以SPSS软件进行统计分析。
2 结果
2.1 GrB、GNLY和PFP蛋白表达量
以β-actin为内参照,与健康对照组比较,隐球菌性脑膜炎患者PBMC中GNLY、PFP蛋白含量均明显降低,而GrB蛋白含量无明显变化,见图1。计算健康对照组和隐球菌性脑膜炎患者PBMC中各蛋白的吸光度值与对应的β-actin吸光度值,得到各蛋白的相对表达水平,经统计学分析GNLY和PFP表达显著降低(P<0.01),GrB的表达无显著性差异(P>0.05),见图 2。

图1 Western blot检测隐球菌性脑膜炎患者和健康人PBMC中 GNLY、GrB、PFP蛋白
2.2 GrB、GNLY和 PFP mRNA表达量
采用荧光定量PCR技术分析隐球菌性脑膜炎患者PBMC中GrB、GNLY和PFP mRNA表达量,以2-(△△Ct)代表基因表达的相对定量,结果显示,与健康对照组比较,隐球菌性脑膜炎患者PBMC中GNLY、PFP mRNA表达量显著降低(P<0.01),GrB mRNA表达量与正常对照组的表达水平无显著性差异,见图3。

图2 隐球菌性脑膜炎患者PBMC中 GNLY、GrB、PFP蛋白的相对表达(*P<0.01)
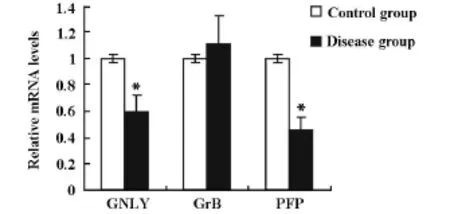
图3 隐球菌性脑膜炎患者PBMC中GNLY、GrB、PFP mRNA的相对表达(*P<0.01)
2.3 GNLY、PFP蛋白表达与隐球菌性脑膜炎患者血清IgG的相关性分析
本研究结果显示:与健康对照组比较,隐球菌性脑膜炎患者血清IgG显著下降(P<0.01),经SPSS软件进行统计分析,隐球菌性脑膜炎患者PBMC中GNLY蛋白表达与IgG成正相关(r=0.477,P<0.05)、PFP蛋白表达与IgG无相关性(r=0.199,P=0.341),见表2和图4。
表2 隐脑患者免疫指标分析 (±s,g/L)

表2 隐脑患者免疫指标分析 (±s,g/L)
隐脑患者组与健康人对照组比较,*P<0.01
组别 例数 IgG IgA IgM对照组 25 12.75±1.56 1.45±0.32 1.23±0.27患者组 30 7.62±1.24*1.56±0.57 1.31±0.71
2.4 GNLY、PFP蛋白表达与隐球菌病患者血清细胞因子水平的相关性分析
经ELISA分析显示:与健康对照组比较,隐球菌性脑膜炎患者血清中的IL-10显著升高(P<0.01)、IFN-γ显著下降(P <0.01),IL-4、TNF-α的变化无统计学意义(P>0.05)。经SPSS软件进行统计分析,结果显示,隐球菌性脑膜炎患者PBMC中GNLY蛋白表达与血清中IL-10水平成负相关(r=-0.505,P<0.05),而与血清IFN-γ水平成正相关(r=0.534,P<0.05);隐球菌性脑膜炎患者PBMC中PFP蛋白表达与IL-10、IFN-γ水平均无相关性,见表3和图5。
表3 隐脑患者细胞因子浓度水平分析 (±s,pg/ml)
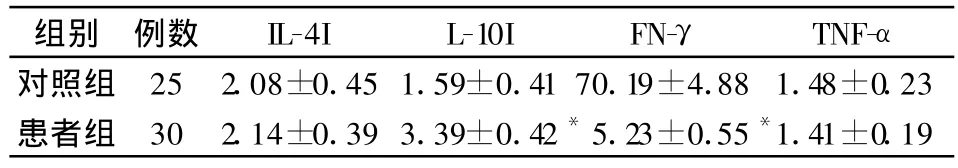
表3 隐脑患者细胞因子浓度水平分析 (±s,pg/ml)
隐脑患者组与健康人对照组比较,*P<0.01
组别 例数 IL-4I L-10I FN-γ TNF-α对照组 25 2.08±0.45 1.59±0.41 70.19±4.88 1.48±0.23患者组 30 2.14±0.39 3.39±0.42*5.23±0.55*1.41±0.19
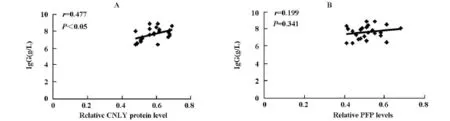
图4 (A)隐球菌性脑膜炎患者GNLY蛋白表达与血清IgG的相关性,(B)隐球菌性脑膜炎患者PFP蛋白表达与血清IgG的相关性
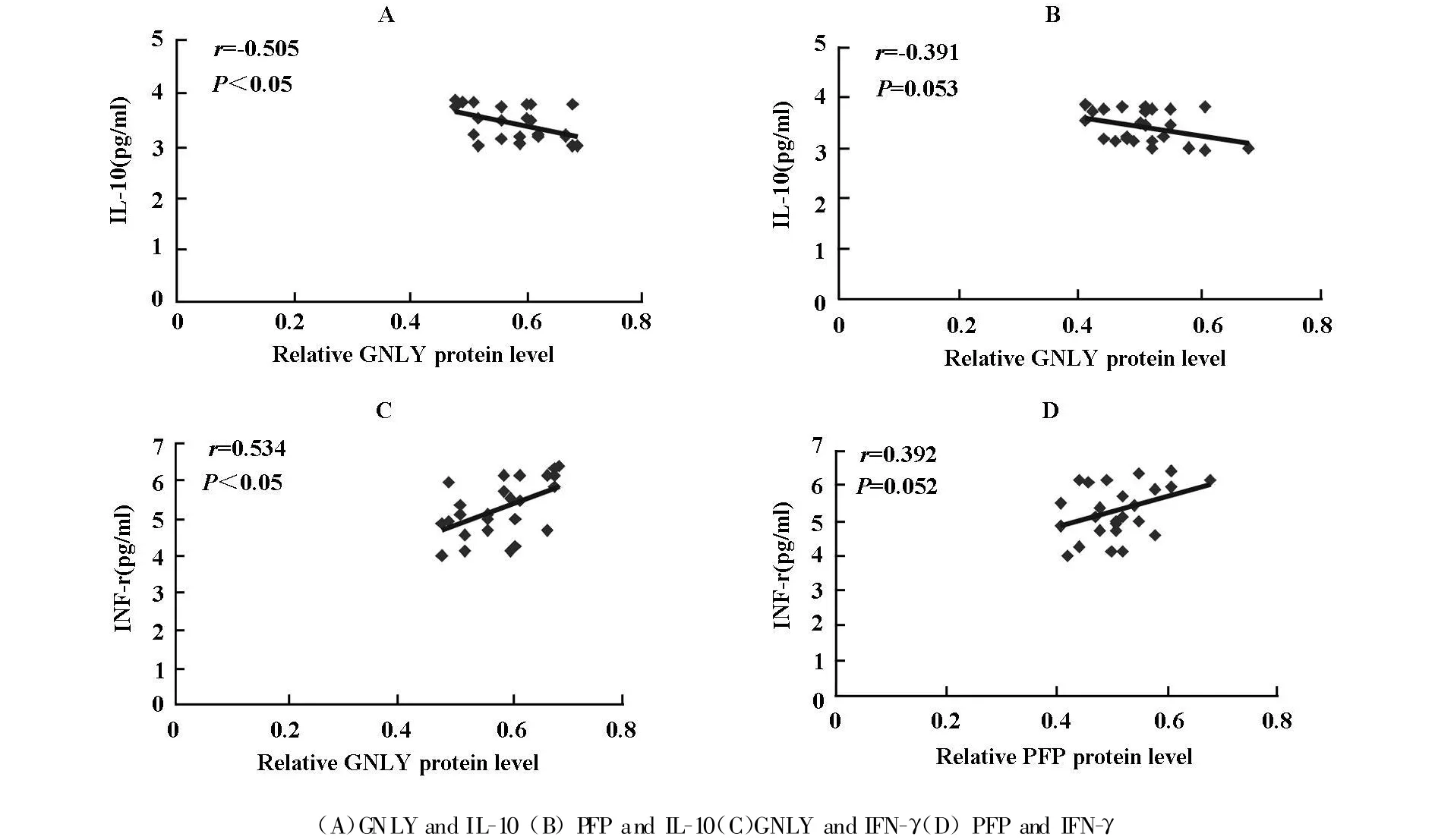
图5 隐球菌性脑膜炎GNLY、PFP蛋白表达与血清细胞因子水平的相关性
3 讨论
新生隐球菌是一种条件致病菌,隐球菌病常见于免疫缺陷患者和机体免疫力低下者[11]。隐球菌性脑膜炎临床表现多样:发热、头痛、恶心、恶吐、脑膜刺激征常见,同时可出现意识障碍、脑神经受损等症状[12]。其病情重、治疗困难,病死率高。研究隐球菌性脑膜炎患者中的免疫调节机制将有利于病情监控和治疗。
颗粒酶B(GrB)属于丝氨酸蛋白家族成员,存在于活化的CTL和NK胞浆中,是CTL和NK发挥细胞毒作用的主要效应分子。活化的CTL识别靶细胞后,以颗粒外排的方式将颗粒酶分泌到细胞间隙以杀伤细胞。颗粒溶素是细胞毒颗粒蛋白,正常状态下GNLY呈低水平表达,免疫激活后3-5天GNLY的表达量开始上升,成为晚期表达的免疫效应分子。穿孔素是一种结构和功能类似补体C9的蛋白[13],存在于CTL与NK的胞浆颗粒中,在保护机体抗胞内病原体如细菌、病毒、寄生虫感染、抗肿瘤和同种排斥应答中起重要作用,是免疫系统重要的效应分子。静止的CD8+细胞前体细胞内PFP的表达水平非常低,然而一旦激活,其PFP的表达水平显著升高。因此,上述三种分子被看作是机体细胞免疫状态的生物标志之一。本研究检测的25名隐球菌性脑膜炎患者PBMC中GNLY、PFP蛋白含量和mRNA均明显降低,提示隐球菌性脑膜炎患者中细胞免疫力下降,这可能是导致发病的重要原因。而GrB蛋白含量无明显变化,这可能是由于它们的表达调控机制不同所造成的。隐球菌性脑膜炎患者中血清IgG水平显著降低,是病情指标之一。本研究中,GNLY、PFP的表达水平与血清IgG水平成正相关,提示检测GNLY、PFP有助于对病情的监测和临床治疗药物的选择。
Th1型免疫应答能够分泌Th1型细胞因子(如IFN-γ),在强化细胞介导的免疫应答及对宿主抵抗细胞内病原菌过程中发挥重要作用,而Th2型免疫应答分泌Th2细胞因子(如IL-10)却可能抑制Th1型细胞因子介导的免疫应答,加重感染病情[14]。本研究中,隐球菌性脑膜炎患者IFN-γ水平显著下降,IL-10水平显著升高,呈现Th2漂移,因此IFN-γ可与其他抗真菌药物联合应用于新生隐球菌感染的免疫治疗。有研究表明[15],GNLY还具有免疫调节作用,可刺激IFN-γ等细胞因子的分泌。本研究中,隐球菌性脑膜炎患者中GNLY蛋白的低水平表达与血清IgG和IFN-γ水平成正相关,与IL-10水平成负相关(P<0.05),提示显著降低的GNLY表达可能导致Th1/Th2失衡,机体抗真菌免疫反应降低而诱发隐球菌病的发生。这为探索有效隐球菌病的途径提供了依据。
[1]Pukkila-Worley R,Mylonakis E.Epidemiology and management of cryptococcal meningitis:developments and challenges[J].Expert Opin Pharmacother,2008,9(4):551.
[2]Chang WN,Lu CH,Huang CR,et al.Cerebrospinal fluid 14-3-3-gamma protein level in eight HIV-negative cryptococcal meningitis adults[J].Eur J Neurol,2008,15(4):428.
[3]Whyte C,Eshkar N.Images from headache:external hydrocephalus due to cryptococcal meningitis[J].Headache,2007,47(10):1447.
[4]Murdoch DM,Venter WD,FeldmanC,et al.Incidence and risk factors for the immune reconstitution inflammatory syndrome inHIV patients in South Africa:a prospective study[J].AIDS,2008,22(5):601.
[5]Singh N,Alexander BD,Lortholary O,et al.Pulmonary cryptococcosis in solid organ transplant recipients:clinical relevance of serum cryptococcal antigen[J].Clin Infect Dis,2008,46(2):2.
[6]Jarvis JN,Harrison TS.HIV-associated cryptococcal meningitis[J].AIDS,2007,21(16):2119.
[7]Lewis JS 2nd,Graybill JR.Fungicidal versus Fungistatic:what's in a word?[J].Expert Opin Pharmacother,2008,9(6):927.
[8]Tan DB,Yong YK,Tan HY,et al.Immunological profiles of immune restoration disease presenting as mycobacterial lymphadenitis and cryptococcal meningitis[J].HIV Med,2008,9(5):307.
[9]Stenger S,Hanson DA,Teitelbaum R,et al.An antimicrobial activity of cytolytic T cells mediated by Granulysin[J].Science,1998,282(5386):121.
[10]Froelich CJ,Dixit VM,Yang X.Lymphocyte granule-mediated apoptosis:matters of viral mimicry and deadly proteases[J].Immunol Today,1998,19(1):30.
[11]Kobayashi CC,Souza LK,Fernandes OF,et al.Characterization of Cryptococcus neoformans isolated from urban environmental sources in Goiâ nia,Goiás State,Brazil[J].Rev Inst Med Trop Sao Paulo,2005,47(4):203.
[12]Milefchik E,Leal MA,Haubrich R,et al.Fluconazole alone or combined with flucytosine forthe treatment of AIDS-associated cryptococcal meningitis[J].Med Mycol,2008,46(4):393.
[13]Liu CC,Walsh CM,Young JD.Perforin:structure and function[J].Immunol Today,1995,16(4):194.
[14]Segal BH,Steinbach WJ.Combination antifungals:an update[J].Expert Rev Anti Infect Ther,2007,5(5):883.
[15]Anmei Deng,Sunxiao Chen,Qing Li,et al.Granulysin,a cytolytic molecle,is also a chemoattractant and Proinflammatory Activator[J].Journal of Imunology,2005,174(9):5243.

