LaCrO3基耐硫钙钛矿型的阳极催化剂性能
谭文轶 ,缪明生,钟秦
(1. 南京理工大学 化工学院,南京,210094;2. 南京工程学院 环境工程系,南京,211167)
1987年,Pujare等[1]研究以H2S和O2作为反应气体的固体氧化物燃料电池。采用该技术在脱除H2S的同时,可获得绿色能源——电能。利用H2S固体氧化物制作燃料电池是一种废物资源化的理想途径。由于H2S燃料气具有腐蚀性,阳极催化剂的选择是H2S燃料电池研究的核心。Pujare等[2]提出复合金属硫化物如CuFe2S4适合作为H2S燃料电池阳极催化材料,随后,许多研究者开发了多种单金属硫化物阳极材料,如FeS,NiS,MoS2,CoS,CuS,WS2和 PbS 等。Yates等[3-4]在此类阳极材料中掺入少量的银粉,或采用双元硫化物M-Mo(M为Co,Ni,Fe)以增加阳极的导电性能,避免电极的极化损失。Tan等[5]则研究以MoS2为阳极的钙钛矿型质子导体燃料电池的匹配。发现尽管阳极金属硫化物表现出良好的电催化性,但非钙钛矿型阳极与钙钛矿型固体电解质之间的匹配性成为影响H2S燃料电池的重要因素。为保证阳极与固体电解质之间的匹配性,Chen等[6-7]提出采用钙钛矿结构系列作为燃料电池关键材料,探讨钙钛矿阳极材料在CH4和醇类燃料电池中的适用性和催化活性,并研究与钙钛矿固体电解质匹配性。对于在“毒化”作用更强的H2S气氛中,采用钙钛矿结构的阳极与同为钙钛矿固体电解质组装成固体氧化物燃料电池的报道较少[8-9]。Cr具有稳定配位结构,Simner等[10]认为这种稳定的配位结构有利于增加阳极的稳定性。Zha等[11]对 La0.75Sr0.25Cr1-xMnxO3的导电性能进行研究,发现La0.75Sr0.25Cr1-xMnxO3在空气中的电导率要比在 H2和含φ(H2S)=10%的气体中的电导率高1个数量级,而且电导率随着 Mn含量的增加而增加。在 900 ℃时,La0.75Sr0.25Cr1-xMnxO3在φ(H2S)=10%的潮湿H2中的电导率为1.6 S/cm,但是,Mn离子掺杂削弱了材料的耐硫特性。本文作者采用在B位掺杂Fe的LaCrO3型阳极,La0.75Sr0.25Cr0.5Fe0.5O3-δ(记作 LSCrF)作为固体氧化物燃料电池阳极催化剂,通过测定它的耐硫稳定性以及过电位,探讨此类阳极催化剂在H2S燃料电池中使用的可能性。将制备的阳极催化剂与钙钛矿质子导体BaxCe1-xZryY1-yO3-δ(记作 BCZY)组成燃料电池,并对其电输出性能进行测试。
1 实验
1.1 阳极催化剂的制备
实验采用尿素-硝酸盐燃烧法[12]制备La0.75Sr0.25Cr0.5Fe0.5O3-δ阳极催化剂前驱体粉末。以含相应金属离子的硝酸盐为原料,按化学计量比取样,溶解于蒸馏水中配置成混合溶液。按物质的量比n(尿素)∶n(金属盐)=1.0∶1.2,将尿素溶液加入以上混合硝酸盐溶液中,用电炉加热直至其燃烧。燃烧后得到疏松的泡沫状粉末,将粉末研磨,然后,在900 ℃煅烧4 h,即得LaCrO3基钙钛矿型阳极催化剂。
1.2 稳定性表征
在H2S气氛中测试催化剂的稳定性,即催化剂的耐硫性能。在 850 ℃时,将催化剂粉末暴露在含φ(H2S)=20%的N2中12 h。此后,保持原温用N2吹扫催化剂表面1 h,以吹走催化剂表面残留的H2S气体和高温下升华的硫。将处理后的样品研磨成粉末,采用BOMEM MB1545S FT-IR(加拿大)红外分析仪对粉末进行测定。通过对比测试前后催化剂的红外吸收光谱图和XRD图来评价催化剂的耐硫性能。
1.3 极化实验与燃料电池测试
阳极催化剂的极化实验采用恒定电位仪(天津中环电子制造)。图1所示为电极极化测试示意图,其中:电极厚度约为1 mm,辅助电极和参比电极均采用Pt片,分别采用导线连接工作电极、辅助电极和参比电极,将导线的另一端连接至恒定电位仪。在 600~800 ℃,φ(H2S)=20%的N2气氛中进行极化测试。

图1 电极极化测试示意图Fig.1 Schematic diagram of electrode polarization testing
以 LSCrF为阳极催化剂,BCZY为电解质,Ag为阴极催化剂构建H2S燃料电池。
2 结果与分析
2.1 耐硫稳定性
图2所示为LSCrF催化剂耐硫性能测试前后的傅立叶红外谱(FT-IR)和XRD(X-ray diffraction)谱。由图2(a)可看出:LSCrF催化剂测试前后的IR谱基本相同,没有形成新的键,耐硫性能较佳。LSCrF催化剂耐硫性能测试前后的 XRD谱进一步验证了这一结果,如图2(b)所示。测试前后的XRD峰型基本相同,测试后的粉末没有新峰产生,峰强度较强,晶型保持不变。
2.2 阳极极化测定及其交换电流密度i0的计算
图3所示是燃料气流速为80 mL/min,LSCrF阳极催化剂在600~800 ℃时的η-i曲线,即极化曲线。由图3可知:在同样的电流密度i下,在600~800 ℃时,随着温度的增高,由于电极反应速度加快,导致阳极极化过电位下降,从而使燃料电池的电压升高;在低过电位(取小于150 mV)下,对阳极极化曲线进行线性拟合。根据Butler-Volmer公式[13]:
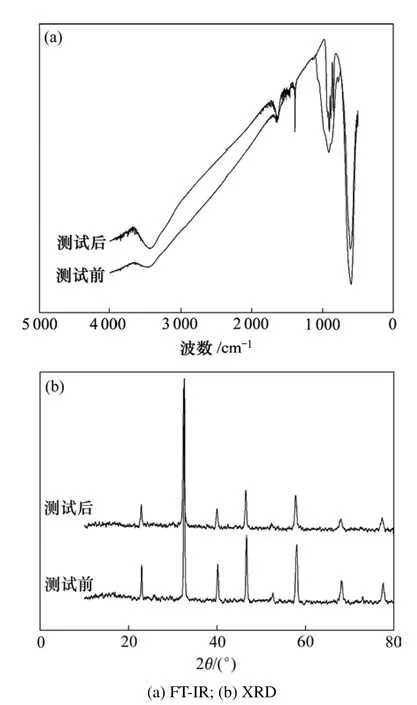
图2 LSCrF耐硫测试表征谱图Fig.2 Patterns of LSCrF sulfur tolerance testing
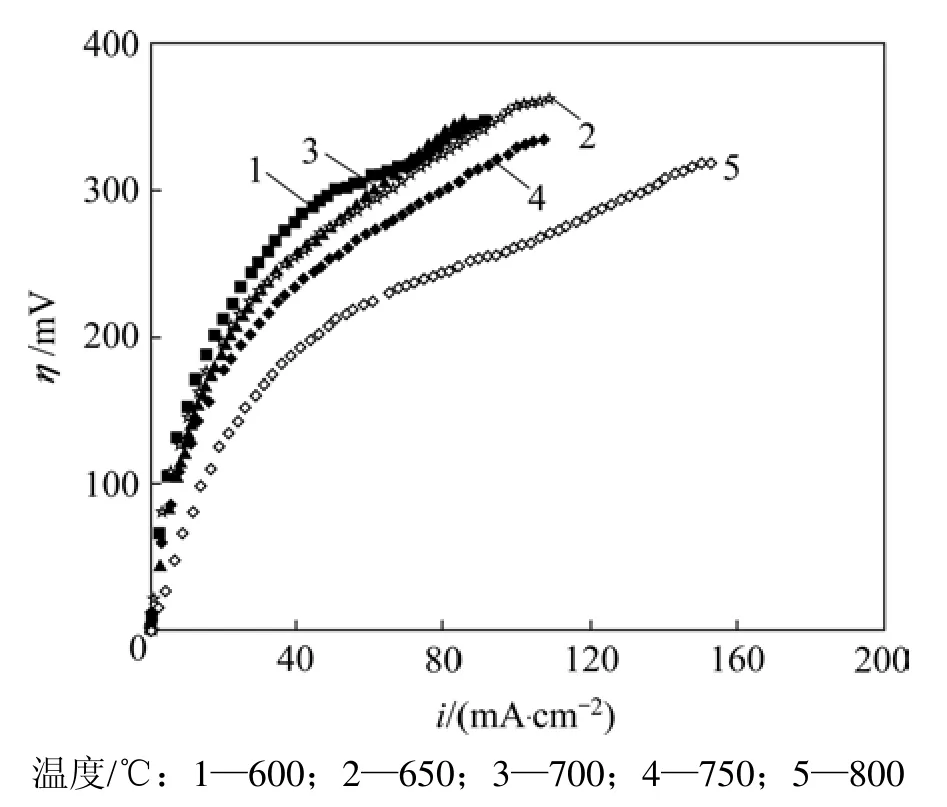
图3 LSCrF阳极的极化曲线图Fig.3 Curves of polarization of LSCrF anode

其中:F为法拉第常数,C/mol;R为普适气体常数,J/(mol·K);T为热力学温度,K;β为对称系数,β=0.5;i0为交换电流密度,mA/cm2;i为电流密度,mA/cm2;η为过电位,mV;z为电子数。
在高过电位下,式(1)可以简化为:
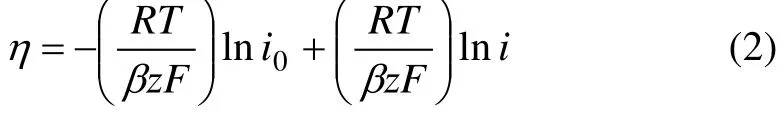
此即为 Tafel公式[13]。在低过电位时,利用泰勒展开式,式(1)进一步简化为:

根据式(3),计算得到LSCrF阳极催化剂在不同温度下的交换电流密度i0,如表1所示。作为对比,表1中还列举了n(Co)∶n(Mo)=2∶3的阳极催化剂的交换电流密度。交换电流密度i0反映了电极材料对反应的催化活性,i0越大,表示电极材料对反应的催化活性越强,反之,i0越小,电极材料对反应的催化活性越弱。由表 1可知:在 600~800 ℃时,随着温度的升高,LSCrF和 n(Co)∶n(Mo)=2∶3的催化剂的交换电流密度愈来愈大,说明2种催化剂的电催化活性均随温度的升高而逐渐增强;在相同温度下,LSCrF催化剂的交换电流密度要比 n(Co)∶n(Mo)=2∶3的催化剂的交换电流密度大,表明LSCrF催化剂的催化活性更强。
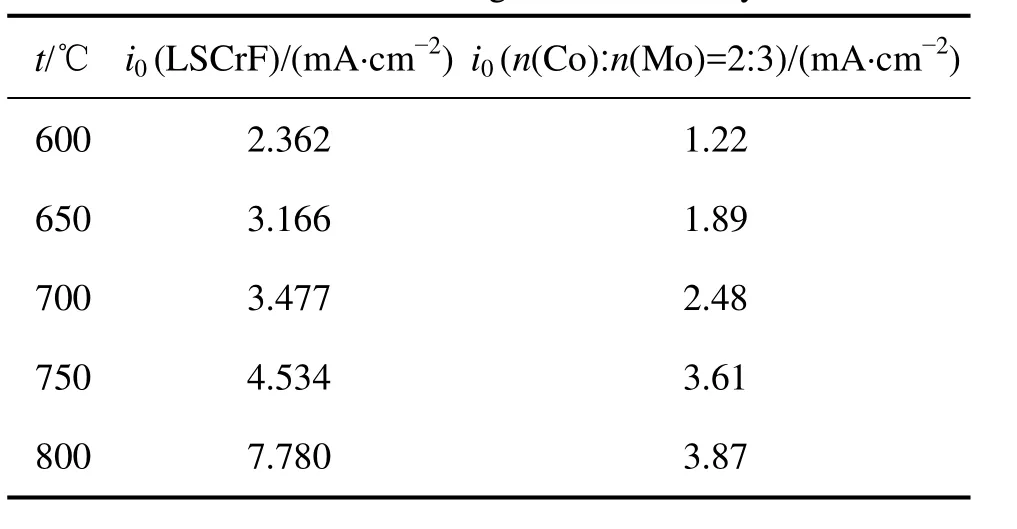
表1 交换电流密度i0Table 1 Exchange current density
2.3 燃料电池电性能测试
图4所示为以LSCrF阳极进行燃料电池电性能测试结果。从图4可见:在同一温度下,随着电流密度的升高,极化过电位也升高,燃料电池的输出电压下降[14-15]。同时,较高的温度对提高燃料电池输出电压有利,这与较高温度下过电位较低有直接关系[16]。在800 ℃时开路电压最大,为0.76 V,但随着电流密度增大,输出电压逐渐降低。根据燃料电池基本原理[17]:

图4 不同温度下燃料电池的电压(U)和电流密度(i)的关系图Fig.4 Curves of U-i of H2S fuel cell at various temperatures

其中:U0为开路电压,V;U为输出电压,V;I为输出电流,A;R为体电阻,Ω。
根据式(3)和(4),当电流密度从0 mA/cm2增至20 mA/cm2时,电极极化显著增强,在800 ℃时过电位η理论上应线性增大至110 mV,U随之线性减小;当电流密度为100 mA/cm2时,LSCrF阳极的电极极化过电位为304 mV,但是,实际燃料电池电压输出值几乎测不出。其主要原因是电解质材料、电极材料及其接触电阻均会使体电阻电压(IR)损失[18-19]。体电阻可由式(4)估算获得,图5所示为800 ℃时体电阻电压损失与电流密度i的关系。图5中IR随着电流密度的增加而呈线性增大,其斜率即为单位电极表面积的体电阻。经初步估计,在800 ℃时,H2S燃料电池过电位η对燃料电池的电压损失贡献仅占15%左右,而IR贡献则达到近40%。
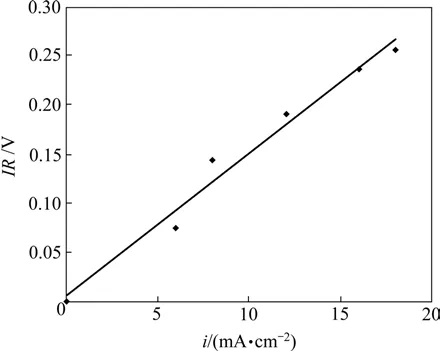
图5 800 ℃时不同电流密度下H2S燃料电池的体电阻电压损失Fig.5 Total resistance contribution to potential loss in H2S fuel cell at 800 ℃
3 结论
(1) LSCrF阳极催化剂在φ(H2S)=20%的气氛下是稳定的,未出现明显的晶型转变。
(2) 在 600~800 ℃时,随着温度的升高,LSCrF交换电流密度升高,表明催化剂的催化活性随着温度的升高而增强;在同一温度下,LSCrF催化剂的交换电流密度几乎为n(Co)∶n(Mo)=2∶3的催化剂的2倍,即LSCrF催化剂的催化活性强于后者。
(3) LSCrF阳极催化剂在H2S燃料电池中输出电压随着温度的升高而得到改善,其原因是较高温度有利于过电位的降低。在800 ℃时,H2S燃料电池过电位η对燃料电池的电压损失贡献仅占15%左右,而体电阻电压损失贡献则达到近40%。
[1] Pujare N U, Semkow K W, Sammells A F. A direct H2S/air solid oxide fuel cell[J]. Journal of the Electrochemical Society, 1987,134(10): 2639-2640.
[2] Pujare N V, Tsai K J, Sammells A F. An electrochemical claus process for sulfur recovery[J]. Journal of the Electrochemical Society, 1989, 136(12): 3662-3678.
[3] Yates C, Winnick J. Anode material for hydrogen sulfide solid oxide fuel cell[J]. Journal of the Electrochemical Society, 1999,146(8): 2841-2844.
[4] Grgicak C M, Pakulska M M, O’Brien J S, et al. Synergistic effects of Ni1-xCox-YSZ and Ni1-xCux-YSZ alloyed cermet SOFC anodes for oxidation of hydrogen and methane fuels containing H2S[J]. Journal of Power Sources, 2008, 183(1): 26-33.
[5] Tan W Y, Zhong Q, Miao M S, et al. H2S solid oxide fuel cell based on a modified barium cerate perovskite proten conductor[J]. Ionics, 2009, 15(3): 385-388.
[6] Chen X H, Ma W H, Yang B. Performance of La1-xSrxCr1-yMnyO3-δanode materials for intermediate temperature solid oxide fuel cell[J]. Transactions of Nonferrous Metals Society of China, 2007, 17(S2): 998-1001.
[7] Sauvet A L, Irvine J T S. Catalytic activity for steam methane reforming and physical characterisation of La1-xSrxCr1-yNiyO3-δ[J]. Solid State Ionics, 2004, 167(1/2): 1-8.
[8] Peter D, Alexander S M. Perovskite catalysts for the auto-reforming of sulfur containing fuels[J]. Journal of Power Sources, 2007, 167(2): 472-481.
[9] Jin X L, Jing L L, Chuang K T, et al. Chemical stability of Y-doped Ba(Ce, Zr)O2perovskites in H2S-containing H2[J].Electrochimica Acta, 2008, 53(10): 3701-3707.
[10] Simner S P, Hardy J S, Stevenson J W, et al. Sintering of lanthanum chromite using strontium vanadate[J]. Solid State Ionics, 2000, 128(1/4): 53-63.
[11] Zha S W, Sang P T, Cheng Z, et al. Electrical properties and sulfur tolerance of La0.75Sr0.25Cr1-xMnxO3under anodic conditions[J]. Journal of Solid State Chemistry, 2005, 178(6):1844-1850.
[12] Ringuede´ A, Labrincha J A, Frade J R. A combustion synthesis method to obtain alternative cermet materials for SOFC anodes[J]. Solid State Ionics, 2001, 141/142(1): 549-557.
[13] 杨辉, 卢文庆. 应用电化学[M]. 北京: 科学出版社, 2001:55-70.YANG Hui, LU Wen-qing. Applied electrochemstry[M]. Beijing:Science Press, 2001: 55-70.
[14] Wen C, Kato R, Fukunaga H, et al. The overpotential of nickel/yttria-stabilized zirconia cermet anodes used in solid oxide fuel cells[J]. Journal of the Electrochemical Society, 2008,147(6): 2076-2080.
[15] Chan S H, Khor K A, Xia Z T. A complete polarization model of a solid oxide fuel cell and its sensitivity to the change of cell component thickness[J]. Journal of Power Sources, 2001, 93(1/2):130-140.
[16] Min C, Bok H K, Qing X, et al. Preparation and electrochemical properties of Ni-SDC thin films for IT-SOFC anode[J]. Journal of Membrane Science, 2009, 334(1/2): 138-147.
[17] Department of Energy of USA. Fuel cell handbook[M]. 5th ed.Morgantown, West Virginia: EG & G Services, 2000: 2-5-2-7
[18] Mori M, Hiei Y. Thermal expansion behavior of titanium-doped La(Sr)CrO3solid oxide fuel cell interconnects[J]. Journal of the American Ceramic Society, 2001, 84(11): 2573-2579.
[19] Rida K, Benabbas A, Bouremmad F, et al. Effect of strontium and cerium doping on the structural characteristics and catalytic activity for C3H6combustion of perovskite LaCrO3prepared by sol-gel[J]. Applied Catalysis B: Environmental, 2008, 84(3/4):457-467.

