马垂体促性腺激素的提取及其生物活性测定*
王志琴,陈静波,董 红,张国庭,孙金权
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆畜牧科学院畜牧科学研究所,新疆乌鲁木齐 830000)
马垂体促性腺激素的提取及其生物活性测定*
王志琴1,陈静波2*,董 红2,张国庭2,孙金权1
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆畜牧科学院畜牧科学研究所,新疆乌鲁木齐 830000)
家畜胚胎移植技术在畜牧业生产中应用日益广泛,由于马促性腺激素在国内外无商品出售,使马的胚胎移植超数排卵研究和应用受到限制。本试验用马脑垂体提取促性腺激素,将从屠宰场采集的新鲜马脑垂体冷冻保存,经固定、去膜、浸泡、捣碎、匀浆、振摇提取、离心、沉淀、洗涤、脱水、干燥等步骤,得到促性腺激素提取物干粉,用小鼠做生物活性测定。结果表明,建立的马脑垂体促性腺激素提取方法可行,提取物具有生物活性。
垂体;提取物;促性腺激素;马
家畜胚胎移植技术在畜牧业生产中应用日益广泛,马的胚胎移植可挖掘优秀母马品种和个体的繁殖潜力。试验证明,母马卵巢对其他种属来源的促性腺激素不敏感,仅对马属动物来源的促性腺激素有反应。由于马促性腺激素在国内外无商品出售,使马的胚胎移植超数排卵研究和应用受到限制。提取马垂体促性腺激素成为生产和科研中的紧迫任务。
马的垂体位于脑的基底部,蝶骨体的脑垂体窝内[1]。脑垂体分为腺垂体(前叶)和神经垂体(后叶)两部分,腺垂体分泌7种激素,其中维持性腺机能的两种激素是促卵泡素(follicle-stimulationg hormone,FSH)和促黄体素(luteinizing hormone,LH),两者合称为垂体促性腺激素(gonadotrophic hormone,GTH)。它们可促进睾丸的精子形成、卵泡成熟及参与黄体的形成,是垂体前叶产生的糖蛋白激素[2]。FSH能促进卵泡的早期发育,卵泡成熟是FSH和LH协同作用的结果。FSH促进颗粒细胞的增殖,多个卵泡生长。FSH与少量LH协同作用促进卵泡合成和分泌雌激素。FSH促进卵泡生长和成熟,使颗粒细胞上的LH受体增加,标志着卵泡已成熟。成熟卵泡在FSH和LH的作用下发生排卵[3]。
目前从猪脑垂体提取的FSH和LH已在牛、羊繁殖中广泛应用,主要用于提早家畜的性成熟,诱导母畜发情,超数排卵处理,治疗母畜繁殖疾病和提高公畜的精液品质[1]。然而,马脑垂体激素提取与应用在国内未见报道,而且马对猪源FSH不敏感。马胚胎移植的超数排卵技术的推广应用,需要用促性腺激素处理供体马。为了开展马胚胎移植科研工作,本试验采集马脑垂体,用生物化学方法提取促性腺激素,并用小鼠测定其生物活性。
1 材料与方法
1.1 材料
1.1.1 马垂体采集 在冬季12月份~1月份,马屠宰后,立即采集垂体,置-20℃冷冻保存,共采集3 526匹马的垂体。
1.1.2 实验动物 18日龄同批、同源雌性(昆明系)小鼠,体重9 g~13 g,购自新疆医科大学实验动物中心。
1.1.3 试剂与仪器设备 100 g/L乙酸铵、乙酸、950 mL/L乙醇、乙醚和丙酮,均为国产分析纯试剂;人绒毛膜促性腺激素,宁波激素厂生产。J-25 AVANPI低温离心机(BECKMAN COULTEB),PL203电子分析天平(梅特勒-托利多仪器公司),DS-1组织捣碎机(上海标本模型厂),FE20 pH计(梅特勒-托利多仪器公司),SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司),LDZX-50KB立式压力蒸汽灭菌器(上海申安医疗器械厂)。
1.2 方法
1.2.1 垂体预处理 ①固定:将冷冻保存的垂体解冻后,在室温条件下,连脑膜一起放入适量的无水丙酮中,以固定组织、脱水和脱脂;②剥离脑膜:手工剥离垂体外周脑膜,剥离后的垂体浸入适量新鲜无水丙酮中,共更换3次丙酮,垂体经3次丙酮浸泡后,脱水和脱脂基本完成,从丙酮浸泡液中滤出垂体放入真空干燥器中干燥[4],称重;③分离:干燥后的垂体,分离垂体前叶和后叶,保留垂体前叶备用。
1.2.2 马促性腺激素的提取方法和步骤 用乙醇法提取马垂体促性腺激素。具体步骤如下:①浸泡:取垂体前叶颗粒用提取液充分溶胀;②捣碎匀浆:用组织捣碎机充分捣碎匀浆,转入锥形瓶中;③振摇:于锥形瓶脑垂体匀浆中加入提取液,在恒温振荡器振摇;④离心:4℃条件下离心40 min收集上清液,沉淀加提取液,再次捣碎组织匀浆,振摇,离心得上清液,合并两次的上清液;⑤沉淀:将上清液在搅拌下慢慢加入950 mL/L乙醇至乙醇浓度为76 mL/L~80 mL/L;放入4℃冰箱,24 h后取出,收集白色沉淀物;⑥洗涤脱水:沉淀物用离心法分别加入无水乙醇、乙醚洗涤脱水;⑦干燥:沉淀物连同离心管一起,放入真空干燥器中干燥,得到白色垂体粗提物干粉。⑧分装:无菌分装于灭菌小瓶中,冷冻保存,使用时用生理盐水溶解即可。
1.2.3 马垂体促性腺激素提取物生物活性测定①试验分组。取同一来源的18日龄的雌性昆明小鼠,体重9 g~13 g,随机分成 4组,每组6只。第1组为hCG组,取hCG 25 U加1 mL生理盐水溶解;第2组为垂体提取物组,取1 mg垂体提取物溶于1 mL生理盐水中(1 mg/mL);第3组为提取物和hCG组,取垂体提取物1 mg,加1 mL含25 mg hCG的生理盐水溶解;第4组为溶剂对照组;②注射方法。每日上午10:00时,分别自小鼠颈部皮下注射各组的试验药品溶液0.2 mL,每天1次,连续注射3 d。③测定。最后1次注射后24 h,将小鼠颈椎脱臼处死,解剖。取出子宫和卵巢,剥离脂肪和周围组织,在滤纸上吸干后,称取湿重,并计算子宫和卵巢的平均重量。
2 结果
2.1 马垂体促性腺激素提取结果
从马脑垂体中提取获得促性腺激素粗品见表1。将3 526个马脑垂体分4批进行提取,真空干燥后,共得到脑垂体提取物19.039 g,按0.1 g/瓶和0.2 g/瓶分装于灭菌小瓶中,储存于-20℃冰箱。

表1 马脑垂体促性腺激素提取结果Table 1 The results of equine pituitary GTH extraction
2.2 提取物生物活性测定结果
各组小鼠子宫平均湿重为hCG组0.080 3 g,提取物组0.099 19 g;提取物+hCG组 0.073 9 g,对照组0.043 5 g。溶剂试验组子宫平均重量比空白组高近1倍。
各组小鼠卵巢平均湿重见表 2。hCG组0.022 g;提取物组 0.026 5 g;提取物 +hCG组0.023 3 g;对照组0.017 1 g。试验组小鼠卵巢平均重量明显比对照组高。
各组小鼠卵巢解剖学变化情况,hCG组和溶剂对照组小鼠的卵巢均呈现白色,没有明显变化;单纯提取物组小鼠卵巢均发红色(有卵泡发育);提取物+hCG组小鼠的卵巢颜色都出现红色的变化,同时有2只鼠的卵巢上有红色排卵点。卵巢重与子宫重与溶剂对照组比较略有增加。
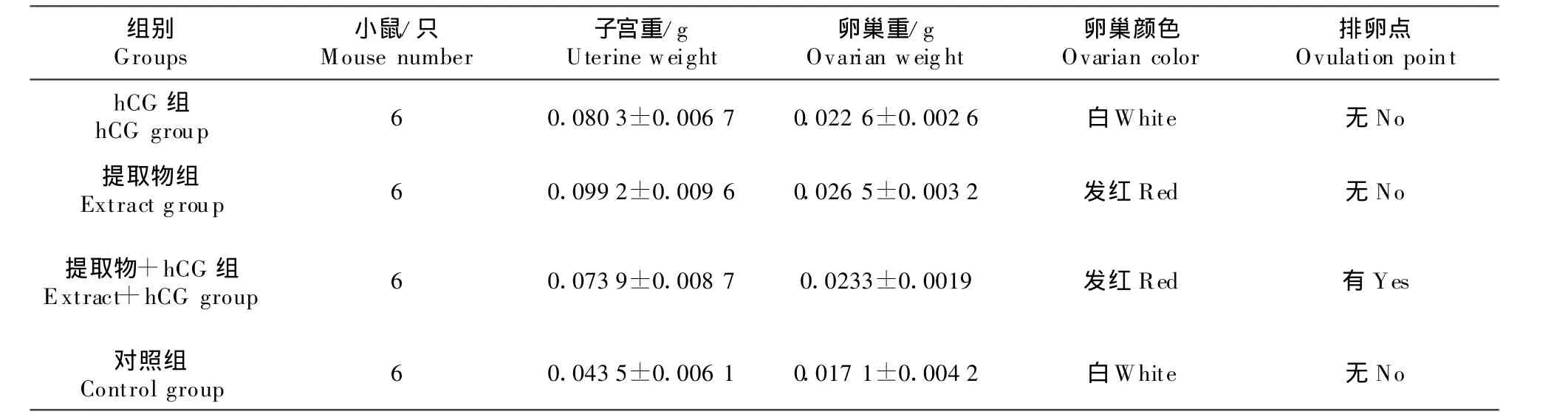
表2 马脑垂体提取生物活性测定结果Table 2 The results of bioactivity measurement of pituitary G TH extract
3 讨论
3.1 马垂体促性腺激素提取条件与要求
本提取试验采用提取液浸泡溶胀垂体前叶,用组织捣碎机将溶胀后垂体前叶捣碎匀浆,更有利于充分振摇提取,比采用粉碎过筛方法更方便。为避免常温下影响马垂体提取物中促性腺激素的生物活性,所有提取过程尽可能在低温条件下操作,以保持提取物中促性腺激素的生物活性[5]。
3.2 提取中乙醇的作用与要求
脑垂体促性腺激素属糖蛋白激素,经提取处理,用760 mL/L~800 mL/L乙醇作为沉淀剂使糖蛋白激素沉淀[5]。加入乙醇受温度的影响,用-10℃~-15℃乙醇边加边搅拌,用酒精比重计测量乙醇浓度,可见到白色沉淀,静置24 h~48 h,分离出沉淀物,上清液含乙醇,可回收利用[6]。
3.3 FSH和LH协同作用的关系
FSH能促进卵泡的早期发育,卵泡成熟则是FS H和LH协同作用的结果。FSH促进颗粒细胞的增殖,卵泡生长和成熟,成熟卵泡在FSH和 LH协同作用下发生排卵[7]。有研究表明,高纯度的FSH制剂能引起动物卵泡生长,但不引起排卵。当血液中FSH和LH达到一定浓度且成一定比例时,才引起排卵。垂体中FSH和LH的含量和比例,因畜种不同而异,并与发情活动有密切关系[8]。因此,本试验提取物为FSH和LH的混合物,且比例是马垂体的自然比例,促马卵泡发育最为合适,不需要进行分离即可使用。
3.4 马垂体提取物生物活性测定效果判断
本试验用小鼠测定马脑垂体提取物的生物活性,结果表明从马脑垂体中提取出的提取物含有促性腺激素,能对小鼠卵巢和子宫产生作用,使小鼠的卵巢颜色出现红色的变化(有卵泡发育),卵巢表面有红色排卵点,与对照组有明显区别,可以确定马脑垂体提取激素具有生物活性。随后在母马使用的结果也证明了本试验提取物具有较高的生物活性,本试验的垂体提取方法可行。
综上所述,本试验用马脑垂体提取获得的促性腺激素提取物,用小鼠做生物活性测定,结果表明本试验提取的马垂体促性腺激素提取物具有生物活性。
[1]郑亦辉.动物激素及其应用[M].江苏南京:江苏科学技术出版社,1996:202-204.
[2]王建辰.家畜生殖内分泌学[M].北京:农业出版社,1993:58-61.
[3]王建辰,章孝荣.动物生殖调控[M].安徽合肥:安徽科学技术出版社,1998:190-195.
[4]陈来同,唐 运.41种生物化学产品生产技术[M].北京:金盾出版社,1994:58-63.
[5]李 津,俞詠霆,董德祥.生物制药设备和分离纯化技术[M].北京:化学工业出版社,2003:166-170.
[6]杨廷富.人绒毛膜促性腺激素的临床意义及检测进展[J].检验医学与临床,2007,4(10):976-978.
[7]潘 琼,宋小白,秦 津,等.哺乳动物促性腺激素细胞研究进展[J].动物医学进展,2008,29(7):63-66.
[8]高志花,周虚,刘立文,等.促性腺激素(FSH、L H)对牛腔前卵泡体外发育及E2分泌的影响[J].中国兽医学报,2008,28(9):2901-2901.
Extraction and Bioactivity Measurement of Equine Pituitary GTH
WANG Zhi-qin1,CHEN Jing-bo2,DONG Hong2,ZHANG Guo-ting2,SUN Jin-quan1
(1.College of Veterinary Medicine,Xinjiang Agricultural University,Urumqi,Xinjiang,830052,China;2.Institute of Animal Science,Xinj iang Academy of Animal Science,Urumqi,Xinj iang,830000,China)
The equine embryo transfer can greatly increase the number of offspring for desire mare individuals.But its application is restricted by the effective of GTH method and the regents for the superovulation treatment.T he equine GTH(gonadotrophic hormone)is only one or a few hormones which effective for the mare superovulation stimulation.The objectives of present experiment were to obtain the extract of horse pituitary and measure its bioactivity.The 3526 horse pituitaries were taken from slaughterhouse freshly,freezing immediately under-20℃.The pituitary GT H crude powder were obtained by fixing,separating the brain membrane,immersion,ground and oscillation centrifugation,sedation,washing,dehydration and dry.The bioactivity was measured by using the mice.The results proved that GTH extraction was successful established.
pituitary;extract;gonadtrophic hormone;equine
Q575.12
A
1007-5038(2010)08-0017-04
2010-04-21
新疆维吾尔自治区科技厅科技攻关项目(200741118)
王志琴(1957-),女,陕西西安人,副教授,主要从事畜产品检验检疫教学与科研工作。*通讯作者