豆类来源D-海因酶的提取及特性研究
D-对羟基苯甘氨酸(D-HPG)是一种重要的医药精细化学品,白色结晶粉末,是合成β-内酰胺类半合成抗菌素的侧链,用于生产阿莫西林、头孢等抗菌素药物。目前D-HPG的生产方法有化学合成法和生物转化法两种。化学合成法得到的是外消旋的对羟基苯甘氨酸,需要经过拆分才能得到光学纯的D型氨基酸,同时存在原料昂贵、产量低、反应时间长以及产生大量废弃物等缺点,逐渐被淘汰。生物转化法是以化学合成的DL-对羟基苯海因 (D,L-p-Hydroxyphenylhydantoin,DL-HPH) 作为生物酶作用的底物,利用D型特异的生物酶将其转化为D-HPG。D-海因酶( D-Hydantoinase,DHase) 和N-氨甲酰水解酶(N-Carbamoylase,DCase) 是生物酶法合成D-HPG中起催化作用的两种酶,由于大部分筛选的海因酶是二氢嘧啶酶,且为D-选择性的,所以许多文献都将DHase等同于二氢嘧啶酶。从D-5单取代海因得到D-氨基酸,先后经过两个步骤:DHase催化底物DL-苯海因或DL-对羟基苯海因生成N-氨甲酰基-D-苯甘氨酸或N-氨甲酰基-D-对羟基苯甘氨酸,再在DCase的作用下生成D-苯甘氨酸(D-PG)或D-HPG[1]。
目前应用较多的海因酶大多从微生物或动物中提取,研究表明二氢嘧啶酶也存在于豆类、番茄和小麦等植物中[2],但是植物来源的二氢嘧啶酶的提取及特性还未见报道,也未见有用于工业化生产D-氨基酸的研究。作者从几种豆子中提取二氢嘧啶酶并进行酶活测定,从中筛选到D-海因酶酶活较高的红小豆,并对红小豆来源的D-海因酶特性进行了研究。
1 实验
1.1 材料与试剂
红小豆、花红小豆、芸豆、绿豆、黑豆、豌豆,市售。
DL-对羟基苯海因、5-苄海因、5-苯海因、5-甲基海因、对二甲氨基苯甲醛(PDAB),上海邦成化工有限公司。
1.2 D-海因酶的提取及纯化
红小豆、花红小豆、芸豆、绿豆、黑豆、豌豆去皮,各称取2 g,用20 mL pH值9.0的硼酸缓冲溶液将其研磨充分,4℃、8000 r·min-1离心60 min。取上清于锥形瓶中,55℃放置10 min以去除热不稳定性蛋白。4℃、12 000 r·min-1离心10 min,取上清分别加入适量硫酸铵,使其成为40%、50%、60%、70%的饱和溶液,4℃反应1 h后于4℃、12 000 r·min-1离心10 min,弃上清,将沉淀溶于5 mL pH值7.0的Tris缓冲溶液中,-20℃储存。
1.3 D-海因酶酶活的测定
4.5 mL 0.4% 底物溶液于37℃预热15 min,加入0.5 mL酶液(对照加入0.5 mL 50 mmol·L-1pH值7.0 Tris缓冲溶液),37℃反应30 min,加入5滴6 mol·L-1HCl终止反应,反应液于8000 r·min-1离心10 min,取上清加入2 mL 5% PDAB溶液,于438 nm测吸光值。
以每分钟转化1 μmol 底物所需的酶量为一个酶活单位U[3]。
1.4 SDS-PAGE
将蛋白样品与等体积的2× SDS 上样缓冲溶液 (0.1 mol·L-1Tris-Cl,10%β-巯基乙醇,0.005% 溴酚蓝,20% 甘油,4%SDS,pH值6.8) 混合后煮沸 10 min,经 12 000 r·min-1离心10 min,取上清进行SDS-PAGE。以 50 V 电压电泳至样品在积层胶和分离胶界面上被压成细线。再以120 V电压电泳1~2 h。电泳结束后以考马斯亮蓝 R250染液染色 4 h 以上,并以甲醇-冰乙酸脱色液脱色[4]。
2 结果与讨论
2.1 不同豆类来源D-海因酶酶活和底物特异性
以不同的单取代海因作为底物,以70%硫酸铵沉淀溶解液为酶液,检测不同豆类来源的D-海因酶的活力,结果如表1所示。
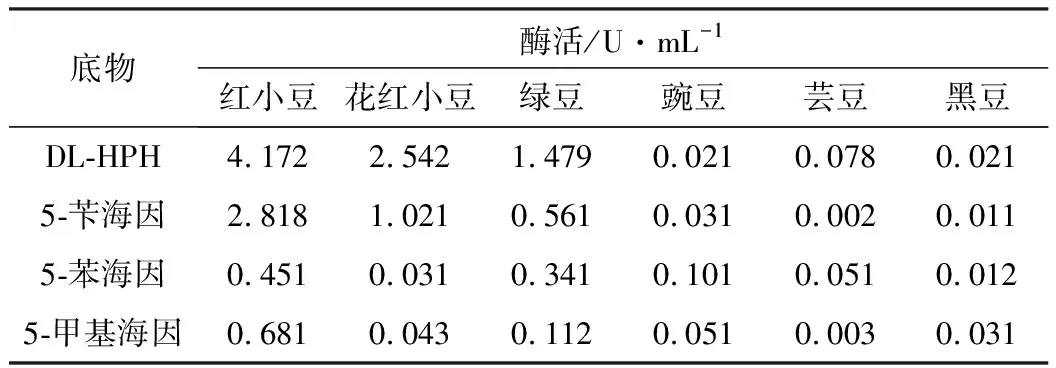
表1 不同豆类来源D-海因酶酶活及底物特异性
从表1可以看出,红小豆、花红小豆、绿豆提取物含有D-海因酶活力,而豌豆、芸豆、黑豆几乎没有D-海因酶活力。其中红小豆来源的D-海因酶酶活最高,最佳的底物是DL-HPH。后续实验均以红小豆来源的D-海因酶为研究对象。
2.2 不同浓度硫酸铵沉淀溶解液的D-海因酶酶活
为了获得最佳的硫酸铵浓度,对红小豆来源的D-海因酶进行了5种浓度的沉淀实验,并测定了以DL-HPH为底物时,在不同硫酸铵浓度下获得的沉淀溶解液的D-海因酶酶活,结果如表2所示。

表2 不同浓度硫酸铵沉淀溶解液的D-海因酶酶活
从表2可以看出,70%硫酸铵沉淀获得的酶液酶活最高。
2.3 不同浓度硫酸铵沉淀溶解液的SDS-PAGE 检测
对不同浓度硫酸铵沉淀的溶解液进行SDS-PAGE电泳分析,结果如图1所示。

1.粗提液 2~6.40%、50%、60%、70%、80%硫酸铵沉淀溶解液
从图1可以看出,研磨得到的红小豆粗提液蛋白质种类多,经过不同浓度的硫酸铵沉淀后蛋白质种类减少,并且在分子量为100 kD处有单一蛋白的富集,其中70%硫酸铵沉淀中蛋白纯度最高,只有一条明显的蛋白带,表明该浓度下D-海因酶酶活最高,由此可以推断此蛋白带为D-海因酶。由于D-海因酶亚基的分子量在50~60 kD,而D-海因酶活性形式大多是同型二聚体或四聚体[5],本研究结果表明D-海因酶在红小豆中以二聚体形式存在。
2.4 酶促反应的最佳条件
2.4.1 反应温度
将红小豆来源的70%硫酸铵沉淀的酶液在不同的温度下进行反应,测定酶活,结果如表3所示。
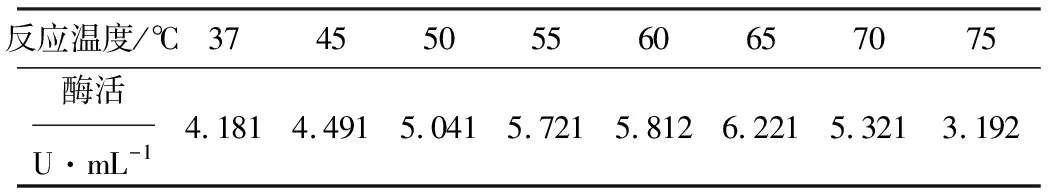
表3 不同反应温度下的D-海因酶酶活
从表3可以看出,酶活随着反应温度的升高逐渐增大,在65℃达到最大值,说明65℃是酶促反应的最佳反应温度。
2.4.2 pH值
在65℃下,测定pH值对酶活的影响,结果如表4所示。

表4 不同pH值下的D-海因酶酶活
从表4可以看出,酶促反应的最佳pH值为8.0。
2.4.3 底物浓度
以DL-HPH为底物,测定不同底物浓度下D-海因酶的酶活,结果如表5所示。
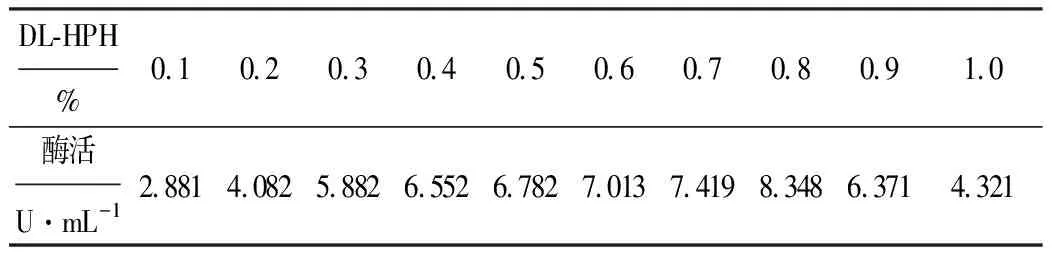
表5 不同DL-HPH浓度下的D-海因酶酶活
由表5可以看出,DL-HPH浓度为0.8%时,D-海因酶酶活最高,达8.348 U·mL-1。
2.5 讨论
与微生物来源的D-海因酶相比,红小豆来源的D-海因酶有以下优点:(1) 不受底物溶解度的影响。海因及其单取代衍生物水溶性很低,需要借助助溶剂以提高底物在培养基中的溶解性[6],吐温-80、DMSO、CTAB和戊二醛都是有效的助溶剂,可以改善底物的溶解性。但是由于上述试剂同时改变了细胞膜的通透性,降低了细胞对热和有机溶剂的稳定性,从而降低了酶活,因此必须控制使用的浓度,使得底物溶解度仍然有限,从而限制了对羟基苯甘氨酸的产量,而红小豆来源的D-海因酶不受活细胞的影响,可以最大限度地提高底物的溶解度,从而提高产率。(2) 红小豆来源的D-海因酶热稳定性高。高温可以增大海因的可溶性并加快其自消旋的速度[7],从而提高产率,本研究表明红小豆来源的D-海因酶最佳反应温度为65℃,比一般微生物来源的D-海因酶耐受温度高出20~30℃,可有效提高产率。
3 结论
本研究对豆类来源的二氢嘧啶酶的提取方法进行了探索,并成功用70%硫酸铵对酶进行了最大量的沉淀和富集,对市面常见几种豆子进行了D-海因酶活力测定和分析,结果表明红小豆、花红小豆、绿豆具有D-海因酶活性,其中红小豆来源的D-海因酶酶活最高。对影响酶促反应的相关因素进行单因素分析,在以0.8%DL-HPH为底物、pH值为8.0、反应温度为65℃的最佳酶促反应条件下,D-海因酶活力最高,达8.348 U·mL-1。
参考文献:
[1] 董妍玲,谭新国,潘学武.海因酶法制备 D-对羟基苯甘氨酸的研究进展[J].氨基酸和生物资源,2009,31(3): 47-52.
[2] Tintemann H, Wasternack C, Helbing D,et al.Pyrimidine degradation in tomato cell suspension cultures and inEuglenagracilislocalization of enzymes[J].Comp Biochem Physiol,1987,88B(3): 943-948.
[3] 严希康.生化分离技术[M].上海:华东理工大学出版社,1996:29-38.
[4] Kruger N J.The Bradford Method for Protein Quantitation.The Protein Protocols Handbook (2nd edition)[M].Totowa N J: Humana Press,2002:15-21.
[5] Cheon Y H,Kim H S,Han K H,et al.Crystal structure of D-hydantoinase fromBacillusstearothermophilus: Insight into the stereochemistry of enantioselectivity[J].Biochemistry,2002,41(30):9410-9417.
[6] Yin B D,Chen Y C,Lin S C,et al.Production of D-amino acid precursors with permeabilized recombinantEscherichiacoliwith D-hydantoinase activity[J].Process Biochemistry,2000,35(9):915-921.
[7] Chung J H,Hack J H,Lim J H,et al.Thermostable hydantoinase from a hyperthermophilic archaeon,Methanococcusjannaschii[J].Enzyme and Microbial Technology,2002,30(7):867-874.

