大肠杆菌hCG核酸疫苗质粒扩增营养条件研究
, , ,
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
核酸疫苗即DNA疫苗,是将编码的保护性抗原基因构建真核表达质粒直接导入动物体细胞内,使外源基因通过机体内源性表达系统并提呈给免疫系统,诱发产生特异性免疫应答,以达到预防和治疗疾病的目的。由于质粒DNA传递系统转染细胞的效率比较低,估计提供给细胞的每1000个质粒分子只有1个能到达细胞核并被表达,导致彻底治愈疾病需要大量的质粒DNA,因此,随着核酸疫苗进入临床研究,必须开发质粒DNA的大规模生产技术。
质粒DNA生产的工艺流程包括质粒DNA的构建、工程菌发酵、菌体收集、细菌裂解、纯化浓缩、质量检验与包装等,其中重组工程菌的发酵和质粒DNA的纯化是影响质粒DNA产量的关键环节。现阶段对发酵生产质粒DNA的研究方向主要集中在培养基的设计和培养条件的优化方面,例如,O′Kennedy等[1,2]研究了培养基对质粒产量的影响,同时就不同发酵策略对质粒产量的影响进行了研究。但是,如以这些研究结果作为本发酵过程的操作依据,并不能解决由不同质粒、不同菌种造成的过程特殊性问题。为此,作者针对含有质粒pVAXON-hCGβ的大肠杆菌DH5α系统,采用摇瓶实验考察了碳源、C/N比对质粒DNA含量的影响,并从代谢途径方面考察了糖酵解途径抑制剂对质粒DNA含量的影响,初步确立了肿瘤核酸疫苗的大肠杆菌发酵的优化营养条件。
1 实验
1.1 材料
1.1.1 菌株与质粒
大肠杆菌DH5α菌株由复旦大学医学院提供。质粒为在pVAX-1的基础上构建的质粒pVAXON-hCGβ,携带有ON33寡核苷酸,大小为3.7 kb,具有硫酸卡那霉素抗性。
1.1.2 培养基
LB液体培养基:胰蛋白胨10 g·L-1,酵母浸出粉5 g·L-1,NaCl 10 g·L-1。
LB固体培养基:胰蛋白胨10 g·L-1,酵母浸出粉5 g·L-1, NaCl 10 g·L-1,琼脂粉2%(质量比)。
PDM培养基:胰蛋白胨7.93 g·L-1,酵母浸出粉4.41 g·L-1,葡萄糖10 g·L-1,Na2HPO4·12H2O 17.096 g·L-1,KH2PO43.00 g·L-1,NH4Cl 0.5 g·L-1,MgSO40.24 g·L-1。
改良的PDM培养基:胰蛋白胨7.93 g·L-1,酵母浸出粉4.41 g·L-1,甘油10 g·L-1,Na2HPO4·7H2O 20.5152 g·L-1,KH2PO43.6 g·L-1,NH4Cl 2.68 g·L-1,MgSO40.24 g·L-1。使用时加入50 μg·mL-1硫酸卡那霉素。
1.2 培养方法
1.2.1 种子培养
取-80℃保存的甘油管菌种涂板于含50 μg·mL-1硫酸卡那霉素的LB固体培养基,37℃培养36 h,挑取单菌落接入50 mL LB液体培养基,37℃、250 r·min-1培养10 h。
1.2.2 摇瓶发酵培养
将培养好的种子液以1%(体积比)的接种量转接至发酵培养基中(250 mL锥形瓶中装入50 mL发酵培养基及50 μg·mL-1硫酸卡那霉素),37℃、250 r·min-1培养10 h。
1.3 分析方法
1.3.1 细胞密度测定
菌体浓度稀释至OD600=0.1~0.6(d=1 cm),用分光光度计在600 nm处测细胞密度。
1.3.2 菌体干重(DCW)测量
用预先称重的离心管取一定体积发酵液,10 000 r·min-1离心10 min,弃去上清,用去离子水重新悬浮细胞,10 000 r·min-1离心10 min,弃去上清,于110℃的烘箱内烘干,经3次称重,恒重后得到菌体干重。
1.3.3 质粒产量的测定
称取一定量离心后的湿菌体,用Omega公司提供的质粒抽提试剂盒提取质粒,吸取800 μL经试剂盒抽提得到的质粒DNA溶液,加水3 mL,转入石英比色皿中测A260和A280,以A260乘以50得出纯化后质粒DNA的含量( mg·L-1),质粒拷贝数由单位菌体质粒含量(mg质粒/g菌体干重,记为mg·g-1)衡量[3]。
2 结果与讨论
2.1 碳源对细胞生长和质粒产量的影响
碳源对菌体生长和产物形成非常重要,由于菌种所含的酶系统不完全一样,各类菌种对不同碳源的利用速率和效率也不一样,同时不同碳源发酵的同一菌体得率和产物收率也不同,所以选择合适的碳源非常重要。在PDM培养基中用不同碳源做对比实验,其添加量为10 g·L-1,考察碳源对细胞生长和质粒产量的影响,结果如图1所示。
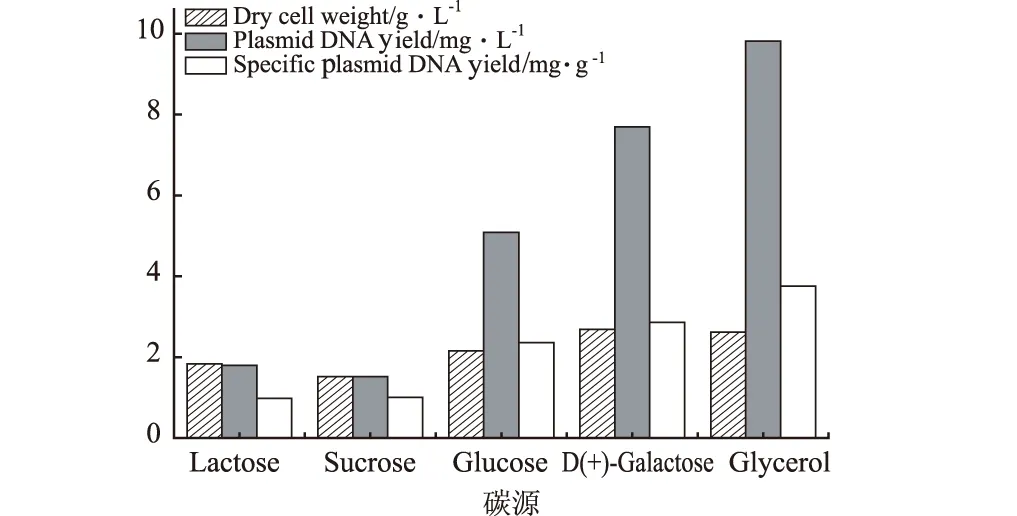
图1 碳源对质粒DNA产量和菌量的影响
由图1可知,用乳糖和蔗糖作碳源时,菌量和质粒DNA含量较低,用葡萄糖作碳源时,质粒DNA含量远远低于用甘油作碳源,这是由于过多的葡萄糖会过分加速菌体的呼吸,大大降低培养基内的溶氧,使得一些中间代谢物不能完全氧化而积累在菌体或培养基内,如乳酸、乙酸等酸性物质,从而严重地影响了质粒的复制,而用甘油作碳源时,其在一定程度上能够避免一些中间代谢物的阻碍作用和抑制性有机酸的积累,因此,虽然菌量不是最高,但质粒含量和单位菌体质粒含量却最高,表明甘油是大肠杆菌产pVAXON-hCGβ质粒的最佳碳源。
2.2 初始甘油浓度对细胞生长和质粒产量的影响
将大肠杆菌DH5α菌株培养在以甘油为唯一碳源的改良PDM培养基中,考察初始甘油浓度对细胞生长和质粒产量的影响,结果如表1所示。

表1 初始甘油浓度对菌量和质粒DNA产量的影响
由表1可知,随着初始甘油浓度的增加,菌量变化不大,但质粒含量却有较大差别,初始甘油浓度为2 g·L-1时,质粒含量较高,随着初始甘油浓度的进一步提高,质粒含量下降,随后继续上升,当初始甘油浓度为10 g·L-1时,菌量只有2.23 g·L-1,但质粒含量和单位菌体质粒含量却达到最高,分别为9.54 mg·L-1和4.29 mg·g-1。
2.3 C/N比对细胞生长和质粒产量的影响
改变PDM培养基中NH4Cl浓度,使碳氮比(C/N)在4.39~6.84之间变化,考察C/N比对细胞生长和质粒产量的影响,结果如图2所示。
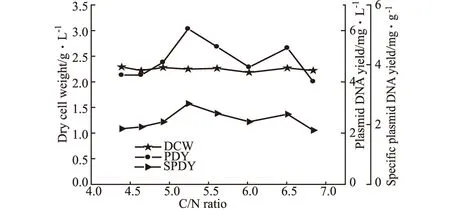
图2 C/N比对菌量和质粒DNA产量的影响
由图2可知,菌量、质粒DNA含量和单位菌体质粒含量受C/N比影响较大,质粒含量在C/N比为5.24时可达6.068 mg·L-1。C/N比对质粒DNA含量影响较大的原因仍不是很清楚,但Bryers等[4]认为大肠杆菌中质粒的丢失率与C/N比有很大的关系,当大肠杆菌在较高的C/N比中生长时,代谢的葡萄糖大部分被用于胞外聚合物的生产,这有可能使细胞中质粒的拷贝数受到影响,从而使质粒的产量减少。
2.4 柠檬酸钠浓度对细胞生长和质粒产量的影响
向改良的PDM培养基中添加不同浓度(0~9 g·L-1)的柠檬酸钠,考察其对细胞生长和质粒产量的影响,结果如图3所示。

图3 柠檬酸钠浓度对菌量和质粒DNA产量的影响
由图3可知,添加柠檬酸钠后菌量下降,随其浓度的不断增加,菌体生长受到严重抑制,当柠檬酸钠添加量小于3 g·L-1时,质粒DNA含量不断提高,添加量为3 g·L-1时质粒DNA含量最高为11.73 mg·L-1,提高了20%。这是因为柠檬酸、ATP是磷酸果糖激酶(PFK)的变构抑制剂,胞内柠檬酸可通过加强ATP的抑制效应来抑制磷酸果糖激酶的活力,柠檬酸钠的添加降低了PFK的活力,而PFK又是影响EMP途径通量的关键酶,其活力降低则糖酵解过程减慢。另外,柠檬酸可以增加钙离子的吸收,而钙离子是丙酮酸激酶(PK)的强烈抑制剂,因此柠檬酸钠的添加导致了糖酵解途径中关键酶PFK和PK活力的降低,从而引起糖酵解过程酶反应速率减慢,通量减少,进而导致HMP途径代谢通量的增加,为核酸的生物合成提供更多的前体。
2.5 氟化钠浓度对细胞生长和质粒产量的影响
在菌体生长8 h后向改良的PDM培养基中添加不同浓度的氟化钠,考察其对细胞生长和质粒产量的影响,结果如图4所示。

图4 氟化钠浓度对菌量和质粒DNA产量的影响
由图4可知,添加氟化钠后菌量有所下降,但质粒含量和单位菌体质粒含量却随氟化钠浓度的增大而增大,当添加氟化钠浓度为120 mg·L-1时,质粒含量和单位菌体质粒含量最高为12.09 mg·L-1和4.851 mg·g-1,质粒含量比未添加氟化钠时提高了29%。当浓度超过120 mg·L-1后,质粒含量开始下降。这可能是因为氟化钠是糖酵解抑制剂,可以降低糖酵解途径中丙酮酸激酶的酶活力[5],从而有效地减少了糖酵解途径的代谢流,可使更多的糖类转向HMP途径,为核苷酸和核酸的生物合成提供更多的前体。
2.6 乙醇浓度对细胞生长和质粒产量的影响
向改良的PDM培养基中添加不同浓度的乙醇,考察其对细胞生长和质粒产量的影响,结果如图5所示。

图5 乙醇浓度对菌量和质粒DNA产量的影响
由图5可知,加入不同浓度的乙醇后菌量均下降,当乙醇添加量为2 g·L-1时,质粒含量最高为12.94 mg·L-1,比未添加时提高了32%,随乙醇浓度的进一步增大,质粒DNA含量下降。一般认为培养基组成对细胞生长速率有影响,并进而影响质粒拷贝数。细胞分裂过快,质粒复制速率赶不上细胞分裂速率,容易造成质粒丢失,细胞的比生长速率越快,质粒拷贝数越低。加入乙醇后,由于其能够降低水活度和乙醇本身的毒性,对菌体生长产生抑制作用,导致生长速率的减缓,质粒拷贝数提高。而高浓度的乙醇毒性增加,对维持细胞、酶与膜的功能与结构不利,导致菌量和质粒拷贝数下降。另外,Stouthamer[6]发现,合成1 g(34.7 mmol)不含质粒的细胞所需的能量大部分被用于蛋白合成,只有3.2%的能量用于DNA合成,而含有质粒的细胞中带有卡那霉素抗性基因,由于这些细胞中卡那霉素磷酸转移酶的合成致使ATP需求增加了24%[7],因此卡那霉素磷酸转移酶的合成可能是质粒DNA复制的一个瓶颈,而乙醇在代谢过程中被氧化成乙酸,并释放能量,产生ATP,因此乙醇的加入可能同时还起到了能源的作用。
3 结论
(1)甘油是质粒DNA生产的最佳碳源;C/N比对质粒DNA含量影响明显。向改良的PDM培养基中添加3 g·L-1的柠檬酸钠,可以降低糖酵解途径的代谢通量,使质粒含量达到11.73 mg·L-1, 提高了20%。
(2)氟化钠是糖酵解途径的抑制剂,在菌体生长8 h后,向改良的PDM培养基中添加浓度为120 mg·L-1的氟化钠,培养后质粒DNA含量为12.09 mg·L-1,提高了29%。氟化钠是具有一定毒性的物质,在合适的时间添加适量的氟化钠才会在基本不影响菌体正常代谢的条件下提高质粒DNA的含量。本实验未深入研究氟化钠对菌体的负面影响。
(3)在改良的PDM培养基中添加2 g·L-1的乙醇,可使质粒DNA含量达到12.94 mg·L-1,比未添加时提高了32%。乙醇提高质粒DNA含量的作用机制尚需进一步深入研究,且乙醇易燃,存在安全隐患问题。
参考文献:
[1] O′Kennedy R D, Ward J M,Moore E K. Effects of fermentation strategy on the characteristics of plasmid DNA production[J]. Biotechnology and Applied Biochemistry, 2003, 37(Pt1):83-90.
[2] O′Kennedy R D, Ward J M, Moore E K. Effects of growth medium selection on plasmid DNA production and initial processing steps[J]. Journal of Biotechnology, 2000, 76:175-183.
[3] 奥斯伯著,颜子颖,王海林,译.精编分子生物学实验指南[M].北京:科学出版社, 1998: 698.
[4] Bryers J D, Huang C T. Recombinant plasmid retention and expression in bacterial biofilm cultures[J]. Water Sci Technol, 1995, 31(1):105-115.
[5] Guminska M, Sterkowicz J. Effect of sodium fluoride glycolysis in human erythrocytes and Ehrlich tumor cellsinvitro[J]. Acta Biochim Pol, 1976, 23(4):285-291.
[6] Stouthamer A H. A theoretical study on the amount of ATP required for synthesis of microbial cell material[J]. Antonie Van Leeuwenhoek, 1973, 39(1):545-565.
[7] Rozkov A, Avignone-Rossa C A, Ertl P F. Characterization of the metabolic burden onEscherichiacoliDH1 cells imposed by the presence of a plasmid containing a gene therapy sequence[J]. Biotechnology and Bioengineering, 2004, 88(7):909-915.

