小鼠内耳圆窗基因导入的实验研究△
朱光洁 徐琳 高下 陈杰 丁小琼 麻晓峰 陆玲 秦小明 周函 崔昕燕
小鼠内耳圆窗基因导入的实验研究△
朱光洁1,2徐琳2高下2陈杰2丁小琼2麻晓峰2陆玲2秦小明2周函2崔昕燕2
目的 研究携带增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)腺病毒(Ad-EGFP)经由小鼠耳后圆窗径路导入内耳的可行性,分析EGFP在耳蜗内的表达特点。方法 19只健康的8~9周龄C57BL/6J雄性小鼠随机分为三组:Ad-EGFP组7只,人工外淋巴液组6只,两组通过耳后切口圆窗径路注射,分别导入Ad-EGFP和人工外淋巴液;空白对照组6只,未予处理。各组均于术前3日和术后7日行听性脑干反应(ABR)检查;术后7日取出耳蜗于荧光显微镜下观察EGFP在内耳的分布并行免疫组化观察EGFP在基底膜的表达。结果 3组动物术前ABR反应阈差异无统计学意义(P>0.05),术后7日,Ad-EGFP组ABR反应阈为62.86±9.94 dB SPL,人工外淋巴液组ABR反应阈为60.83±9.70 dB SPL,均较术前(37.86±8.59和34.16± 8.04 d B SPL)及空白对照组(40.83±8.61 dB SPL)高(P值均<0.05);空白对照组实验前后ABR反应阈无变化,Ad-EGFP组与人工外淋巴液组术后7天ABR反应阈差异无统计学意义(P值均<0.05)。Ad-EGFP组Ad-EGFP导入后在基底膜上可见EGFP呈广泛表达,人工外淋巴液组和空白对照组基底膜未见荧光表达。结论 外源性基因可经内耳圆窗导入并在耳蜗基底膜上广泛表达。
基因转导; 圆窗; 腺病毒; 小鼠; EGFP
内耳基因治疗作为感音神经性聋的新兴手段目前研究广泛,合理的手术入路及良好的动物模型是内耳基因治疗能够得以实施的研究基础。作为经典的动物模型,豚鼠和大鼠实验证实了内耳基因转导技术的可行性[1,2]。小鼠作为遗传学研究的动物模型,近年来,引起了耳科学界的关注[3~5],如将遗传性聋小鼠和内耳基因转导技术良好的结合,将可能为人类遗传性聋找到一条新的治疗途径。然而,鉴于小鼠内耳的解剖特点,怎样将携带目的基因的载体成功导入体积微小的耳蜗是实验研究中的主要难点,选择合适的手术入路十分重要。本研究采用经圆窗鼓阶显微注射法,通过将携带增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的腺病毒(Ad-EGFP)经耳后入路圆窗导入,观察腺病毒能否转导入小鼠内耳并进行相应蛋白的表达,以期为后续的目的基因转导遗传性聋小鼠内耳实验奠定基础。
1 材料与方法
1.1 材料 携带增强型绿色荧光蛋白基因的重组腺病毒(Ad-EGFP,滴度:1×109PFU)由南京大学模式动物研究所张文程博士提供。
1.2 动物分组 健康的8~9周龄C57BL/6J小鼠19只,雄性,体重20~30 g(南京大学模式动物研究所提供)。随机分成三组:Ad-EGFP组7只,人工外淋巴液组6只,空白对照组6只。Ad-EGFP组及人工外淋巴液组均以左耳作为手术耳,分别于术中经圆窗注入Ad-EGFP及人工外淋巴液;空白对照组正常饲养,不做任何处理。
1.3 内耳圆窗基因导入方法 Ad-EGFP组和人工外淋巴组动物以三溴乙醇(2,2,2-Tribromoethanol)500 mg/kg腹腔注射麻醉,在手术显微镜下,沿术侧耳根部外侧弧形切开皮肤及皮下组织,沿肌腱剪断胸锁乳突肌,暴露下方二腹肌后腹和听泡后壁。在高倍镜下用尖镊咬开听泡,暴露镫骨动脉及上方圆窗,将微量注射器内1μL Ad-EGFP重组腺病毒或人工外淋巴液经圆窗缓慢注入耳蜗,取预先备好的脂肪迅速封堵圆窗,耳脑胶覆盖脂肪块,分层缝合切口,37℃热台复苏。
1.4 听性脑干反应(ABR)测试 各组动物分别于术前3天和术后7天应用TDT system3(Tucker-Davis Technologies,美国)系统行ABR测试(均测试左耳)。测试于隔声屏蔽室内进行,小鼠俯卧位于测试台上,颅顶为记录电极,测试耳为参考电极,鼻尖处接地线。刺激声为短声(click),叠加1 024次,滤波带宽10~3 000 Hz,给声范围110 dB至0 dB终止,以给声刺激至少能引出波I及波II并与上一波形有延续性为阈值判断标准。
1.5 耳蜗基底膜铺片及免疫荧光染色 于术后7天断颈处死动物,迅速挑开听泡,取出耳蜗,置于4%多聚甲醛磷酸盐缓冲液(p H 7.4)中,在体式荧光显微镜下(Leica,德国)进行内耳外观形态观察后,于解剖显微镜下(Leica,德国)进行蜗顶打孔,开放圆窗及卵圆窗。4℃固定过夜,10%EDTA室温脱钙三天,基底膜铺片。
基底膜铺片标本经PBS洗后0.3%的Triton X-100破膜10分钟。PBS洗后5%BSA封闭组织30分钟后,加1:100稀释兔抗鼠EGFP(Santa Cruze,美国)一抗4℃湿盒过夜。PBS洗后加1:200羊抗兔488标记二抗(Pierce,美国),室温30分钟,湿盒闭光。PBS洗后50%甘油磷酸盐溶液封片,激光共聚焦显微镜观察EGFP的分布并拍片(Leica,德国)。
1.6 统计学方法 各组ABR反应阈比较采用SPSS 11.0统计软件包中方差分析和t检验分析处理,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组术前3天及术后7天ABR反应阈 术前3天三组间ABR反应阈比较差异无统计学意义(P>0.05);Ad-EGFP组及人工外淋巴液组术后7天与术前3天及空白对照组比较差异有统计学意义(P<0.05);Ad-EGFP组与人工外淋巴液组术后7天比较差异无统计学意义(P>0.05)(表1)。
表1 各组动物手术前后ABR阈值
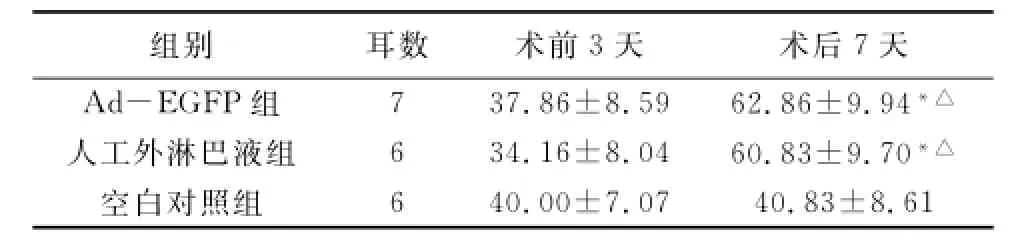
表1 各组动物手术前后ABR阈值
注:*与同组术前3天比较,P<0.05;△与空白对照组术后7天比较,P<0.05
组别耳数术前3天术后7天Ad-EGFP组7 37.86±8.59 62.86±9.94*△6 40.00±7.07 40.83±8.61人工外淋巴液组6 34.16±8.04 60.83±9.70*△空白对照组
2.2 动物术后中、内耳外观观察 术后无动物死亡,术后7天取材时见动物中耳腔内清洁,未见中耳及内耳炎症、出血等反应。体式荧光显微镜下可见Ad-EGFP组EGFP的表达部位包括内耳的圆窗、前庭窗及听小骨、镫骨动脉及耳蜗附近软组织等广泛区域;剥开耳蜗骨壁,则可见血管纹、螺旋韧带、基底膜和骨螺旋板等部位有大量荧光表达(图1)。人工外淋巴液组(图2)和空白对照组双侧耳蜗则无荧光表达。
2.3 基底膜免疫荧光观察结果 Ad-EGFP组基底膜铺片Corti器形态良好,荧光表达部位包括从顶回到底回的支持细胞区域、骨螺旋板区域、螺旋神经节细胞等(图3)。人工外淋巴液组和空白对照组双侧耳蜗基底膜铺片未见EGFP表达。
3 讨论
小鼠是发育、分化及疾病在基因水平研究的最主要的动物模型,与人类基因型有极高的同源性,内耳结构和功能与人类极为相似,基因打靶技术可在小鼠体内进行人类耳聋基因的研究等[6~8],因此,小鼠作为内耳基因治疗研究的模式动物,有明显的优点。但由于小鼠内耳的解剖结构的特殊性也使其成为困扰实验者进行外源基因导入的瓶颈,如小鼠耳蜗体积小,外淋巴容积仅为0.6μl,限制了导入外源基因的体积;耳蜗骨壁较脆,对钻孔技术要求高;镫骨动脉紧贴圆窗龛下方,手术过程中易触碰之造成大出血[4,5]。
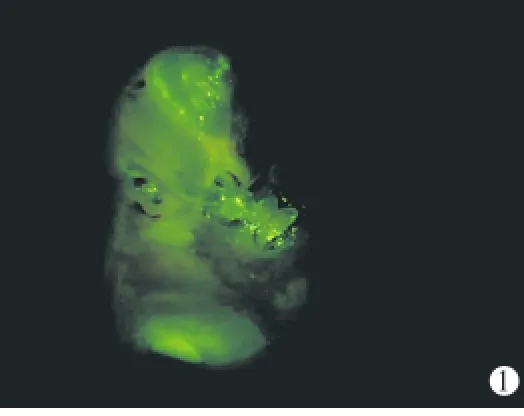
图1 荧光显微镜下Ad-EGFP组术侧耳蜗大体标本 圆窗附近及顶转均可见EGFP阳性绿色荧光信号(×16)
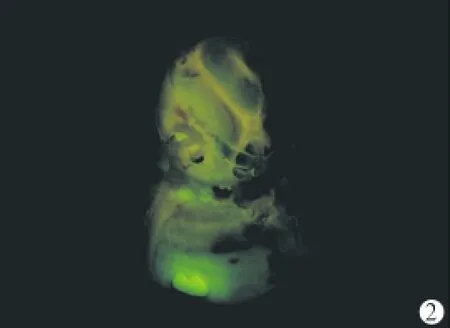
图2 荧光显微镜下人工外淋巴液组术侧耳蜗大体标本 未见EGFP阳性绿色荧光信号(×16)
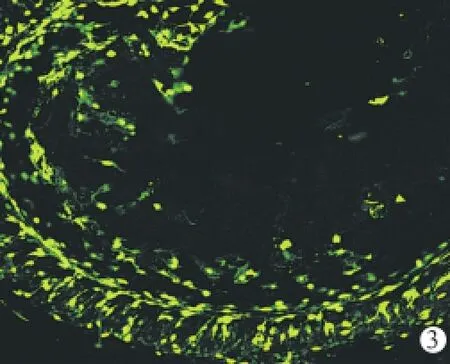
图3 激光共聚焦显微镜下Ad-EGFP组术侧耳蜗基底膜免疫组化铺片 基底膜上EGFP呈广泛表达(×200)
目前,载体经外淋巴导入的途径主要有听泡上打孔及听泡外途径两类,其中,听泡上打孔又可分为经圆窗鼓阶显微注射、微渗透泵导入或圆窗膜上粘贴浸泡治疗介质的明胶海绵三种经圆窗途径[9,10]及耳蜗切开鼓阶显微注射、微渗透泵导入两种途径[11,12];听泡外途径包括听泡外鼓阶显微注射法和外半规管切开显微注射法[13,14]。经圆窗及耳蜗切开直接注射是耳蜗转基因载体导入的经典方法,定位确切,转入效率高,但破坏了听泡结构的完整性,有可能影响声音的传入。明胶海棉浸入脂质体及腺病毒载体贴圆窗膜法能成功地将外源基因经完整圆窗膜导入耳蜗内的许多组织中并得到表达,但也要破坏听泡本身。经半规管和听泡外鼓阶途径也能够将转基因载体成功导入并保持了听泡的完整性,但可能会致前庭功能受损。故怎样将携带目的基因的载体成功导入体积微小的小鼠内耳中并保持术后无听力下降是实验研究中的主要难点,选择一条合适的手术入路十分重要。
考虑到小鼠耳蜗相对容积小,操作困难,本研究采取了经圆窗膜导入的方法,成功地将Ad-EGFP转染至耳蜗各部位,实现了腺病毒在内耳的成功转染,分析原因可能与实验过程中缓慢注入约1μl腺病毒载体后迅速用脂肪封堵,有效的预防了液体外漏有关。然而,腺病毒在内耳的转染部位却不能人为控制,有很大的随机性,与腺病毒在淋巴液中的运动有关,这可能需要运用更有细胞针对性的新型载体来进行实验。
从文中结果看,术后Ad-EGFP组、人工外淋巴液组听力均较术前有所下降(P<0.05),两组术后听力比较差异无统计学意义。可见,圆窗膜导入方法影响了小鼠的术后听力,其原因可能为:一是破坏圆窗膜,影响了听骨链、外淋巴液机械能的传递与释放,造成了传导性聋;二是液体导入过程中对膜迷路产生的机械损伤。
目前应用于耳蜗的转基因载体主要包括病毒类和非病毒类,其中病毒类包括逆转录病毒、腺病毒、腺相关病毒、疱疹病毒、慢病毒等;非病毒类有脂质体、纳米材料等。非病毒载体无免疫原性,有研究证实能够携EGFP成功转染内耳[15,16],但由于其转染效率低,不能长期表达,目前应用较少。腺病毒是转基因研究中最常用的载体,导入效率明显高于逆转录病毒,能够制备较高滴度的病毒,且对非分裂细胞也具有很好的感染性,虽然免疫原性不可避免,但某些亚型几无致病性。故本研究选用了腺病毒作为载体,结果显示能够将基因成功转染细胞且未见明显炎症反应,为下一步的内耳转基因治疗打下基础。
1 Kawamoto K,Ishimoto S,Minoda R,et al.Math1 gene transfer generates new cochlear hair cells in mature guinea pigs in vivo[J].Neurosci,2003,23:4 395.
2 Huang Y,Chi F,Han Z,et al.New ectopic vestibular hair cell-like cells induced by Math1 gene transfer in postnatal rats[J].Brain Res,2009,1 276:31.
3 Leibovici M,Safieddine S,Petit C.Mouse models for human hereditary deafness[J].Curr Top Dev Biol,2008,84:385.
4 徐延军,胡吟燕,翟所强,等.耳后入路圆窗膜显微注射小鼠耳蜗基因转染新途径的研究[J].听力学及言语疾病杂志,2009,17:279.
5 徐延军,杨仕明,胡吟燕,等.腹侧听泡外入路小鼠耳蜗鼓阶基因导入的实验研究[J].中华耳科学杂志,2009,7:79.
6 Peters LL,Robledo RF,Bult CJ,et al.The mouse as a model for human biology:A resource guide for complex trait analysis[J].Nat Rev Genet,2007,8:58.
7 Brown SD,Hardisty-Hughes RE,Mburu P.Quiet as a mouse:Dissecting the molecular and genetic basis of hearing[J].Nat Rev Genet,2008,9:277.
8 Alagramam KN,Brown SD,Davis RR,et al.Foreword for special issue:Mouse models for hearing research[J].Brain Res,2009,1 277:1.
9 Aarnisalo AA,Aarnisalo P,Pietola L,et al.Efficacy of gene transfer through the round window membrane:An in vitro model[J].ORL J Otorhinolaryngol Relat Spec,2006,68:220.
10 Jero J,Mhatre AN,Tseng CJ,et al.Cochlear gene delivery through an intact round window membrane in mouse[J].Hum Gene Ther,2001,12:539.
11 Carvalho GJ,Lalwani AK.The effect mouse of cochleostomy and intracochlear infusion on auditory brainstem response thresholds in the guinea pig[J].Am J Otol,1999,20:87.
12 Han JJ,Mhatre AN,Wareing M,et al.Transgene expression in the guinea pig cochlea mediated by the lentivirus derived gene transfer vector[J].Hum Gene Ther,1999,10:1 867.
13 Kawamoto K,Oh SH,Kanzaki S,et al.The functional and structural outcome of inner ear gene transfer via the vestibular and cochlear fluids in mice[J].Mol Ther,2001,4:575.
14 Praetorius M,Baker K,Weich CM,et al.Hearing preservation after inner ear gene therapy:The effect of vector and surgical approach[J].ORL J Otorhinolaryngol Relat Spec,2003,65:211.
15 Tan BT,Foong K H,Lee MMG,et al.Polyethyleniminemediated cochlear gene transfer in guinea pigs[J].Arc Otol Head Neck Surg,2008,134:884.
16 Wareing M,Mhatre AN,Pettis R,et al.Cationic liposome mediated transgene expression in the guinea pig cochlea[J].Hear Res,1999,128:61.
(2009-11-09收稿)
(本文编辑 雷培香)
Gene DeIivery through Round Window Membrane in Mouse Inner Ear
Zhu Guangjie*,Xu Lin,Gao Xia,Cheng Jie,Ding Xiaoqiong,Ma Xiaofeng,Lu Ling,Qin Xiaomin,Zhou Han,Cui Xinyan
(*The medicaI coIIege of Southeast University,Nanjing,210009,China)
Objective To investigate the expression of enhanced green fluorescence protein(EGFP)in inner ear of mice by microinjecting through the round window membrane with adenoviral vectors.Methods 19 healthy C57BL/6J mice were selected and divided into three groups:Ad-EGFP group,artificial perilymphatic fluid group and control group.7 mice were microinjected Ad-EGFP through round window membrane,6 mice were implanted with artificial perilymphatic fluid,and the left 6 mice were maintained as controls.Auditory brainstem response(ABR)thresholds were tested in all animals three days before surgery and seven days after surgery.All animals were sacrificed and the surface preparations of basilar membrane were carried out seven days after surgery.ResuItsABR results showed that this surgery had significant side-effect on the hearing of mice,but there was no significant difference between Ad-EGFP group and artificial perilymphatic fluid group after mircoinjection.Bright green fluorescence in cochleae was observed in Ad-EGFP group while artificial perilymphatic fluid group and control group were free of fluorescence.ConcIusion The transgenic technique can successfully deliver EGFP into the inner ear by microinjection through round window membrane.
Gene transfer; Round window; Adenovirus; Mouse; EGFP
10.3969/j.issn.1006-7299.2010.04.011
R764.9+3
A
1006-7299(2010)04-0347-04
△ 国家自然科学基金(30973302)、江苏省重点人才项目基金(RC2007010)、南京市医学科技重点项目基金(ZKX06019)资助项目1 东南大学医学院(南京 210009); 2 南京大学医学院附属鼓楼医院耳鼻咽喉-头颈外科
朱光洁,女,江苏人,硕士研究生,研究方向:听力学基础研究。
高下(Email:xiagao213@yahoo.com.cn)

