基于抗原的1型糖尿病治疗
考夫曼 等
引言
基于抗原的治疗策略(ABTs)是通过诱导调节性T细胞应答(主动耐受)或降低/消除病理性T细胞效应(被动耐受),以达到预防或抑制自身免疫性疾病的目的。理论上,这种治疗方法可以促进免疫耐受且对免疫系统功能影响有较小影响。临床上应用ABTs治疗自身免疫性疾病尚处于初级阶段。尽管最初应用ABTs治疗多发性硬化,类风湿性关节炎及1型糖尿病时的疗效并不理想、但最近的临床研究结果提示ABTs有希望延缓1型糖尿病的发病,保护成人隐匿性自身免疫性糖尿病(LADA)及新诊断的儿童1型糖尿病患者的胰岛β细胞功能。若此结果被证实,ABTs将实现由NOD鼠实验发现到临床应用的重要转化。然而,NOD鼠的实验研究表明,ABTs带来的免疫学影响比之前预计的要更多变和复杂得多。关于啮齿类动物和人类在1型糖尿病发病机制上的差别及其他免疫治疗方法在之前发表的文章中已有全面综述,在此,我们仅以ABTs为中心,讨论其免疫性影响,理论上可影响其疗效和安全性的因素,以及有希望用于评价其疗效的标记物。
针对β细胞抗原的炎症性T细胞反应在鼠科和人类1型糖尿病发展中广泛存在
1型糖尿病是由自身反应性T细胞识别β细胞自身抗原(β- CAAs)所介导的。在NOD鼠中,自身反应性CD4+T细胞主要是Th1型(分泌干扰素γ),随着病程发展,自身免疫反应逐渐扩展到β- CAAs分子内和分子间,如胰岛素、GAD、热休克蛋白(HSP)、IGRP等。同样,自发性CD8+T细胞应答亦扩展到如胰岛素、GAD、IGRP等其他β- CAAs。与在NOD小鼠的观察相似,在人类1型糖尿病患者中,针对许多β-CAAs自身反应性CD4+(主要是Th1)和 CD8+T细胞亦有上升。这种扩散的炎症性T细胞反应将引起促炎瀑布级联反应,从而推动疾病的进一步发展。
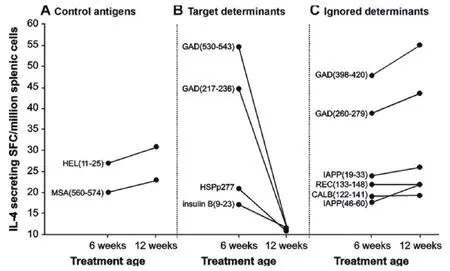
图1
ABT介导的主动耐受
给予自身抗原能诱导调节性T细胞反应,如Th2 (分 泌 白 介 素 [IL]:IL-4和 IL-5)、 Th3(分泌TGFβ)及Tr1 (分泌IL-10),以及CD4+CD25+Foxp3+调节性T细胞 (分泌IL-10 和TGFβ)的应答,从而抑制促炎性的Th1 和Th17反应,以在动物模型中阻止1型糖尿病、多发性硬化、风湿性关节炎及葡萄膜炎等发生。诱导这种主动耐受无需起始目标抗原或效应T细胞特异性信息。当治疗介导的调节性T细胞识别炎症反应部位的抗原时,将释放抗炎因子以抑制局部效应T细胞的作用,这种旁观者抑制(bystander suppression)的作用不具有特异性。尽管炎症型自身反应性T细胞应答持续存在,ABT介导的调节性应答能建立组织特异性的长期的功能性耐受而不削弱其免疫力。
ABTs不仅可诱导针对给定自身抗原的免疫应答,还能产生针对其他靶组织自身抗原的免疫反应。例如,NOD鼠经单个β- CAA和不完全弗氏佐剂(IFA)联合处理后,可产生注射的自身抗原以及其他检测的β细胞自身抗原的Th2应答。这种调节性应答的扩散仅限于β- CAA目标决定簇,而不会发生在野生型小鼠。在器官移植后和实验性自身免疫性脑脊髓炎(EAE)模型中,亦可观察到由ABT介导的Tr1和Treg应答扩散。因此,与炎症反应相似,调节性T细胞反应亦可扩展,可能是通过分泌细胞因子和作用于抗原递呈细胞(APCs)推动相似T细胞应答的活化或扩展。
这种由ABT介导的调节性应答可广泛和快速的扩散。例如,经IFA联合单个β- CAA免疫处理的新生NOD小鼠,在4周龄时,针对所有检测β- CAA的Th2型细胞自身免疫反应在脾脏均可出现,这与在未经处理的NOD小鼠中最早检测出β- CAA自身应答时间相比要早得多。有证据显示,在发生胰岛炎之前,NOD鼠体内即存在β- CAA反应性T细胞,给予有效协同信号,后者可迅速激活和/或扩散。由于Th2应答可扩展至所有检测的β- CAA目标决定簇,因此,扩散的调节性T细胞应答数目可能远远超过针对给予β- CAA自身的数目。
除了增加旁观者抑制作用外,扩展的调节性T细胞应答能减少可致病性未接触抗原刺激的效应型T细胞群。此外,其分泌的抗炎因子能诱导耐受性APCs,从而进一步促进调节性T细胞应答。这些协同作用可能是ABT具保护作用的基础。
影响NOD小鼠ABTs疗效的因素
抗原大小
小分子抗原可能仅包含一个抗原决定簇,因而只能由一个特定的主要组织相容性符合体(MHC)递呈,而一个大分子蛋白质包含很多决定簇,由各个MHC等位基因递呈。因此,ABTs中使用的抗原大小影响其诱导T细胞应答的程度。事实上,是GAD而非胰岛素β链或HSPp277接种疫苗延长了糖尿病NOD鼠同系胰岛移植后的存活,且在NOD小鼠治疗中,联合GAD多肽段比单个多肽预防疾病更有效。
抗原表达形式
由于各个自身蛋白表达形式不同,因此,无论是其诱导的外周和中枢耐受还是留守细胞库的抗原特异性(同源)T细胞数量和活性均存在差异。人类胸腺中所表达的胰岛素原水平,是受1型糖尿病易感基因多态性调节的。NOD小鼠胸腺表达胰岛素原2而非胰岛素原1 ,敲除胰岛素原2基因将加速疾病发展过程。GAD65基因能否转染到NOD鼠胸腺中表达尚有争议,但胸腺中尚未检测出GAD酶活性(D.L.K.,未发表数据)。GADs在神经元中表达较少。尽管GAD65在鼠β细胞中表达水平极低,但已经足够导致GAD65特异性CD8+T细胞克隆迅速摧毁NOD/SCID鼠的β细胞。GAD在组织的低表达可能是由于较少的阴性选择,使得自身免疫前的NOD小鼠中存在大量高亲和力的未活化GAD65-反应性 T细胞。未活化抗原特异性T细胞群的大小和活性在很大程度上决定了抗原调节应答的能力。
疾病发展的阶段
尽管在NOD鼠早期阶段给予ABTs十分有效,但随着自身免疫病程进展,其有效性降低。外来抗原和非β细胞自身抗原在NOD小鼠中诱导免疫应答的能力不受疾病进程的影响(图1A)。与之相反,对于所有β- CAAs及包含β- CAAs抗原决定簇的肽段,其原有的Th2免疫及扩散能力随病程进展显著降低(图1B)。这种β-CAAs诱导调节应答能力的衰减,有可能反映了未活化β- CAA反应性T细胞进行性招募到病理性应答中而降低了被ABT预处理的同源幼稚T细胞有效性。
NOD小鼠发展为轻度高血糖症后,ABTs对于减慢疾病进程的作用微乎其微。NOD小鼠通常在1~2周内从轻度进展至重度高血糖症,而ABTs需10~14天方能诱导针对给予的β-CAA最大免疫应答,调节性T细胞对于扩展至其他β- CAAs的应答则需要更长的时间。当ABT诱导的调节应答达峰值时,残留的β细胞群已不足。与此相反,抗CD3及其它系统性免疫抑制剂可迅速起效,能在新发糖尿病的NOD小鼠中逆转高血糖症。即使用抗CD3治疗NOD小鼠,其血糖水平超过400 mg/dl之前有效。这意味着足够的残存β细胞是治疗有效的基础,此结论来自抗CD3和GAD疫苗的临床试验结果。
尽管ABTs并不能有效逆转NOD小鼠的高血糖症,但ABTs可延长NOD小鼠同系胰岛移植物的存活,这表明ABTs能诱导1型糖尿病起病后的潜在性调节应答。在这些研究中,给予了患糖尿病的NOD小鼠ABT,且持续用胰岛素治疗,数周后再移植同系胰岛,从而为诱导调节性应答争取了充足的时间。GAD而非胰岛素β链或HSPp277的疫苗能延长胰岛移植物的存活。这可能反映了GAD具有较大的体积,众多的免疫原性决定簇及在NOD小鼠疾病晚期更好的免疫原性。此外,ABT介导的CD4+CD25+T调节细胞反应大小是一个重要因素。这些发现提示在疾病晚期,调节性应答可能是经拥有大量可供启动的未分化同源T细胞池的靶组织抗原而得到最好的筛选。
被识别与被忽略的β细胞抗原
ABTs着眼于给予自身抗原本身。但由于β-CAAs预备免疫应答的能力随疾病进程减弱,而从未参与至自身免疫过程中的β细胞抗原基于其免疫原性,能在晚期病程的NOD小鼠中更有效地预防疾病(图1-3)。但是ABTs诱导的这种新自身免疫或许有不可预料的危险。同样,包含β-CAA目标决定簇的合成肽其免疫原性也变弱,但位于同一β- CAA内被自身免疫过程所忽略的决定簇,其免疫原性并未受到疾病进程的影响(图1C)。由于完全隐藏的决定簇很少从整体抗原中递呈出来且其对T细胞分泌的影响性小,因此,通过使用含决定簇的合成多肽(其可绕开整个抗原过程)治疗,使病程后期有可供使用的大量同源T细胞。
对12周龄的NOD小鼠接种完全隐藏决定簇的疫苗,可产生更强的调节性T细胞应答,且能比接种β- CAAs主要目标决定簇疫苗更有效的预防1型糖尿病(图1和图2)。被识别和被忽略抗原决定簇的免疫原性,诱导的Th2应答幅度均与其预防NOD小鼠1型糖尿病发生的能力正相关(图3)。这些观察结果提示将较大抗原片段化(如通过肽链内切酶或使用一系列合成多肽)可能暴露大量隐藏决定簇且能比整体自身抗原预备更多调节性应答。诱导对完全隐藏β- CAA决定簇的调节性应答可能是较安全的,因为:1)调节性自身反应性扩散如经典ABTs之后一样,仅在β-CAA目标决定簇间发生。2) 由于同源T细胞在活体中并未活化,此诱导较难促进病理性T细胞应答。在肿瘤疫苗领域,使用隐藏决定簇进行免疫,在小鼠中能比显性肿瘤抗原决定簇诱导出更多更高亲和力的T细胞应答,使用隐藏肿瘤抗原决定簇的临床试验正在进行。
先前的免疫史影响后续免疫反应
先前存在于小鼠中的Th1应答能修饰Th2促进佐剂中其他靶抗原的后续免疫反应。这种调整可能是由第一轮效应和记忆细胞或APCs培育的细胞因子所致。儿童注射芽孢杆菌卡介苗疫苗能降低过敏性疾病发病率,提示个体先前的免疫应答影响后续反应。有趣的是,接种GAD/明矾(GAD/alum)疫苗(20 μg)并不增加缓慢进展型1型糖尿病——LADA患者的GAD自身抗体(表1),但可大量增加新发糖尿病患儿的GAD自身抗体,这提示自身免疫反应的进展性影响对ABT的免疫应答(见下)。若先前存在的自身免疫反应可调节ABT诱导的应答,则其可用于减少先于ABT的病理性应答,共同管理有助于增强调节应答诱导的因子(如细胞因子),优化ABT在自身免疫过程不同阶段的剂量和频率。
ABT的剂量和途径
皮下给予可溶性自身抗原通常只能产生微弱的免疫原性,但重复治疗能很好的调节应答。粘膜给药途径证实产生了调节性应答。吸入抗原诱导调节性T细胞应答比口服抗原更为有效。诱导较强自身抗原应答的最有效方法是将其加入佐剂中。加入佐剂的免疫原提供的抗原作用持久,且能促进活体耐受性T细胞和APCs长期存在于活体中。然而,更强烈的免疫应答本身具有诱导更多不希望发生的应答的危险。
表达β- CAA 的DNA载体是稳定的且能共运载其他基因编码的免疫调节蛋白。因DNA中结合Toll样受体的二核苷酸(CpG)基序起促炎佐剂的作用,免疫调节基因的共运载可能为推动功能性显性调节应答所必需。
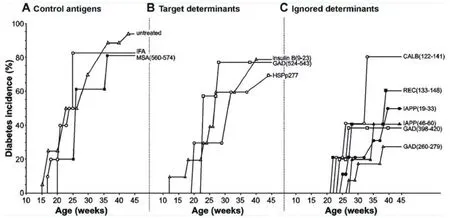
图2 使用对照(A), 靶抗原(B)或忽略抗原(C)免疫后的NOD小鼠中1型糖尿病发生率
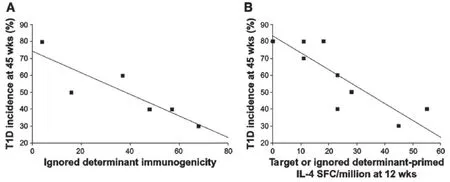
图3 β- CAA可供NOD小鼠应答的能力与治疗效能的关系

表1 词汇表
ABT的剂量和使用频率对人类进行中的自身免疫的效果仅刚刚开始研究,其仍然是发展ABTs的瓶颈所在。我们假设ABTs能唤起包括诱导调节性T细胞,推进病理性应答,致使T细胞衰竭、无能乃至删除的混合性免疫应答。这些应答的程度可能依赖于治疗的剂量、途径和频率。ABT所引起的混合性应答也许能解释为何口服不同胰岛素剂量,在新发1型糖尿病患者的小范围临床试验中其结果多变,为何LADA患者使用GAD/明矾疫苗,其收益只限于特定的剂量,且并不表现出剂量依赖性,以及为何用GAD/明矾治疗新发1型糖尿病患者,细胞因子对GAD的应答表现出明显的多样化(如下)。
被动耐受
ABTs能通过降低或消除T细胞反应而诱导被动耐受。在转基因动物中,亦可通过抑制自身抗原表达或消除自身抗原的目标决定簇而诱导被动耐受。胰岛素和GAD的被动耐受能预防NOD小鼠胰岛炎和1型糖尿病的发展。这些观察结果可能初步明确了β细胞自身抗原或表明自身反应性是自身免疫应答所必需的驱动剂,若缺乏,其他的幼稚自身免疫反应性将被活化诱导为细胞死亡或调节。大部分对GAD被动耐受的转基因NOD小鼠,起初T细胞对其他β- CAAs的应答有显著的降低,表明早期T细胞自身反应性需要相互支持才能扩展(J.T.,D.L.K.,未发表数据)。随着小鼠长大,它们对其他β- CAAs具超常的T细胞应答,如此以致疾病的发生率并不能降低。降低或消除许多GAD反应性T细胞效应将使其他β- CAA反应性T细胞最终扩大到极限,这可能是由于降低了APCs的竞争或在靶组织中有恒定增殖所导致的。这些发现强调了将原T细胞类型库转化为仅针对单一自身抗原后,自身免疫应答所具的动态特征及潜在的预期外结果。
在人类1型糖尿病中是否存在初始抗原尚不清楚。中枢和外周诱导机制仅能使T细胞和β-CAAs在亚活化阈值时发生相互作用。理论上,当抗原递呈因胰岛重塑、代谢需要或局部炎症受到干扰时,之前和活化阈值之下同源β- CAAs相互作用的T细胞(对多数β- CAAs有反应)将得到充分的刺激以激活和扩展,这将引发多种起始抗原的自身耐受。除非已有关键因子T细胞自身反应性,否则在已产生自身免疫的个体中,强制对单个β- CAA的被动耐受将受益甚少。
在缺乏有效刺激信号时给予静脉注射自身抗原是诱导被动耐受的经典模式。然而,由于胸腺中将释放新的幼稚T细胞,因而持续的抗原治疗可能为维持被动耐受所必需。此外,由于T细胞对其他β- CAAs的反应能推动疾病进展,在自身免疫建立后诱导对单个自身抗原被动耐受将很难奏效。因此,理论上自身免疫建立后,诱导长期存在的调节性应答是一种更好的治疗策略。
对有1型糖尿病患病风险患者ABTs的临床试验
糖尿病预防试验(DPT)-1测定是否日常皮下注射胰岛素和每年静脉输注胰岛素能预防患1型糖尿病高风险个体的疾病发生。这种治疗能诱导β细胞休息,但因胰岛素治疗能增加胰岛素自身抗体和诱导Th2应答,其免疫学机制可能仍然被唤起。DPT-1对1型糖尿病的发生率没有效果。由于这种治疗并没有改变主要的胰岛素自身抗体(IAA)水平,其免疫学效益值得质疑。另一方面,DPT-1发现口服胰岛素治疗并无总体效果,但能延迟高IAA亚群的1型糖尿病发病。理解此亚群中的治疗收益也许能帮助设计更多有效的ABTs。导致缺乏总体效果的原因可能包括:未达最适剂量、免疫原降解、因给药途径免疫原性减弱及同时诱导了调节性和病理性应答。
1型糖尿病的预测和预防研究发现日常鼻内胰岛素治疗不能预防或延缓糖尿病的发生,即使在自身抗体上升早期就开始治疗亦无效。未发现任何与治疗相关的β细胞反应性抗体改变。与此相反,鼻内胰岛素试验显示:对患1型糖尿病高风险个体应用鼻内胰岛素,增加了抗体且降低了T细胞对胰岛素的应答,后续的临床试验尚在进行中。总之,这些早期的预防研究证实了其安全性,但是产生了关于免疫学影响、抗原递送的最佳模式及抗原剂量的一些新问题。
近期起病的1型糖尿病患者的ABTs干预试验
疾病的预防优于在疾病发生之后的干预,但需要对有1型糖尿病危险因素的个体进行筛选,并冒着加剧疾病进展的风险。人们更倾向于干预试验,因为潜在受试者可被迅速的确定而且治疗的有效程度可在更短的时限评估。在1型糖尿病发病后保护残余的β细胞功能可以预防或延缓长期的并发症。
基于胰岛素的干预试验
已有四个口服胰岛素的临床试验和一个在新发糖尿病患者中注射B链多肽被改变的胰岛素(NBI-6024,皮下注射)的试验。大部分研究没有发现对残余β细胞有保护效果并且对β- CAAs的自身抗体也没有出现试验相关的改变。一个研究发现在某小群患者中血浆C肽的水平下降得更慢。尽管如此,有2项研究发现在口服胰岛素疗法的小群患者中基础C肽有更快下降的趋势,这提高了人们对此疗法在某些情况下可加速疾病进展的关注。在其他研究中,真皮内低剂量(30μg)(非大剂量[300μg])的可溶性DR4限制的胰岛素原多肽可在1型糖尿病长期患者中诱导短暂的白介素-10分泌型的T细胞反应。
应用HSPp277的干预试验
目前已有数个以HSPp277多肽为辅剂(Diapep)的接种疫苗的临床试验,这将诱导IL-10(主导型)、IL-4和IL-13抗原特异性反应。这些研究中大多数都报道了积极的结果。在治疗前有更高的IL-10的个体对治疗的反应更好。与此研究的结果类似,另一项研究发现在新发的1型糖尿病患者中体内IL-10高者更有可能经历蜜月期。这些研究结果提示,个体获得调节反应的倾向和(或)预先存在的免疫反应可能会影响ABT诱导的反应。
GAD/明矾疫苗在LADA和新发1型糖尿病中的使用
GAD/明矾疫苗的临床试验首先在LADA(一种缓慢进展的1型糖尿病)个体中进行(表1)。受试者给以安慰剂或GAD/明矾(4, 20, 100,或500 μg)皮下注射,两次。仅当使用500 μg剂量时提高了GAD自身抗体水平。6个月后,CD4+CD25+/CD4+CD25-细胞比例和血清C肽水平仅在20μg剂量组中较基线水平有所增加。显然,对LADA患者ABT能产生有益的免疫调节作用,且体液应答不因使用抗原而改变。5年随访研究没有发现显著的研究相关不良反应,且仅在使用20μg剂量组中C肽水平明显升高。若能被证实,这种治疗有希望为LADA患者提供一种安全的长期治疗来保护β细胞功能。
20μg而非其他剂量具有显著效果的潜在机理目前尚不明确。许多低剂量抗原通过启动调节性应答常常可诱导耐受。高剂量抗原/佐剂通过耗竭特异性T细胞常常可诱导耐受,但因某些抗原从佐剂中逸出,直接活化记忆B细胞而促进了体液应答,这解释了为何高剂量GAD/明矾不仅无效且增加了GAD自身抗体。另一种解释是,各剂量的GAD/明矾唤起了免疫应答的不同混合(即调节性应答,促进病理性应答,耗竭,无能和删除)。20μg剂量可能诱导了有益/病理性应答的最佳比例,从而产生了功能性耐受。与安慰剂治疗对照组的PBMCs相比,经GAD/明矾治疗后1型糖尿病受试者的PBMCs可分泌更高水平对GAD有反应的多种细胞因子,这一观察结果支持了治疗可诱导免疫应答混合的观点(如下)。
20μg剂量GAD/明矾的有益效果经后续针对新发糖尿病儿童的大规模临床试验进一步证实。此项研究发现GAD/明矾(20 μg)疫苗能保护起病6个月内即接受治疗的1型糖尿病患者的β细胞功能,但对起病6个月后才接受治疗的1型糖尿病患者无效。对更早诊断的患者,治疗的有效性有可能反映其残存有更多β细胞团。与之相似,在接受抗CD3治疗时,若有很强的残存β细胞功能,治疗将会更有效。即使在15个月以后,治疗也能诱导更高水平的IL-5, IL-10和 IL-13这些GAD特异性应答以及更高频率分泌Foxp3+和TGF-β的T细胞。有趣的是,治疗亦提高了一些针对GAD的促炎细胞因子水平。这些促炎因子可能被增强的调节性应答所中和或参与了调节环路。与LADA研究相对照,GAD/明矾治疗显著提高了新发1型糖尿病患者的GAD自身抗体水平,提示对GAD/明矾疫苗免疫应答差异取决于是否个体有缓慢或更激进的疾病进程。进一步分析显示,有更高起始GAD自身抗体水平的个体对GAD/明矾有最好的应答,这个结果来自一个关于对参与DPT-1时具有高IAA水平个体口服胰岛素产生有利影响的观察报告。
在此研究中,影响个体治疗应答的主要因素是治疗时期,这提示治疗时残存的β细胞团是一个影响GAD/明矾效力的主要因素。在这方面,可能比新发1型糖尿病患者拥有更多β细胞团的LADA患者(即他们尚未有胰岛素依赖),在使用20μg GAD/明矾治疗1年后,其C肽分泌竟然较基线水平有增加,这一点值得注意。重要的是,尽管接受GAD/明矾治疗的新发1型糖尿病患者,其胰岛素分泌逐渐下降,其下降速度与抗CD3治疗后所报道的相似,但GAD/明矾疗法并无显著的副作用。基于以上原因及GAD/明矾制品的相对稳定性,这种治疗在发展中国家很适于应用。
ABTs的安全性
大量的动物模型证实ABTs可致潜在的有害影响。例如,当新生的NOD小鼠用任何β-CAA 的IFA免疫后,四周龄时即可对给予的β- CAA产生早熟的Th2(主要的)应答和一些Th1应答。因此,尽管在胰岛炎和使用Th2促进佐剂之前处理NOD小鼠,ABT促进了针对所注射β- CAA的一些Th1应答。显然,部分或完全活化的Th1细胞对许多不同β- CAAs的反应在发生胰岛炎之前已存在于NOD小鼠中,在增加的自身抗原刺激下,它们将快速扩增至可检测水平。此外,口服胰岛素加重了BB大鼠病情,胰岛素B(9-23)/IFA提高了年长NOD小鼠的同源Th1应答,粘膜自身抗原递呈可预备病理性CD8+T细胞应答,重复给予β- CAA多肽可诱发过敏,Th2细胞能在免疫缺陷的小鼠中诱发疾病,诱导对HSPs的自身免疫可致使摧毁大鼠的视网膜细胞。最后,多数在一种名为“僵人综合征(stiff-person's syndrome)”的罕见神经紊乱疾病,有时在其他罕见的神经变性疾病的个体中,可发现GAD自身免疫性,这引起了对ABTs推动GAD自身免疫性而致神经系统毒害后果的关注。

表2 1型糖尿病使用ABTs未解决的问题
基于迄今所得1型糖尿病的临床试验,一些迹象表明,口服胰岛素可加速新发1型糖尿病患者亚组C肽水平的下降,且依剂量的不同,口服胰岛素可呈有益或有害作用。尽管在大多数1型糖尿病临床试验中,ABT缺乏有益效果被归因于免疫学影响不足,但其同样也反映出ABTs同时诱导有益和病理性应答而且彼此作用相互抵消。由于ABT具加速β细胞损伤的可能性,所以在糖尿病前期人群中推广治疗前,应先检测ABT维持新发1型糖尿病患者残存β细胞团的能力并评估其长期安全性。
治疗效能的标记物
在NOD小鼠ABTs及人类肿瘤疫苗的研究中,发现抗原介导的免疫应答强度及决定簇扩展T细胞应答至其他靶组织抗原的范围均与较好的临床结局相关。目前尚无可反映ABT效能的人类免疫学标记物。急需快速评估候选治疗而非依赖于长期的临床结局。尽管诱导抗原特异性IgG1与诱导调节性Th2应答在小鼠中是相关的,但是这种自身抗体同型的联系在人类中尚不明确。此外,GAD/明矾治疗LADA患者的观察结果提示,体液应答不一定与治疗效能相关。
目前测定人类T细胞应答的数量和功能表型需要许多劳动密集型检测。由于表达于血液中的自身抗原特异性T细胞频率很低,因此,开发能可再生的检测在单个T细胞水平T细胞对多种β- CAAs刺激应答的试验是有价值的。这些检测以及对不同β- CAA特异性抗体亚类的检测有希望使临床试验中ABTs的效能得以评估。此外,成像技术,如核磁共振显像和正电子成像术,增加了非侵入性显示人类胰岛炎和β细胞团的可能性,只是价格昂贵。
未来展望
较免疫抑制疗法,ABTs的优势在于对免疫系统较小的损害,并相对而言在制造、试验和保管上更简便和经济。ABTs临床试验的重点在对1型糖尿病发生后的干预。尽管如此,ABT和系统的免疫调节的临床干预试验都未能到达长期控制正常血糖的目标。因此,人们对联合疗法有着极大的关注,即联用一种免疫调节剂(抗原特异性的或系统性免疫抑制剂)和一种促使β细胞再生的刺激剂。然而,这些疗法还需反复测试,而且永久缓解很难在已经出现自身免疫和β细胞数量大为减少的情况下实现。
长期的目标应该着眼于预防1型糖尿病,理由如下:1)在易感性上,已有极好的基因和自身抗体的标记物,而且1型糖尿病有很长的前驱期;2)在病程的早期微创治疗可能就起效;3)预防比胰岛素疗法和长期并发症的治疗花费更少。加强对β- CAAs的调节反应的ABTs,似乎是对长期具有高危因素人群最有希望和安全的单一疗法。随着预防性治疗变得可能,发明便宜而高效地筛选那些具有1型糖尿病高危因素人群的方法变得十分重要。通过邮寄血液斑点收集卡做自身抗体的检测可以提供高性价比的疾病监控和预防。
今后可深入开展以优化ABTs的研究领域在表2中列出。ABTs在Ⅱ期临床试验中取得的成功产生谨慎的乐观:新的治疗有可能预防1型糖尿病并在1型糖尿病起病后帮助保护β细胞功能。

