与灰葡萄孢致病性相关的真菌毒素及胞外酶
刘莎莎,陈小龙
(浙江工业大学生物与环境工程学院发酵工程研究所,浙江杭州 310032)
灰葡萄孢 (Botrytis cinerea)属于半知菌亚门(Hyphomycetes)丝孢纲 (Deuteromycotina)葡萄孢属,是一种植物病原真菌,宿主达200余种,其中包括重要的经济作物葡萄、番茄、草莓等。在植物的生长期、开花期、结果期及运输储藏期灰葡萄孢都可以感染作物,所以由灰葡萄孢引起的灰霉病被认为是最严重的植物真菌病害之一。每年都有关于灰葡萄孢感染新的作物品种的相关报道,在环境适宜的条件下,特别是温室培养,灰霉病会大面积爆发,带来严重的经济损失[1-3]。
目前抗灰霉病的方法主要集中在化学防治和生物防治2方面[4],我国防治灰霉病使用的药剂主要包括苯丙咪唑类 (如多菌灵),二甲酰亚胺类 (如速克灵)和氨基甲酸酯类 (如乙霉威)杀菌剂,国外也有一些通过控制作物栽培气候条件和培养抗灰葡萄孢植株来抵抗灰霉病的相关报道[5-7]。由于化学防治容易产生抗性,生物防治和其它举措还没有特别行之有效的方法[8-10],所以找到对灰霉病有特效的杀真菌剂是全世界范围内急需解决的难题。
灰葡萄孢在进入植物组织之前先杀死细胞,然后吸取植物的营养,这个过程中灰葡萄孢会分泌多种有毒的代谢产物和胞外酶。目前国内外对灰葡萄孢致病机理研究的重点都集中在这些致病因子的合成途径以及作用方式。
1 灰葡萄孢毒素
灰葡萄孢毒素成分种类很多,国外已分离出将近20种化合物,这些毒素中最为关键的是二环倍半萜烯botrydial和高取代内酯 botcinolide,其它鉴定出结构的毒素都为这2种物质的前体或衍生物,毒性相对较低。
botrydial最早在1974年被分离鉴定出来,botcinolide最早在1993年被分离鉴定出来,它们的结构式如图1所示[11-12]。所有已经分离鉴定出的灰葡萄孢毒素中,botrydial的毒性最高,活体实验结果表明,灰葡萄孢分泌botrydial越多,其对宿主细胞表现出的毒力就越高[13]。目前国内外的研究都集中在botrydial的致病机理以及生物合成途径方面。
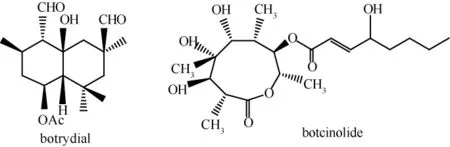
图1 botrydial和botcinolide的化学结构式
1.1 botrydial和以灰霉二醛为骨架的化合物
很多丝状真菌的毒力都是萜类化合物引起的,这些化合物帮助植物真菌突破宿主的细胞防御。botrydial是非特异性毒素,可以作用于不同作物和基因型,正是因为这样灰霉病才能引发大面积的植物病害。Isidro等人发现,被灰葡萄孢侵染的宿主植物出现伤口后,植物组织细胞中就可以检测到botrydial,但植物本身并不能分泌这种化合物。随着植物叶片上萎黄程度增高,检测到botrydial的量也增加,所以灰葡萄孢分泌的二环倍半萜类毒素被认为是灰霉病致病的关键因素,这些毒素可以引发宿主植物萎黄病和组织细胞破裂[14]。Colmenares等[15]发现,botrydial的活性具有光依赖性,光照条件下botrydial引发宿主产生病斑的能力比黑暗条件下高出1倍,但其机理还未阐明。
灰葡萄孢在液体培养时除了会产生botrydial外,发酵液中还发现了大量以灰霉二醛为骨架的二环倍半萜类毒素,这些含灰霉二醛骨架化合物的生物活性存在一定差异。通过比较后发现,这些化合物的生物活性与灰霉二醛骨架结构上C-10和C-15原子的氧化态以及C-9上的羟基有直接关系[16]。
1.2 botrydial的生物合成途径和相关基因
了解botrydial及其相关化合物的合成途径对灰霉病致病性的研究具有重大意义。最近,合成botrydial的基因簇及其编码的蛋白序列已经鉴定出来,5个合成botrydial基因簇的开放阅读框及功能如图2所示[17]。BcBOT2负责编码的蛋白是1种倍半萜合酶,将FPP(法呢基焦磷酸)环化生成关键的中间产物 PSP(presilphiperfolan-8βol),随后PSP在3种单加氧酶细胞色素 P450(BcBOT3,BcBOT1,BcBOT4编码)和乙酰转移酶 (BcBOT5编码)的作用下生成 botrydial。botrydial的生物合成途径如图 3 所示[18]。

图2 合成botrydial基因簇的开放阅读框及功能

图3 botrydial的生物合成途径
在5个基因簇中,最重要的是1.2 kb的BcBOT2基因,它负责编码倍半萜合酶,此酶是botrydial合成途径中的关键酶。敲除BcBOT2基因的灰葡萄孢菌株失去了合成botrydial和相关化合物的能力,菌株毒力基本丧失[18]。PSP转化成botrydial的过程中涉及到多种以灰霉二醛为骨架的化合物,这些化合物在整个途径中起到中间体的作用。
1.3 灰葡萄孢毒素的应用
灰葡萄孢产生的毒素会引发植物枯萎死亡,特别是大部分双子叶植物。botrydial在1.0 μg·mL-1的浓度下就可以使植物叶片表现典型的症状,botcinolide在浓度为10-3mol·L-1时对某些单子叶和双子叶植物就有很强的抑制或杀除作用,但这2种化合物及其相关化合物对小鼠的毒性都不高[13],所以灰葡萄孢毒素可以作为生物除草剂进行开发利用,国内外对灰葡萄孢毒素的研究也都集中在除草剂方向。Cutler在1995年申请了botcinolide应用为除草剂的专利,郑蒙等[19]对灰葡萄孢发酵液中的除草活性组分进行纯化和结构鉴定,得到有望开发为生物除草剂前体的10-顺-二氢化灰霉二醛。
2 与致病性相关的胞外酶
灰葡萄孢侵染植物组织并导致植物死亡的过程一般从孢子开始,分生孢子成熟后脱落,借气流、雨水传播附着在植物表面,再萌发出芽管形成菌丝。灰葡萄孢突破植物体表面屏障入侵细胞,再将植物组织降解为可供真菌利用的能量,这一整个过程都要依赖胞外酶的协同作用[20]。
2.1 与破坏宿主表面屏障相关的酶
植物表面都有一层起保护作用的表皮,这层表皮由角质和脂肪酸构成,此外许多植物表面还有一层由脂肪醇组成的疏水蜡质层。角质的主要成分是单、双及三羟基脂肪酸,这些羟基脂肪酸通过酯键相互连接。表皮细胞壁的角质化以及角质层和蜡质层的存在使整个植物表面形成坚固的疏水层抵御病原菌的侵害。
灰葡萄孢感染植物从植物表面开始进行,即使宿主表面不存在伤口,灰葡萄孢的孢子也能由植物表皮直接入侵宿主引起发病,但有创口或死亡的植物组织更容易感染灰霉病。这是因为灰葡萄孢入侵宿主表面时能分泌减小宿主表面疏水性并分解蜡质层的蛋白及代谢物,为其它致病因子提供了入口。这些分泌物起到表面活化剂的作用,也就是减小了宿主的表面张力,在此过程中起作用的胞外酶包括了角质酶、丝氨酸酯酶、脂酶和其它非特异性酯酶。表1涵盖了一些协助灰葡萄孢破坏宿主表面屏障的酶和这些酶起到的作用[21-25]。

表1 与灰葡萄孢破坏宿主表面相关的胞外酶及功能
2.2 与利用植物能量相关的酶
灰葡萄孢的孢子穿过植物表面保护层后萌发为菌丝,分泌大量可分解植物组织的胞外酶,这些酶将植物细胞中的多糖降解为可供真菌利用的生物量。植物细胞壁由多种多糖组成,其中主要的组成是纤维素和半纤维素,胞间层则含有大量的果胶质,这个阶段灰葡萄孢产生的与致病性相关的酶主要是纤维素酶、半纤维素酶等细胞壁降解酶和果胶酶。
2.2.1 纤维素酶和半纤维素酶
灰葡萄孢在纤维素的诱导下分泌纤维素水解酶,将植物细胞壁中的纤维素分解为纤维二糖和葡萄糖。体外实验证明,当培养基中加入果胶时纤维素酶的产量会增加,而葡萄糖和纤维二糖则会抑制纤维素酶分泌[26]。灰葡萄孢分泌的纤维素水解酶包括 β-葡萄糖苷酶,1,4-β-D-葡聚糖内切酶和1,4-β-D-葡聚糖外切酶,其中β-葡萄糖苷酶既有胞内酶也有胞外酶,但在灰葡萄孢侵染植物的过程中,只有胞外酶作用于植物细胞,胞内β-葡萄糖苷酶与灰葡萄孢的致病性没有关联[27]。灰葡萄孢的孢子无论是在萌发前还是萌发后都没有检测到纤维素酶的活性,说明纤维素酶只在灰葡萄孢进入宿主后起作用。
植物细胞壁中的半纤维素是由木聚糖和阿拉伯糖组成的,有报道称灰葡萄孢侵染植物后分泌出3种木聚糖酶和1种阿拉伯糖酶[28],其它关于灰葡萄孢分泌半纤维素酶的研究几乎没有。
2.2.2 果胶酶
植物的细胞壁和胞间层中都含有大量的果胶质,在灰葡萄孢侵染植物的过程中会产生多种可以降解果胶的酶,它们在降解果胶的过程中起着不同的作用,协助灰葡萄孢分解果胶的酶及其功能如表2 所示[29-33]。

表2 灰葡萄孢分泌的果胶酶及功能
Movahedi等在经灰葡萄孢侵染后坏死的植物细胞中发现了多外聚半乳糖醛酸酶,果胶裂合酶和果胶酸裂解酶。果胶酸裂解酶在孢子中就存在,但在灰葡萄孢侵染宿主的起始阶段不发挥作用,而多外聚半乳糖醛酸酶在灰葡萄孢侵染宿主的早期就开始发挥作用,黄瓜叶片接种灰葡萄孢9 h后就能检测到多外聚半乳糖醛酸酶。此外,在大豆下胚轴和南瓜果实中都检测到果胶裂合酶和果胶酸裂解酶,而苹果组织中却没有检测它们的酶活。体外实验发现这两种酶在酸性pH下会失活,所以这2种酶在酸性的苹果组织内失活,此外果胶裂合酶还需要Ca2+离子起协同作用[31-33]。
3 展望
灰葡萄孢引起的灰霉病是世界性的重要病害,给农业生产带来了极大危害。几十年来大面积使用化学药剂防治灰霉病带来了严重的后果,抗药性的菌株大量出现,土地污染和水污染都日趋严重。发展靶标性的抗灰霉病药物成为目前研究的热点,靶标性的抗菌剂只作用于目标微生物,而不作用于其它生物,对于保持生态系统的平衡十分有利。
设计靶标性的抗菌剂需要了解病原真菌代谢产物的合成途径以及对植物的作用机理,灰葡萄孢的代谢产物包括酶类、多糖、植物激素、毒素和脂肪酸酯类等,其中酶类、毒素和植物激素是重要的致病因子。致病因子作用于植物是一个复杂的过程,近年来更多的研究由致病因子的作用机制转向编码相关致病因子的基因与合成途径,对这些基因及调控机理的研究必将极大地促进新型抗灰霉病药物的研制和发展。
[1]Garibaldi A.First report of botrytis blight caused by Botrytis cinerea on Chamelaucium uncinatum in Italy [J]. Plant Disease,2009,93(9):968-968.
[2]Zhang M,Tsukiboshi T,Okabe I.First report of Botrytis cinerea causing leaf spot of Aquilegia vulgaris in Japan [J].Plant Disease,2009,93(4):425-425.
[3]Oliveira M,Guerner M J,Mesquita M M,et al.Important phytopathogenic airborne fungal spores in a rural area:incidence of Botrytis Cinerea and Oidium Spp [J].Annals of Agricultural and Environmental Medicine,2009,16(2):197-204.
[4]Long C A,Yuan G.Kloeckera apiculata strain(34-9)to control Botrytiscinereaduringthepre- andpostharvest handling of strawberries[J].Annals of Microbiology,2009,59(1):77-81.
[5]Morandi M A B,Mattos L P V,Santos E R,et al.Influence of application time on the establishment,survival,and ability of Clonostachys rosea to suppress Botrytis cinerea sporulation on rose debris[J].Crop Protection,2008,27(1):77-83.
[6]Chen S C, Liu A R, Wang F H, etal. Combined overexpression of chitinase and defensin genesin transgenic tomato enhances resistance to Botrytis cinerea [J].African Journal of Biotechnology,2009,8(20):5182-5188.
[7]Jeon E H,Chung E S,Lee H Y,et al.Ectopic expression of wild rice OgGRP gene encoding a glycine rich cell wall protein confers resistance to Botrytis cinerea pathogen on Arabidopsis[J].Plant Pathology Journal,2009,25(2):193 -198.
[8]Mercier J,Kong M,Cook F.Prevalence of fungicide resistance in Botrytis cinerea isolates from strawberry fields in California[J].Phytopathology,2009,99(6):84-84.
[9]Rosslenbroich H J,Stuebler D.Botrytis cinerea - history of chemical control and novel fungicides for its management[J].Crop Protection,2000,19(8-10):557-561.
[10]Drobya S,Wisniewski M,Macarisinb D,et al.Twenty years of postharvest biocontrol research:Is it time for a new paradigm[J].Postharvest Biology and Technology,2009,52:137-145.
[11]Culter H G,Jacyno J M,Harwood J S,et al.Botcinolide:A Biologically active natural product from Botrytis cinerea [J].Bioscience,Biotechnology and Biochemist,1993,57(11):1980-1982.
[12]Jacyno J M,Harwood J S,Culter H G,et al.Structure and solution-state conformation of botcinolide,a new biologically active metabolite from the fungus Botrytis cinerea [J].Tetrahedron,1994,50(40):11585-11592.
[13]Rebordinos L,Cantoral J M,Prieto M V,et al.The phytotoxic activity of some metabolites of Botrytis cinerea [J].Phytochemistry,1996,42(2):383-387.
[14]Deighton N, MuckenschnabelI, ColmenaresA J, etal.Botrydial is produced in plant tissues infected by Botrytis cinerea[J].Phytochemistry,2001,57(5):689-692.
[15]Colmenares A J,Aleu J,Duran-Patron R,et al.The putative role ofbotrydialand related metabolites in the infection mechanism of Botrytis cinerea[J]. Journal of Chemical Ecology,2002,28(5):997-1005.
[16]Patron R D,Galan R H,Rebordinos L G,et al.Structure-Activity relationships of new phytotoxie metabolites with the botryane skeleton from Botrytis cinerea [J]. Tetrahedron,1999,55:2389-2400.
[17]Pinedo C,Wang C M,Pradier J M,et al.Sesquiterpene synthase from the botrydial biosynthetic gene cluster of the phytopathogen Botrytis cinerea[J ].Acs Chemical Biology,2008,3(12):791-801.
[18]Wang C M,Hopson R,Lin X,et al.Biosynthesis of the sesquiterpene botrydialin Botrytiscinerea mechanism and stereochemistry of the enzymatic formation of presilphiperfolan-8β - ol[J].Journal of the American Chemical Society,2009,131(24):8360-8361.
[19]郑蒙,徐扩,董金皋.灰葡萄孢BC7-3菌株除草活性组分的纯化与结构鉴定 [J].微生物学报,2008,48(10):1362-1366.
[20]Boulard T,Chave M,Fatnassi H,et al.Botrytis cinerea spore balance of a greenhouse rose crop[J].Agricultural and Forest Meteorology,2008,148(3):504-511.
[21]Commenil P, BelingheriL, Bauw G, etal. Molecular characterization of a lipase induced in Botrytis cinerea by components of grape berry cuticle [J]. Physiological and Molecular Plant Pathology,1999,55(1):37-43.
[22]Reis H, Pfiffi S, Hahn M. Molecular and functional characterization of a secreted lipase from Botrytis cinerea[J].Molecular Plant Pathology,2005,6(3):257-267.
[23]Gindro K,Pezet R.Purification and characterization of a 40.8-kDa cutinase in ungerminated conidia of Botrytis cinerea Pers.Fr[J].Fems Microbiology Letters,1999,171(2):239 -243.
[24]Vankan J A L,Vantklooster J W,Wagemakers C A M,et al.Cutinase A of Botrytis cinerea is expressed,but not essential,during penetration of gerbera and tomato[J].Molecular Plant-Microbe Interactions,1997,10(1):30-38.
[25]Vankan J.License to kill:The role of phytotoxic proteins and pectinases in pathogenicity of Botrytis cinerea [J].Phytopathology,2005,95(6):136.
[26]Touzan A,DonecheB. Production and propertiesofthe cellulase complex of Botrytis cinerea[J].Canadian Journal of Botany-Revue Canadienne De Botanique,1996,74(3):486-491.
[27]Sasaki I,Nagayama,H. Beta - Glucosidase from Botrytis cinerea its relation to the pathogenicity of this fungus[J].Bioscience Biotechnology and Biochemistry,1994,58(4):616-620.
[28]Urbanek H,Zalewska S J.Multiplicity of cell wall degrading glycosidic hydrolases produced by apple infecting Botrytis cinerea[J].Phytopathologische Zeitschrift,1984,110(3):261 -271.
[29]Kars I,McCalman M, WagemakersL, etal. Functional analysis of Botrytis cinerea pectin methylesterase genes by PCR-based targeted mutagenesis:Bcpme1 and Bcpme 2 are dispensable for virulence of strain B05.10[J].Molecular Plant Pathology,2005,6(6):641-652.
[30]Poinssot B, Vandelle E, Bentejac M, et al. The endopolygalacturonase 1 from Botrytis cinerea activates grapevine defense reactions unrelated to its enzymatic activity [J].Molecular Plant Microbe Interactions,2003,6(16):553-564.
[31]Kapat A,Zimand G,Elad Y.Biosynthesis of pathogenicity hydrolytic enzymes by Botrytis cinerea during infection of bean leaves and in vitro[J].Mycological Research,1998,102:1017-1024
[32]Rha E, Park H J, Kim M O, etal. Expression of exopolygalacturonases in Botrytis cinerea [J]. FEMS Microbiology Letters,2001,201:105-109.
[33]Movahedi S,Heale J B.The Roles of aspartic proteinase and endo-pectin lyase enzymes in the primary stages of Infection and pathogenesis of various host tissues by different isolates of Botrytis cinerea Pers Ex Pers[J].Physiological and Molecular Plant Pathology,1990,36(4):303-324.

