骨组织工程的发展趋势
崔福斋 清华大学材料系 (北京 100084)
骨组织工程的发展趋势
崔福斋 清华大学材料系 (北京 100084)
自从提出组织工程的概念以来,组织工程尤其是骨组织工程获得了飞速发展,目前被认为是最快能获实际应用的领域。十余年来随着对骨组织工程三要素(细胞,支架材料,生长因子)认知的加深,其中大量工作围绕支架材料开展。总的来说,支架材料如果按制备方法来分类可以分为两大种类:预设计支架和非预设计支架,本综述分别对其进行了详细介绍。鉴于传统骨组织工程策略中因细胞产品标准在实际中面临的难题,其实际应用等待很长时期.本文同时也列举了近年来提出并得到应用的基于组织工程概念的实用发展策略。
组织工程 骨组织工程 支架材料 临床应用
Abstract:Since concept of tissue engineering was introduced, research in the field of tissue engineering and regenerative medicine has exploded, especially in bone tissue engineering. By the progress of bone tissue engineering during the last two decades, a series of rules for the properties of scaffolds were proposed, scaffold meet the rules were synthesized through various methods. According to the approach of synthesis, scaffolds could be classi field to the designed controlled scaffold and non-designed controlled scaffold, both of which were reviewed in this paper. To bring the concept of bone tissue engineering to the clinic, some proposed strategies were discussed.
Key words:tissue engineering, bone tissue engineering, scaffold, clinic application
0 引言
在世界范围内,由于创伤,肿瘤 和感染等原因造成的骨缺损每年都在折磨着众多的患者。自19世纪以来,人们一直采用骨移植术,通过植入自体骨,异体骨和人工骨替代材料来修复大范围骨缺损。然而这些材料都各自存在着不可忽视的缺陷。这些骨移植材料,分别有来源有限,排异反应,与宿主骨的力学性能不匹配,以及使用寿命等方面的问题,导致它难以达到令人满意的骨修复效果。骨组织工程在这种背景下应运而生,给骨修复带来新的期盼。
1985年生物力学专家Y.C. Fung 向美国科学基金会(NSF)申请建立一个工程研究中心,名称为“活组织工程中心”(Center for Engineering of Living Tissues)[1],然而当局并没有批准他的申请。1993年,Langer和 Vacanti在Science上首次发表了题为“Tissue Engineering”[2]的论文,并提出了组织工程的基本含义:应用工程学和生命科学的基本原理和技术,在体外构建具有生物功能的人工替代物,用于修复组织缺损,替代失去功能或衰竭的组织、器官的部分或全部功能。而骨组织工程就是利用细胞生物学和工程学原理,研究开发修复和改善损伤骨组织形态和功能的生物替代物的一门科学,其发展速度在组织工程领域中是最快的。
骨组织工程基于种子细胞+生长因子+支架材料的概念,其中支架材料一方面作为种子细胞和生长因子的载体将其运送至缺损部位,另一方面还给新骨生长提供支撑的作用,是骨组织工程的关键,同时也是全世界研究力量投入最多的地方。由于组织工程细胞相关标准需长期的论证和安全性验证,近年用自体细胞的组织工程策略备受关注[5]。
1 支架材料需满足的条件
Scott在最近的综述[3]中提出了支架设计的4F准则:形状诉求(Form)、性能诉求(Function)、功能诉求(Formation)和可植入性(Fixation)。形状诉求是指支架材料必须能够完全填充复杂的三维缺陷,并且可以诱导再生组织填充整个缺陷;性能诉求是指支架材料必需拥有相应的性能(主要是力学性能),可以在缺失组织得到修复之前暂时起到缺失组织的作用来满足日常活动的需求;功能诉求是指支架材料能够通过释放生长因子和提供合适的环境来促进组织再生;可植入性指的是支架材料可以在外科手术中植入人体,并起到预期的功效。其中形状诉求是一个三维的几何学问题,可以通过CT(Computed tomography)和MRI(Magnetic resonance)等方法来实现;而可植入性同时是一个几何学和力学要求,支架材料必须可以固定在骨缺陷中,并且提供和适的表面以满足缝合以及固定的需要。这两个要求相对简单,而性能诉求和功能诉求就要复杂得多。
对于骨组织工程中的支架材料来说,性能诉求主要指的是力学性能要求,即支架的力学性能必须与环境组织的力学性能相匹配:太软的支架不足以支撑人体的日常活动需求,而太硬的材料也会带来负面的影响,如骨组织的吸收等。虽然与周围环境中组织的力学性能相匹配可以作为衡量支架材料力学性能是否合格的标准,然而组织的力学性能是相当复杂的。由于天然骨组织的特性,其力学性能并不能简单的定义为强度或模量,因为首先对于不同的骨组织来说模型是截然不同的,包括线性弹性、非线性弹性、粘弹性等;其次即使对于某种特定的骨组织来说通常也需要同时采用许多不同的模型来进行模拟。因此,为了满足力学性能匹配的要求,支架材料必须满足一系列相当复杂的力学要求,同时也必须满足骨的各向异性[4]。除此以外,考虑到支架材料的力学性能会随着降解而缓慢的丧失,一个在植入时满足要求的支架很有可能会在植入一段时间后丧失其应有的支撑能力,从而导致手术的失败。
另一方面支架材料的功能诉求要求其必须能够促进组织的再生,而组织再生的情况会受到三方面因素的影响:(1)材料表面的性状与细胞的相互作用;(2)支架材料对生长因子释放的调控;(3)支架的物质传导作用。20世纪90年代Robert Langer等人就已经研究了调节材料与细胞的相互作用对促进组织再生的效果[6],特别是最近20年来该领域取得了诸多进展。在这段期间,人们通过研究发现磷酸钙表面是具有骨传导功能的,有利于骨沉积[7],此外,Kokubo,Murphy等人也在金属钛和聚合物表面通过生物矿化地方法制备出了骨传导涂层[8~12]。支架的物质传导作用主要是指自体组织在支架内的渗透和扩散作用,以及氧气在支架中的渗透和扩散作用。在自体组织的渗透方面,目前已经有Hollister等人的计算,他们的计算主要针对的是骨组织在支架中的扩散和渗透常数[13~15]。相比较而言,关于支架中氧的传导研究就更加丰富一些,Domm[16]和Malda[17]等人的研究证明环境中较低的氧分压有利于软骨细胞的生存和软骨组织的再生,反之,Utting[18]等人证明较高的氧分压有利于成骨细胞的繁殖。此外,骨髓基质干细胞也受到环境中氧分压的影响,Robins[19]等人发现低的氧分压有利于骨髓基质干细胞分化为软骨细胞,同时D’Ippolito[20]发现低的氧分压对成骨细胞有抑制作用。
尽管人们对合格的骨组织工程支架材料提出了一系列要求,却无法说清楚一个具体的支架需要满足什么样具体的性能指标,这是一个需要将来研究以填补的空白。而要弄清楚这些具体的问题一方面需要弄清楚复杂的天然骨组织的分子水平结构和性能,另一方面需要研究现有支架材料在大型动物模型中的作用。脱细胞技术处理好了,细胞外基质(ECM)支架也是国内外努力的一个重要方向[4]。
人工支架材料从其制造工艺上看可以分为两种:预设计支架(Designed Controlled Scaffold)和非预设计支架(Non-Designed Controlled Scaffold)[3],在本文中将详细介绍这两种支架材料。
2 预设计支架材料
预设计支架顾名思义就是支架的结构和性能在设计阶段决定。而一个满足4F准则的支架通常是有着多变的外形和复杂的微观结构的材料,所以这一阶段通常往往需要经过复杂的计算才能完成。
支架的外形设计相对比较容易,可以由CAD[21~24](Computer-Aided Design)或者 IBD[25~27](Image-Based Design)来进行,但是微观结构的设计就十分复杂。因为支架微观结构的改变必然会同时带来力学性能,渗透性/扩散性的变化,而且一者的增强必然会带来另外一者的减弱[28],于是要达到要求的性能就必须仔细寻找微观结构设计的平衡点。于是如何在这两者之间找到平衡就成了该领域研究的焦点课题。有众多的研究人员通过均一化理论对其进行了计算和模拟[29~33]。Scott[34~37]等人通过求解局域方程得到局域的特征变量,将特征变量与微观结构整合进而得出支架材料的有效性能指标。
与此同时,另外一部分学者采用了非均一化方法对固定微观结构下材料的有效性能指标进行了计算。Anderson和Knoth-Tate[38]采用计算流体力学在软件Fluent的帮助下求解了支架微观孔道内的流体速率。Adachi等人[39]把支架材料的降解和骨组织的再生放在同一个模型中进行考量,得出了预测支架力学性能随时间变化的模型。
通过上述的支架结构设计的方法,Lin等人[37]设计并制造出多孔的钛腰椎融合器,该融合器可以承受正常人体脊柱所承担的应力,并且其性能的各向异性与人体实际情况相吻合(图1)。
对于预设计支架来说,为了保证设计的结构和功能在实际产品中得到完全的体现,只能采取一种制造工艺——喷涂成型,又叫做非固态成型(SFF,Solid Free-Form Fabrication)。所谓喷涂成型是指通过喷涂法一层一层将事先已经设计好的整个三维外形以及内部结构堆积出来,然后通过其他的手段将刚刚成型的支架形状和结构固定,这一过程涉及到喷涂沉积技术、激光聚合技术、激光烧结技术和结构印刷技术等等技术领域。
由于喷涂技术对材料的制约,现在SFF法所使用的材料主要是聚合物,陶瓷,还有聚合物/陶瓷的复合材料。目前已经有很多相关的工作了,例如Langer小组通过甘油和癸二酸缩聚制备出聚甘油癸二酸(PGS,poly(glycerol-sebacate))[40,41],拉伸强度超过0.5MPa,切变模量为0.282MPa,可以承受200%的弹性形变。该支架具有不错的生物相容性,植入体内仅仅会引起微弱的炎症反应,通过表面腐蚀可以再35天的时间内完全降解。无论是力学性能还是降解性能都可以通过调节材料的合成条件来控制。Hutmacher,Teoh[42,44]等人通过熔融沉积成型的方法合成出了PCL和PCL/磷酸三钙(TCP)陶瓷的复合材料。Zein等人制造出PCL的支架材料,空隙率可以在48%和77%之间调节,模量可以在4MPa到77MPa之间调节,屈服强度强度在0.4MPa到3.6MPa之间。Liu[45]等人发明了一种低温喷涂的方法制备出了PLLA/TCP和PLGA/TCP复合材料的支架,孔隙率为74~81%,模量为17~23MPa,屈服强度在0.75MPa到1.4MPa之间。SFF法制备出的支架的孔道直径往往有数百个微米,如Lee等人[46]利用光固化制备的PPF支架具有直径为500~900μm的孔道,孔隙率为30~63%,模量为15~40MPa。另外一个小组中,Lee等人[47]制备出具有300μm直径孔道的PPF支架,模量在200MPa到588MPa之间,极限强度为27~129MPa。

图1 通过多元拓扑优化过程同时设计支架的外型和内部三维孔道结构a)在两个脊椎体之间建立一个宏观的设计区域;b)在设计区域内通过宏观拓扑优化得到满足生理载荷的材料密度分布;c)在满足宏观优化预测的孔隙率基础上进行微观拓扑优化得到具有特定微观多孔结构的坚硬材料;d)通过Boolean 交叉算法将宏观外型和微观孔道结构结合在一起得到最终的产物;e)以金属钛为原料通过微区激光熔融工艺制备得到的实体支架材料。
3 非预设计支架材料
同预设计支架材料不同,非预设计支架材料在制备以前并没有一个具体的性能和结构上的设计,它制备的准则是仿生。人们都试图通过研究天然组织本身来模拟构建适宜的支架结构,Curry在上世纪70年代广泛研究了矿化的生物材料,出版了权威著作“Bone”[48]。基于仿生矿化的原理,清华大学崔福斋组通过自组装方法制备出的纳米晶羟基磷灰石/胶原(nHAC)在成分和结构上都与天然骨组织十分接近[49]。Nature Materials曾发表评论说:他给出实验证明了骨矿化胶原的分级结构理论,开辟了用仿生自组装制造生物材料的新途径[50]。在前人工作的基础上,人们认识到适合骨组织工程的支架材料必须具有良好的生物相容性,适中的力学性能,降解速率与自体骨组织再生速率相匹配,还要有合适的空隙率和孔径。
现阶段常用的骨组织工程支架材料主要有:生物陶瓷,天然高分子和合成高分子,三种材料最典型的代表分别是:羟基磷灰石,壳聚糖和聚乳酸。羟基磷灰石(HA,Ca5(PO4)3(OH))是一种钙—磷基陶瓷,在医学及牙科领域已经应用了20多年。由于它和骨骼中磷灰石的化学成分和晶体结构基本相同,所以在植入人体后可以与人体骨骼结合,并逐渐被自体骨替代,具有良好的生物相容性和骨引导性。壳聚糖又称几丁聚糖是甲壳经过脱乙酰基而得到的一种天然阳离子多糖,具有良好的生物相容性,可降解性和成膜性,广泛应用于医药、食品、化工和环保等行业。聚乳酸是一种具有优良的生物相容性和可生物降解的聚合物,经FDA批准用作医用手术缝合线和注射用微胶囊、微球及埋植剂等制剂的材料。
为了制备出具有合适力学强度和孔隙度以及孔径、孔形状的支架材料,人们发展出许多的方法,这些方法都集中在“造孔”上。这些方法包括:溶剂浇铸-粒子沥滤法、气体发泡法、乳液冷冻干燥法、静电纺丝法、和相分离法等。
溶剂浇铸-粒子沥滤法(SCPL,Solvent-casting and particulate leaching)是一种简单且最常用的支架材料制备方法。该方法是将水溶性盐例如氯化钠,柠檬酸钠粒子均匀分散在可生物降解聚合物的溶液中,并将混合溶液浇铸到模具中,在溶剂通过蒸发或冻干被除去后,滤除盐粒子,得到多孔的海绵型支架。气体发泡法(GF,Gas foaming)是将将固体聚合物放入高压气氛中,使气体渗入聚合物块并达到饱和。然后通过热力学不稳定性使气体迅速地从聚合物基体中释放出来,导致气泡在材料内部生成,由此形成多孔支架。乳液冷冻干燥法(EFD,Emulsion freeze drying)是指将由聚合物溶液和水构成的乳液迅速冷冻,然后冷冻干燥除去有机溶剂和水得到多孔支架材料,清华大学崔福斋[51]等人利用EFD法制备出具有良好生物相容性和骨传导性的nHAC/PLA支架材料(图2)。静电纺丝法(Electrospinning)诞生于19世纪,是将聚合物溶液或熔体注射到电场中,使聚合物液滴表而带电,在电场力的作用下被迅速拉伸,同时溶剂挥发,形成纤维。Hong J.H.[52]等人利用该方法制备了直径100nm,比表面积1000m2/g的纤维。相分离法(PS,Phase separation)是先将聚合物溶解在温度较高的溶剂中,然后降低溶液温度使液—液或固—固相分离,通过升华除去富溶剂的一相,得到多孔聚合物支架。
非预设计支架材料往往具有非常精细的内部结构,具有数个微米或是纳米尺度的微观结构,与预设计支架材料的数百微米的孔道结构相比更加有利于细胞的生长和组织的再生。然而,非预设计支架材料的制备过程往往是不能做到完全可控的,因此支架材料的可重复性比较差,难以做到批量生产。
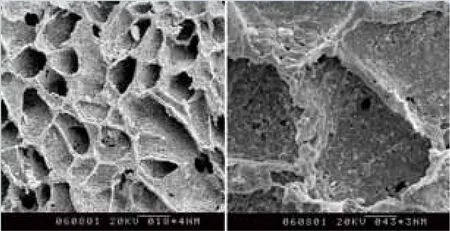
图2 nHAC支架扫面电镜图片
4 骨组织工程临床应用策略
对于骨组织工程而言,无论支架材料如何选择,离进入实际的应用都有着相当长的距离。原因在于,对于种子细胞的来源,储存和运输,还有体外培养等等相关的具体操作事宜上还没有明确的标准,欧盟和FDA正在制定相关的标准,其中欧盟预计需要5年的时间。这也就是说,最少在将来的5年中骨组织工程无法真正的得到临床应用。然而,现阶段的临床应用中仍旧可以使用骨组织工程的概念,并且遵循现有FDA的标准,这些理念更容易得到FDA的批准。
(1) 支架材料+生长因子/药物
BMP2是常用的骨生长因子,Chen等人成功的将BMP2复合在胶原纤维的支架材料中,通过动物实验证明,4到12周以后获得了相当出色的修复效果[53]。Karageorgiou等人通过将BMP2和丝素支架的复合显著的增加了成骨能力[54]。此外,Lee等人将BMP2与纤维蛋白复合并控制BMP2的局部稳定释放,在获得良好成骨效果的同时成功的避免了组织排斥反应[55]。Kamakura等人合成了磷酸八钙支架材料并复合了BMP2在大鼠颅骨模型上获得了成功。除了BMP2之外,常用的骨生长因子还有BMP4。Han等人往大鼠颅骨破损处植入复合了BMP4的支架材料并在8周以后观察到了大量的新骨生成[56]。
(2) 支架材料+自体骨髓细胞/自体血浆
利用自体骨髓细胞和自体血浆代替种子细胞,既可以回避掉种子细胞带来的种种困扰也可以有效地达到组织修复的效果。Bina[57]等人将聚已内酯—磷酸三钙支架材料同富血小板血浆复合,用于骨缺损修复获得了很好的效果。杨新明[58]等人利用浓集自体骨髓基质干细胞和支架材料复合开展了治疗早期股骨头坏死的实验。目前也已经有多例利用字体骨髓基质干细胞复合支架材料治疗颅骨缺损的案例。足日常活动的需要。将预设计支架和非预设计支架的概念结合在一起,以期获得二者的长处避免二者的缺点,获得理想的支架材料。
从生物学角度来说,对细胞与材料相互作用的理解越深刻,在支架材料的设计上才会有更加明确的标准。因此,这方面的研究也应当是一个骨组织工程的关键课题。而且近几年来干细胞越来越多的应用到组织工程领域中,对于干细胞作用和局限性的理解也会帮助支架的设计,并最终有助于组织的再生和修复。
纳米科技的发展也对骨组织工程造成了很大的影响,研究材料在纳米尺寸内的精细结构对细胞在繁殖分化等等方面上的影响也是一个热门课题。在仿生学,支架设计乃至最终的临床应用上都有很大的意义。
5 展望
从现阶段的发展看来,无论是预设计支架还是非预设计支架都各自取得了很大的进展,并且自成一套体系,然而也都各自存在着许多的问题。
对于预设计支架来说,需要更加精密的结构设计来更加精确地满足性能设计提出的要求,单纯的周期性结构并不能真正的反应天然组织的形态。并且现有的预设计支架的孔道结构太过粗糙,不利于细胞增殖和组织再生,需要改进SFF法的精度,需要更加精密的仪器。与此同时目前SFF所用的材料太过单一的现状也亟需改善,开发出更多的生物相容性更好的可以利用SFF法成型的材料用于骨组织工程势所必行。
对于非预设计支架来说,虽然支架材料拥有很精细的微观结构,甚至是“微观—介观—宏观”的多级结构,有利于组织的再生,然而这种支架的可重复性不高。此外,这种支架在力学性能上往往很难完全满
[1] A Proposal to the National Science Foundation for An Engineering Research Center at CSD,CENTER FOR THE ENGINEEING OF LIVING TISSUES,UCSD865023,courtesy of Y.C. Fung,August 23,2001.
[2] R. Langer. Tissue engineering [J]. Science, 1993,260:920-926
[3] S. J. Hollister Scaffold Design and Manufacturing: From Concept to Clinic, Advan Mater, 2009, 21,3330-3342
[4] 卢世璧,组织工程生物材料ECM支架的研究进展,“中国生物材料研究与产业发展现状及趋势“工程科技论坛报告集,2009,中国工程院,P35-73。
[5] 崔福斋,组织工程骨发展趋势,“中国生物材料研究与产业发展现状及趋势“工程科技论坛报告集,2009,中国工程院,P582-614。
[6] L. G. Cima, J. P. Vacanti, C. Vacanti, D. Ingber, D.Mooney, R. Langer, J. Biomech. Eng. 1991, 113, 143.
[7] H. Ohgushi, A. I. Caplan, J. Biomed. Mater. Res. 1999,48,913.
[8] W. L. Murphy, D. J. Mooney, J. Am. Chem. Soc. 2002,124, 1910
[9] W. L. Murphy, M. C. Peters, D. H. Kohn, D. J. Mooney,Biomaterials 2000, 21, 2521.
[10] W. L. Murphy, C. A. Simmons, D. Kaigler, D. J.Mooney, J. Dent. Res. 2004, 83, 204.
[11] T. Kokubo, H. M. Kim, M. Kawashita, Biomaterials 2003, 24, 2161
[12] T. Kokubo, H. M. Kim, M. Kawashita, T. Nakamura, J.Mater. Sci. Mater. Med. 2004, 15, 99
[13] E. A. Sander, E. A. Nauman, Crit. Rev. Biomed. Eng.2003, 31,1.
[14] L. Wang, Y. Wang, Y. Han, S. C. Henderson, R. J.Majeska, S. Weinbaum, M. B. Schaf fl er, Proc. Natl.Acad. Sci. USA 2005, 102, 11911
[15] S. J. Hollister, E. E. Liao, E. N. Mof fi tt, C. G. Jeong, J. M.Kemppainen, in Fundamentals of Tissue Engineering and Regenerative Medicine (Ed: U. Meyer), Springer, Berlin 2009, Ch. 38, pp. 521–537.
[16] C. Domm,M. Schunke, K. Christesen, B.Kurz,Osteoarthritis Cartilage 2002, 10, 13.
[17] J. Malda, C. A. van Blitterswijk, M. van Geffen, D. E.Martens, J. Tramper, J. Riesle, Osteoarthritis Cartilage 2004, 12, 306.
[18] J. C. Utting, S. P. Robins, A. Brandao-Burch, I. R.Orriss, J. Behar, T. R. Arnett, Exp. Cell Res. 2006, 312,1693.
[19] J. C. Robins, N. Akeno, A.Mukherjee, R. R. Dalal, B. J.Aronow, P. Koopman, T. L. Clemens, Bone 2005, 37,313.
[20] G. D’Ippolito, S. Diabira, G. A. Howard, B. A. Roos, P.C. Schiller, Bone 2006, 39, 513.
[21] W. Sun, A. Darling, B. Starly, J. Nam, Biotechnol. Appl.Biochem. 2004, 39, 29.
[22] W. Sun, P. Lal, Comput. Methods Programs Biomed.2002, 67, 85.
[23] W. Sun, B. Starly, A. Darling, C. Gomez, Biotechnol.Appl. Biochem. 2004, 39, 49.
[24] M. A. Wettergreen, B. S. Bucklen, W. Sun, M. A.Liebschner, Ann. Biomed. Eng. 2005, 33, 1333.
[25] S. J. Hollister, R. A. Levy, T.M. Chu, J.W. Halloran, S. E.Feinberg, Int. J. Oral Maxillofac. Surg. 2000, 29, 67.
[26] S. J. Hollister, R. D. Maddox, J. M. Taboas, Biomaterials 2002, 23, 4095.
[27] S. J. Hollister, C. Y. Lin, E. Saito, C. Y. Lin, R. D.Schek, J. M. Taboas, J. M. Williams, B. Partee, C. L.Flanagan, A. Diggs, E. N.Wilke, G. H. Van Lenthe,R. Muller, T. Wirtz, S. Das, S. E. Feinberg, P. H.Krebsbach, Orthod. Craniofac. Res. 2005, 8, 162.
[28] L. V. Gibiansky, S. Torquato, Proc. R. Soc. London Ser.A 1996, 452, 253.
[29] B. Aoubiza, J. M. Crolet, A. Meunier, J. Biomech. 1996,29, 1539.
[30] S. J. Hollister, N. Kikuchi, Biotechnol. Bioeng. 1994, 43, 586.
[31] S. J. Hollister, J. M. Brennan, N. Kikuchi, J. Biomech.1994, 27, 433.
[32] K. May-Newman, A. D. McCulloch, Prog. Biophys. Mol.Biol. 1998, 69, 463.
[33] L. Yin, D. M. Elliott, J. Biomech. 2005, 38, 1674.
[34] S. J. Hollister, Nat. Mater. 2005, 4, 518.
[35] S. J. Hollister, C. Y. Lin, Comput.Methods Appl.Mech.Eng. 2007, 196, 2991
[36] C. Y. Lin, N. Kikuchi, S. J. Hollister, J. Biomech. 2004,37, 623.
[37] C. Y. Lin, C. C. Hsiao, P. Q. Chen, S. J. Hollister, Spine 2004, 29, 1747.
[38] E. J. Anderson, M. L. Knothe-Tate, Tissue Eng. 2007,13, 2525
[39] T. Adachi, Y. Osako, M. Tanaka, M. Hojo, S. J.Hollister, Biomaterials 2006, 27, 3964.
[40] Y. Wang, G. A. Ameer, B. J. Sheppard, R. Langer, Nat.Biotechnol. 2002, 20, 602.
[41] Y. Wang, Y. M. Kim, R. Langer, J. Biomed. Mater. Res.Part A 2003, 66, 192.
[42] D. W. Hutmacher, J. Biomater. Sci. Polym. Ed. 2001, 12,107.
[43] D. W. Hutmacher, T. Schantz, I. Zein, K. W. Ng, S. H.Teoh, K. C. Tan, J. Biomed. Mater. Res. 2001, 55, 203.
[44] I. Zein, D. W. Hutmacher, K. C. Tan, S. H. Teoh,Biomaterials 2002, 23, 1169.
[45] L. Liu, Z. Xiong, Y. Yan, Y. Hu, R. Zhang, S. Wang, J.Biomed. Mater. Res. Part A 2007, 82, 618.
[46] K. W. Lee, S. Wang, B. C. Fox, E. L. Ritman, M. J.Yaszemski, L. Lu, Biomacromolecules 2007, 8, 1077.
[47] J. W. Lee, P. X. Lan, B. Kim, G. Lim, D. W. Cho, J.Biomed. Mater. Res. Part B 2008, 87,1.
[48] J.D. Curry, Bones: structure and mechanics. New Jersey Princeton University Press 2002
[49] W. Zhang, S.S. Liao, F.Z. Cui. Hierarchical selfassembly of nano-fibrils in mineralized collagen.Chemistry of Materials 2003; 15: 3221-3226
[50] Synthetic bone. Nature Materials 2003; 2: 566-566
[51] S.S. Liao, F.Z. Cui, W. Zhang, Q.L. Feng. Hierarchically biomimetic bone scaffold materials: Nano-HA/PLA composite. Journal of Biomedical Materials Research Part B-Applied Biomaterials 2004; 69B: 158-165
[52] J.H. Hong, E.H. Jeong, H.S. Lee, D.H. Baik, S.W. Seo,J.H. Youk. Electrospinning of polyurethane/organically modified motmorillonite nanocomposites. J Polym Sci Part B:Polym Phys., 2005, 43: 3171-3177
[53] Chen B, Lin H, Wang J, Zhao Y, Wang B, Zhao W,Sun W, Dai J. 2007. Homogeneous osteogenesis and bone regeneration by demineralized bone matrix loading with collagen-targeting bone morphogenetic protein-2.Biomaterials 28:1027–1035.
[54] Karageorgiou V, Meinel L, Hofmann S, Malhotra A,Volloch V, Kaplan D. 2004. Bone morphogenetic protein-2 decorated silk fi broin fi lms induce osteogenic differentiation of human bone marrow stromal cells. JBiomed Mater Res A 71:528–537.
[55] Lee TC, Ho JT, Hung KS, Chen WF, Chung YH,Yang YL. 2006. Bone morphogenetic protein gene therapy using a fi brin scaffold for a rabbit spinalfusion experiment. Neurosurgery 58:373–380; discussion 373–380.
[56] Han DK, Kim CS, Jung UW, Chai JK, Choi SH,Kim CK, Cho KS. 2005. Effect of a fibrin-fibronectin sealing system as a carrier for recombinant human bone morphogenetic protein-4 on bone formation in rat calvarial defects. J Periodontol 76:2216–2222.
[57] Rai, B; Oest, ME; Dupont, KM, et al.Combination of platelet-rich plasma with polycaprolactone-tricalcium phosphate scaffolds for segmental bone defect repair JOURNAL OF BIOMEDICAL MATERIALS RESEARCH PART A 卷 : 81A 期 : 4 页 : 888-899出版年: JUN 15 2007
[58] 杨新明,石蔚,杜雅坤,等.浓集自体骨髓基质干细胞组织工程复合物治疗早期股骨头坏死的实验疗效[J].生物骨科材料与临床研究,2008,5(3):1-5
The Development of Bone Tissue Engineering
CUI Fu-zhai Department of Materials Science & Engieering, Tsinghua University (Beijing 100084)
1006-6586(2010)02-0016-07
R318.08
A
2010-01-04
崔福斋,教授,博士生导师
本工作获国家自然科学基金项目50830102资助

