OxLDL诱导人血管内皮细胞及平滑肌细胞DNA加合物生成
杨世明 王 颖陈莉莉
(华中科技大学同济医学院解剖学系组织胚胎学教研室;1华中科技大学同济医学院附属同济医院消化内科;2华中科技大学同济医学院附属同济医院综合内科;湖北武汉,430030)
OxLDL诱导人血管内皮细胞及平滑肌细胞DNA加合物生成
杨世明 王 颖1*陈莉莉2
(华中科技大学同济医学院解剖学系组织胚胎学教研室;1华中科技大学同济医学院附属同济医院消化内科;2华中科技大学同济医学院附属同济医院综合内科;湖北武汉,430030)
目的 探讨oxLDL参与动脉粥样硬化发生的可能机制。方法 培养人血管内皮细胞及平滑肌细胞,以50μg/LoxLDL刺激24、48h后,收获细胞用于后续实验:①免疫组化染色检测DNA加合物εdA水平;②免疫组化方法检测细胞内4-HNE修饰蛋白;③western blot法检测细胞内4-HNE修饰蛋白水平。结果 oxLDL刺激 EC及SMC中DNA加合物εdA水平及4-HNE修饰蛋白水平均较未刺激细胞组明显升高。结论 oxLDL诱导的氧化应激、脂质过氧化反应及其继发的DNA损伤可能为oxLDL参与动脉粥样硬化发生的重要机制。
动脉粥样硬化;氧化低密度脂蛋白;脂质过氧化作用;亚乙烯基-DNA加合物;人内皮细胞和平滑肌细胞
动脉粥样硬化是世界范围内严重威胁人类健康的疾病。许多动脉粥样硬化相关的危险因素已为人们逐渐识别,但其确切发病机制仍远远未被阐明。目前认为参与其发病的细胞类型主要包括有内皮细胞(endothelialcells,EC) 和 平 滑 肌 细 胞(smooth muscle cells,SMC)[1-3]。
脂质代谢的异常,特别是氧化性低密度脂蛋白(oxLDL)诱导 EC功能紊乱和SMC细胞增生[4],被认为是参与动脉粥样硬化发生的重要危险因素[5],然而其机制尚不明了。近年来研究表明, oxLDL可导致细胞氧化应激,引起活性氧分子(ROS)过度生成,继而诱发脂质过氧化反应(LPO),而后者被认为是参与动脉粥样硬化病变的关键机制[6-7]。我们以往的研究曾证实,动脉粥样硬化患者的主动脉内皮细胞内存在LPO相关的DNA损伤[8]。LPO反应产物—反应性醛类化合物4-hydroxy-2-nonenal(4-HNE),不仅能修饰胞浆蛋白形成各分子量的4-HNE蛋白加合物,而且能进入细胞核与DNA碱基作用形成氧化性DNA加合物—1,N6-ethenodeoxyadenosine(εdA),εdA可诱导细胞基因的异常改变,从而引起细胞的异常增生和功能紊乱[9]。
那么oxLDL是否通过诱导EC和SMC的氧化应激及脂质过氧化反应,引起氧化性DNA损伤, DNA加合物εdA生成,从而参与动脉粥样硬化的发生?目前还未见有研究报道。因此,通过εdA半定量检测方法[10],在细胞水平以oxLDL刺激人EC和SMC细胞,并检测细胞内4-HNE蛋白加合物及εdA水平,以初步探讨oxLDL参与动脉粥样硬化发生的机制。
材料和方法
1 材料
胎牛血清(FBS),胰蛋白酶/EDTA,培养基DMEM以及青/链霉素购自Biochrom A G公司(Germany)。蛋白酶K及RNA酶购自Roche公司(Germany)。Tween 20、Triton X-100、小牛血清白蛋白(BSA)等购自 Sigma公司。4-HNE抗体购自 ALEXIS Biochemicals(AXXORA,Germany)。生物素化马抗鼠及羊抗兔IgG,ABC试剂盒(VECTASTAIN Elite ABC kit),和DAB显色试剂盒购 自Merck(Darmstadt,Germany)。εdA特异性抗体EM-A-1由Drs.M.Rajewsky和P.LorenzN(University of Essen,Essen,Germany)惠赠[11]。
2 细胞培养及oxLDL处理
采用脐静脉分离人血管内皮细胞(HUVEC), 50ml PBS冲洗脐静脉后,0.25mg/ml胶原酶B灌注,于37°C孵育20min后,PBS洗,离心10min。沉淀重悬至5ml内皮细胞生长培养基中,接种于25cm2培养皿,常规条件下培养。当细胞生长融合后,以冷PBS洗,胰蛋白酶/EDTA消化。再次离心后,细胞重悬于内皮细胞生长培养基中,接种于75cm2培养皿,传代3-5次后,用于后续实验。
人平滑肌细胞由Dr.Xiaobo Chen(Heidelberg University,Germany)惠赠,常规条件下培养,传代6-8次后用于后续实验。
HUVEC和HVSMC分别以2×104/每孔密度接种于0.2%gelatin包被的玻片,细胞融合后以50μg/mLoxLDL分别刺激24、48h。对照组 HUVEC和 HVSMC细胞以正常血清代替oxLDL。 oxLDL刺激结束后,PBS洗涤,细胞爬片以冷丙酮固定后,供免疫组化染色用。
3 εdA加合物免疫组化染色检测
用免疫组化方法检测HUVEC和HVSMC细胞εdA水平。细胞爬片 PBS洗涤后,0.3% H2O2/甲醇溶液处理10min,以消除内源性过氧化物酶活性,经 ProteinaseK(10μg/ml)室温10min,100μg/ml RNase,37°C孵育 1h,1.5N HCl溶液室温5min后;双蒸水洗,滴加8%BSA +2%马血清+0.05%Tween20+0.05%Triton X-100溶液,室温20min,以封闭非特异性结合位点。鼠抗人εdA抗体EM-A-1(1∶20),4°C过夜。PBS洗后,滴加生物素化马抗鼠 IgG(1∶500),室温孵育1h,ABC作用30min,DAB显色。以正常血清代替一抗作阴性对照。
4 εdA加合物免疫组化染色半定量分析
显微镜下观察结果并获取图像(Leica IM50),以相应图像软件(Image J,Toronto Western Research Institute,U K)计数阳性染色核,εdA表达率用以下公式计算:阳性染色细胞数/总细胞数× 100%。
5 免疫组化染色检测4-HNE蛋白加合物
细胞爬片以 0.3% H2O2/甲醇溶液处理10min,以消除内源性过氧化物酶活性,PBS洗后,加3%正常羊血清,室温20min,以封闭非特异性结合位点。兔抗人4-HNE抗体(1∶500)室温孵育2h,PBS洗后,滴加生物素化羊抗兔IgG(1∶1000),室温孵育 30min,ABC作用 30min后, DAB显色。以正常血清代替一抗作阴性对照。
6 Western blot检测4-HNE修饰蛋白
采用western blot方法检测各组 EC及 SMC细胞4-HNE修饰蛋白以反应细胞4-HNE水平,上述oxLDL刺激组及对照HUVEC和HVSMC细胞分别提取蛋白质后,以50μg/每孔上样,10%聚丙烯酰胺凝胶电泳后,电转至硝酸纤维素膜,以脱脂奶粉封闭1h,加兔抗人 HNE多克隆抗体(1∶1000),40C过夜,含 0.2%TweenPBS溶液(PBST)清洗3次,HRP标记羊抗兔 IgG(1∶2000)室温孵育1h,PBST洗后,ECL显色。根据Marker确定不同分子量4-HNE修饰蛋白,以β-action作为内参照。
7 统计学分析
所有数据以平均值±SD表示,采用t检验,P值小于0.05具有统计学意义。
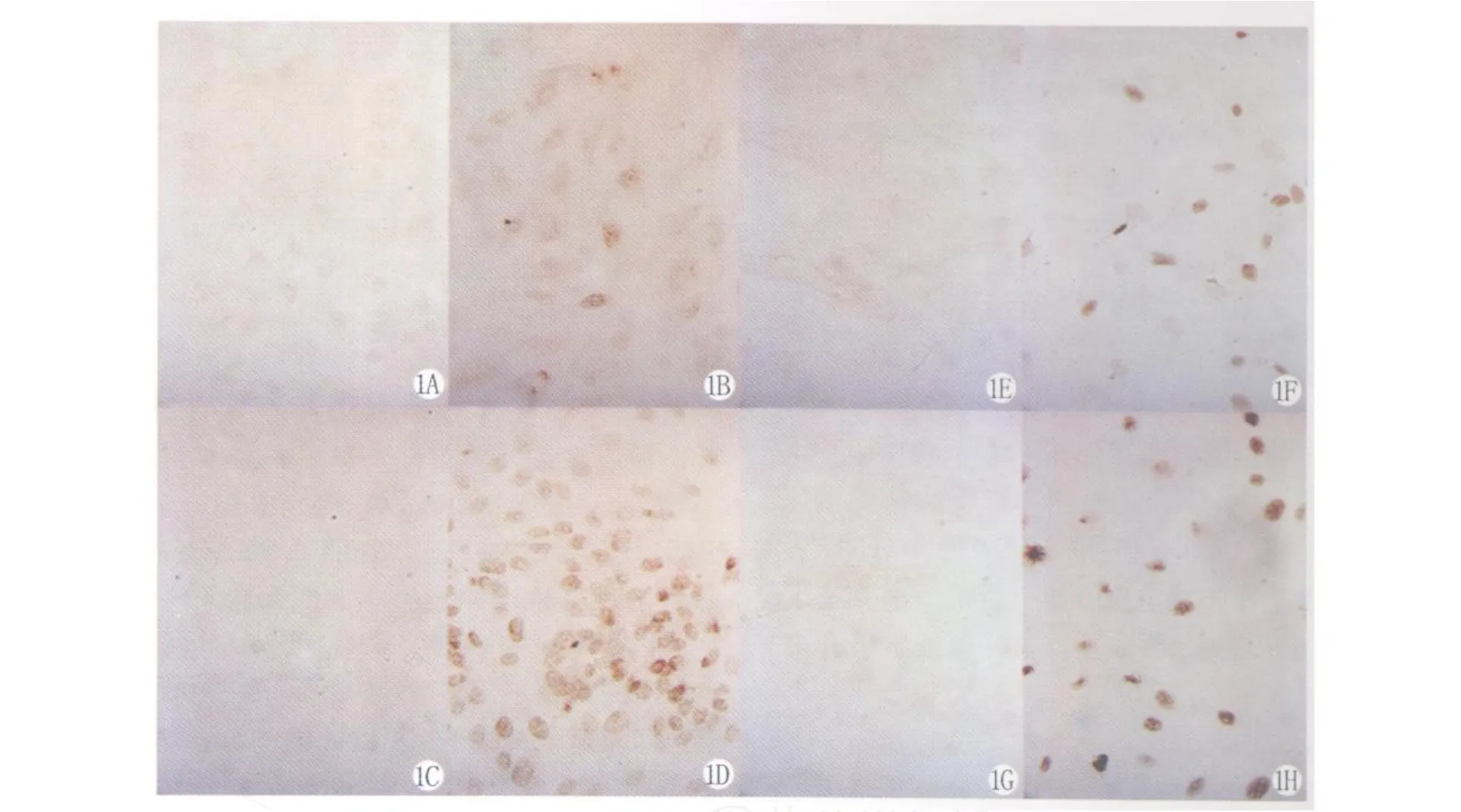
图1 A-H免疫组化显示EC(A-D)和SMC(E-H)中εdA阳性染色×400。未刺激细胞中未见有εdA阳性染色,ox-LDL(50μg/mL)刺激可诱导EC和SMC细胞中εdA生成明显增加。A:对照组EC(24h);B:oxLDL刺激EC(24h),C:对照组EC(48h);D:oxLDL刺激 EC(48h);E:对照组SMC(24h);F:oxLDL刺激SMC(24h);G:对照组SMC(48h);H:oxLDL刺激SMC(48h)。Fig1.A-H micrographs(40×)of immunohistochemically stained sections of EC(A-D)and SMC(E-H) ×400.Untreated control cells lack staining forεdA,while oxLDL(50μg/mL)stimulation after 24h and 48h lead to increased staining for DNA adducts in nuclei of EC and SMC.A:Control EC(24h);B:oxLDLstimulated EC(24h),C:Control EC(48h);D:oxLDLstimulated EC(48h);E:Control SMC(24h);F:oxLDLstimulated EC(48h);G:Control SMC(48h);H:oxLDLstimulated SMC(48h).
结 果
1 oxLDL可诱导EC和SMC细胞中εdA形成
与未刺激EC细胞相比,oxLDL刺激后EC细胞组εdA水平显著上升(图1 A-D),刺激24h后εdA水平可达10.29±1.61 Units(P=0.008), 48hεdA水平可达25.71±1.47 Units(P=0.001)。
oxLDL刺激组SMC细胞εdA水平亦明显高于未刺激SMC细胞(图1 E-H),刺激24h后εdA水平达25.36±3.29 Units(P=0.006),48h后εdA水平可达44.08±4.10 Units(P=0.003)。
2 oxLDL刺激EC和SMC细胞中4-HNE蛋白加合物形成
4-HNE可修饰蛋白质形成4-HNE蛋白加合物,我们采用免疫组化染色和western blot方法检测oxLDL刺激后 EC(图2 A,B)和SMC细胞(图2 C,D)中4-HNE蛋白加合物形成,以反映细胞脂质过氧化状态及4-HNE水平。

图2 A-D免疫组化染色显示EC(A,B)和SMC(C,D)内4-HNE蛋白加合物形成 ×400。未刺激细胞胞浆内未见4-HNE蛋白加合物阳性染色,而oxLDL刺激24h的EC及SMC细胞胞浆内可见有明显的4-HNE蛋白加合物形成。A:对照组EC;B:oxLDL刺激EC;C:对照组SMC;D:oxLDL刺激SMC。Fig.2 A-D Immunohistochemical detection of 4-HNE modified proteins in EC(A,B)and in SMC(C,D)in the cytoplasm,×400.Untreated control cells show no brown staining while oxLDL-stimulation for 24h lead to positive staining for 4-HNE adducted proteins in the cytoplasm.A:Control EC(24h),B:oxLDLstimulated EC(24h), C:Control SMC(24h);D:oxLDLstimulated SMC(24h).
Western blot检测亦发现在oxLDL刺激的EC细胞内可有多个4-HNE蛋白加合物阳性条带形成(图3A),以37.4 KDa和63.8KDa处4-HNE蛋白加合物的水平作相对定量分析(目的蛋白光密度/内参照β-action光密度),其较未处理细胞组升高5倍(图4A)。
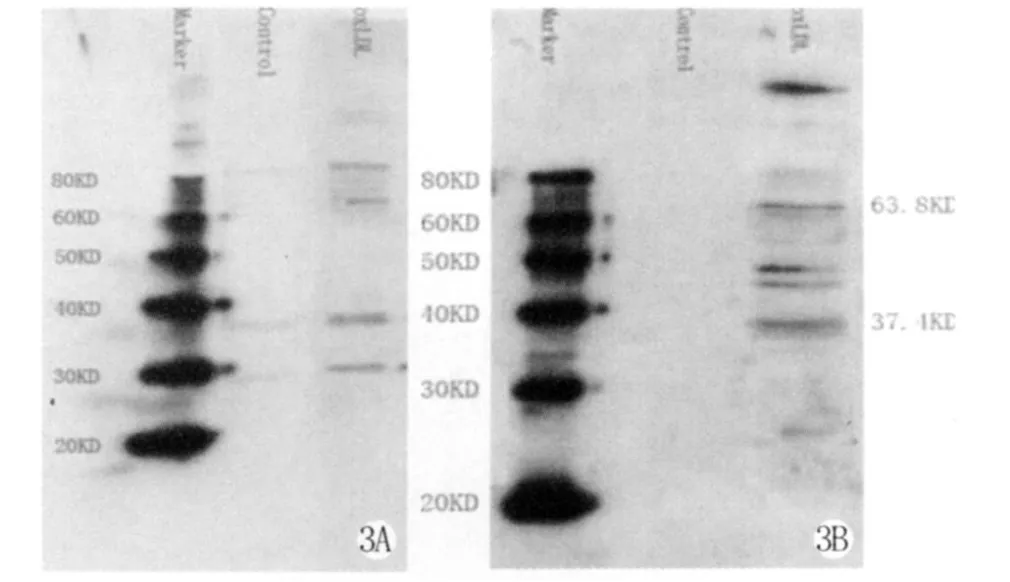
图3 A,B Western blot显示oxLDL刺激 EC(A)、SMC(B)细胞内4-HNE蛋白加合物的阳性条带。Fig.3 A,B Western blot of 4-HNE-adducted proteins in EC(A)and SMC(B)after stimulation by oxLDLfor 24 h is performed using an anti-4-HNE primary antibody with a peroxidase conjugated secondary antibody.Bands a detected by chemiluminescence.
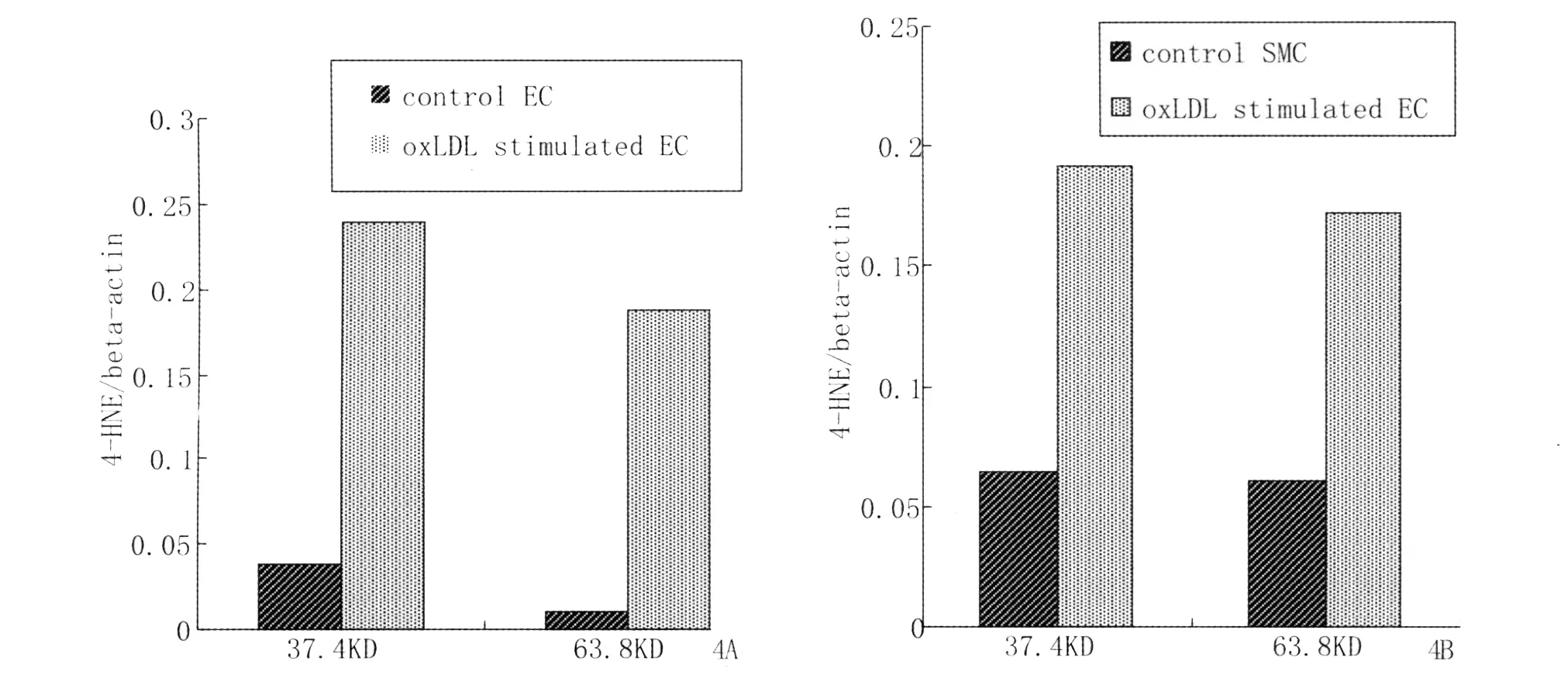
图4 A,B直方图显示在37.4和63.8 KD处,oxLDL刺激EC(A)and SMC(B)细胞4-HNE蛋白加合物水平较未处理细胞明显升高。Fig.4 A,B Histograms of individual densitometry results for EC(A)and SMC(B)treated with oxLDLfor 24 h.Densitometry is performed on the 37.4 and 63.8 KD bands and plotted as the ratio of 4-HNE-modified protein/beta-actin bands.The histograms are representative blots from three experiments+/-SD.
在oxLDL刺激的SMC内,也可见到明显的4-HNE蛋白加合物阳性条带(图 3B),以 37.4 KDa和63.8KDa处4-HNE蛋白加合物的水平作相对定量分析(目的蛋白光密度/内参照β-action光密度),较未处理细胞组升高3倍(图4B)。
讨 论
越来越多的证据显示,氧化应激,ROS的过度形成及继发的LPO是引起血管内皮细胞和平滑肌细胞功能紊乱的重要因素,其可能为参与动脉粥样硬化发生的关键机制之一[12]。
有研究显示人动脉粥样硬化斑块中检测LPO来源的 DNA加合物εdA和εdC,水平明显升高[8]。DNA加合物是一类高度致突变物质,可在哺乳动物细胞引起基因的点突变[13],而有研究显示在动脉粥样硬化动物模型中,LPO来源的DNA加合物是氧化应激诱导的DNA损伤的标志[14]。这些结果在一定程度上支持动脉粥样硬化斑块为单个突变SMC细胞异常增殖形成的“肿瘤性病变”学说[15]。
oxLDL是近年来发现的致动脉粥样硬化的重要危险因素,可能参与其发生的早期事件。以往研究认为oxLDL促炎性反应及细胞毒作用可能是其参与动脉粥样硬化发生的主要机制,然而近年来的研究显示oxLDL亦可诱导EC和SMC细胞氧化应激,ROS过度生成、脂质过氧化反应[6,7,16]。
为了阐明oxLDL参与动脉粥样硬化发病的机制,我们利用oxLDL处理EC和SMC细胞,检测并分析细胞内oxLDL诱导LPO源性DNA加合物(εdA)和蛋白加合物的水平。oxLDL刺激的 EC和SMC细胞内εdA及4-HNE修饰蛋白的水平明显升高,提示oxLDL通过氧化应激,诱导脂质过氧化反应,导致εdA水平升高可能为其参与动脉粥样硬化发生的机制之一。
oxLDL诱导细胞DNA损伤的机制仍有待于进一步阐明,但目前推测ROS,LPO及4-HNE可能为重要因素[17]。据报道,oxLDL可诱导培养内皮细胞4-HNE水平明显上升[7],另有研究表明,以oxLDL刺激APOE鼠后,可使动脉粥样硬化斑块内4-HNE蛋白—PDGF beta含量明显增加[16]。我们的研究结果显示,oxLDL可诱导EC及SMC细胞脂质过氧化反应,继而导致4-HNE修饰蛋白及DNA加合物εdA生成和积聚,若不能及时被机体清除,可进一步诱发EC及SMC细胞基因突变,引起细胞的异常增殖和功能紊乱,其可能为ox-LDL参与动脉粥样硬化发生的重要机制之一。
[1]Newby AC.An overview of the vascular response to injury:a tribute to the late Russell Ross.Toxicol Lett, 2000,112-113:519-529
[2]Bonetti PO,Lerman LO,Lerman A.Endothelial dysfunction:a marker of atherosclerotic risk.Arterioscler Thromb Vasc Biol,2003,23(2):168-175
[3]Doran AC,Meller N,McNamara CA.Role of smooth muscle cells in the initiation and early progression of atherosclerosis.Arterioscler Thromb Vasc Biol,2008, 28(5):812-819
[4]Tsimikas S,Brilakis ES,Miller ER,et al.Oxidized phospholipids,Lp(a)lipoprotein,and coronary artery disease.N Engl J Med,2005,353(1):46-57
[5]Matsuura E,Kobayashi K,Tabuchi M,et al.Oxidative modification of low-density lipoprotein and immune regulation of atherosclerosis.Prog Lipid Res,2006,45(6):466-486
[6]Penn MS,Cui MZ,Winokur AL,et al.Smooth muscle cell surface tissue factor pathway activation by oxidized low-density lipoprotein requires cellular lipid peroxidation.Blood,2000,96(9):3056-3063
[7]Thum T,Borlak J.LOX-1 receptor blockade abrogates oxLDL-induced oxidative DNA damage and prevents activation of the transcriptional repressor Oct-1 in human coronary arterial endothelium.J Biol Chem,2008,283(28):19456-19464
[8]Nair J,De Flora S,Izzotti A,et al.Lipid peroxidationderived etheno-DNA adducts in human atherosclerotic lesions.Mutat Res,2007,621(1-2):95-105
[9]Nair J,Barbin A,Velic I,et al.Etheno DNA-base adducts from endogenous reactive species.Mutat Res, 1999,424(1-2):59-69
[10]Frank A,Seitz HK,Bartsch H,et al.Immunohistochemical detection of 1,N6-ethenodeoxyadenosine in nuclei of human liver affected by diseases predisposing to hepato-carcinogenesis.Carcinogenesis,2004,25(6):1027-1031
[11]Kruger K,Jochum C,Glüsenkamp KH,et al.New modular delivery system for diagnostic and therapeutic pre-targeting using tautomer-specific monoclonal antibody EM-6-47 and 3-substituted adenines.Int J Cancer,1998,77(4):610-619
[12]Chisolm GM,Steinberg D.The oxidative modification hypothesis of atherogenesis:an overview.Free Radic Biol Med,2000,28(12):1815-1826
[13]Barbin A.Etheno-adduct-forming chemicals:from mutagenicity testing to tumor mutation spectra.Mutat Res,2000,462(2-3):55-69
[14]Godschalk R,Curfs D,Bartsch H,et al.Benzo[a] pyrene enhances lipid peroxidation induced DNA damage in aorta of apolipoprotein E knockout mice.Free Radic Res,2003,37(12):1299-1305
[15]Andreassi MG.Coronary atherosclerosis and somatic mutations:an overview of the contributive factors for oxidative DNA damage.Mutat Res,2003(1),543: 67-86
[16]Vindis C,Escargueil-Blanc I,Elbaz M,et al.Desensitization of platelet-derived growth factor receptor-beta by oxidized lipids in vascular cells and atherosclerotic lesions:prevention by aldehyde scavengers.Circ Res, 2006,98(6):785-792
[17]Bartsch H,Nair J.Oxidative stress and lipid peroxidation-derived DNA-lesions in inflammation driven carcinogenesis.Cancer Detect Prev,2004,28(6):385-391
OXIDIZED LOWDENSITY LIPOPROTEIN INDUCES THE FORMATION OF DNA ADDUCTS IN HUMAN VASCULAR ENDOTHELIALAND SMOOTH MUSCLE CELLS
Yang Shiming,Wang Ying1*,Chen Lili2
(Division ofHistology and Embryology,Department of A natomy,Tongji Medical College, Huazhong University of Science and Technology;1Department of Gastroenterology;2Department of Geriatrics,A f f iliated Tongji Hospital ofTongji Medical College, Huazhong University of Science and Technology,Wuhan430030,China)
Objective To investigate the pathogenesis of oxidized LDL(oxLDL)in the progression of atherosclerosis.Methods To correlate oxLDLand macromolecular damage,we measured levels of LPO-derived miscoding etheno-DNA adducts and LPO-modified proteins in cultured human vascular endothelial and smooth muscle cells after incubation with oxLDLfor up to 48h.A semi-quantative analysis method for 1,N6-etheno-deoxyadenosine(εdA)by immunohistochemistry was applied.Results After oxLDLstimulation,a marked and significant increase ofεdA-stained nuclei was found in both endothelial and smooth muscle cells.Similarly,4-hydroxy-2-nonenal- modified proteins,as analyzed by immunohistochemistry and Western blot,showed a 3-5 fold increase.Conclusion LPO-derived etheno-DNA adducts and LPO-modified proteins are strongly induced by oxLDLin human vascular endothelial and smooth muscle cells.This macromolecular damage may contribute to the dysfunction of arterial endothelium and the onset of atherosclerosis.
Atherosclerosis;Oxidized LDL;Lipid peroxidation;Etheno-DNA adduct;Human endothelial and smooth muscle cells
R329
A
10.3870/zgzzhx.2010.04.016
2009-09-04
2010-03-02
杨世明,男(1967年),汉族,主管技师。
*通讯作者(To whom correspondence should be addressed)

