气相色谱微池电子捕获检测器测定蜂蜡中6种杀螨剂药物残留
陈 芳,李 丹, 张金振,黄京平,赵 静,吴黎明,*
(1.中国农业科学院蜜蜂研究所,国家农产品加工中心蜂业分中心,北京 100093;2.北京城市学院生物医药系,北京 100083)
气相色谱微池电子捕获检测器测定蜂蜡中6种杀螨剂药物残留
陈 芳1,李 丹2, 张金振1,黄京平1,赵 静1,吴黎明1,*
(1.中国农业科学院蜜蜂研究所,国家农产品加工中心蜂业分中心,北京 100093;2.北京城市学院生物医药系,北京 100083)
建立一种准确、快速、简便的蜂蜡中杀螨剂类药物多残留检测技术。样品经恒温水浴液-液萃取、低温冷冻离心净化后用气相色谱微池电子捕获检测器测定。对提取溶剂的种类、体积及提取次数进行研究。结果表明:30.0mL乙腈-正己烷(V/V,2:1)是最佳提取溶剂。经两次冷冻及高速离心能将大部分的脂类基质去除。该方法的线性范围为0.01~4mg/L,相关系数均大于0.9878。检出限为0.96~4.69μg/kg,定量限为2.56~13.12μg/kg。该方法在3个不同浓度水平的添加均有很好的回收率(83.8%~110.4%),相对标准偏差为1.70%~6.60%。
杀螨剂;蜂蜡;气相色谱微池电子辅获检测器
Abstract:An accurate, fast and convenient method for simultaneous determination of 6 acaricide residues in beeswax by gas chromatography coupled with a micro-electron capture detector (GC-MECD) was established. The sample was saturated with hexane and acetonitrile in water bath with constant temperature. After frozen and centrifugation at 10000 r/min, the extract was analyzed by GC-MECD. Effects of extraction solvent, solvent volume and extraction times on extraction efficiency were explored. The best extraction solvent was 30.0 mL of acetonitrile-hexane (V∶V, 2:1). Twice freezing and high speed centrifugation could remove the interference of lipid matrix. This method exhibited an excellent linear relationship over the range of 0.01 to 4.0 mg/L with a correlation coefficient of larger than 0.9878. The limits of detection (LOD) for the 6 acaricides varied from 0.96 to 4.69 μ g/kg. The average recovery rates of these analytes spiked at three different levels ranged from 83.8% to110.4%, and the relative standard deviations (RSD) from 1.70% to 6.60%.
Key words:acaricide;beeswax;gas chromatography coupled with a micro-electron capture detector (GC-MECD)
蜂螨是蜜蜂的天敌,也是最为严重的敌害。螨害发生时,轻则群势受损,重则全群覆灭。为防治蜂螨,溴螨酯、蝇毒磷、氟胺氰菊酯等杀螨剂已成为养蜂业广泛施用的药物。这几种药物的使用促进了养蜂业快速发展,但由于杀螨剂脂溶性特点,容易蓄积于蜂蜡中,蜂蜡的循环使用导致巢脾中药物残留种类、残留量不断增加,直接影响了蜂蜡质量安全。同时,通过蜜蜂与巢脾的接触,杀螨剂药物残留能够转移至蜂蜜、蜂王浆、蜂胶等蜂产品中,进而造成蜂产品污染。
因此各种组织和各个国家纷纷制定残留限量来应对蜂产品质量问题。美国规定双甲脒在蜂蜜、蜂巢中的限量分别为1mg/kg和6mg/kg,蝇毒磷在蜂蜜、蜂巢中的限量分别为0.15、45mg/kg, 氟胺氰菊酯在蜂蜜中的限量为0.05mg/kg。澳大利亚规定氟胺氰戊菊酯、氟胺氰菊酯在蜂蜜中的限量为0.005、0.01mg/kg;日本规定了蜂蜜(包括蜂王浆)中双甲脒、氯氰菊酯、氟胺氰菊酯暂定标准为0.2、0.01、0.05mg/kg[1-2];其他国家及我国尚未制定。在检测方法方面,国外对蜂蜡中农药残留研究主要为有机氯类、亲脂性农药及少数杀螨剂药物等;国内对杀螨剂类药物的研究主要集中于蜂蜜产品,先后制定了蜂蜜中双甲脒及其代谢物、溴螨酯、4,4'-二溴二苯甲酮及氟胺氰菊酯残留量检验方法等6个标准,种类较为单一、有限。
由于国内、外使用的杀螨剂药物的品种不同,建立适合我国国情的蜜蜂巢脾及蜂蜡中杀螨剂类药物多残留检测方法十分必要。本研究拟建立一种快速、高效且具有普遍适用性的蜂蜡中常用杀螨剂多残留检测方法,为蜂产品质量安全监控提供有力的技术储备和支撑。
1 材料与方法
1.1 材料与试剂
溴螨酯、蝇毒磷、氟氯苯氰菊酯、氰戊菊酯、氟胺氰菊酯、溴氰菊酯标准品 美国Sigma公司;丙酮、乙腈、正己烷、甲醇、二氯甲烷(均为色谱级) 美国J.T.Baker公司;石油醚(分析纯)。
1.2 仪器与设备
7890a-μECD 气相色谱仪[配备7683自动进样器,色谱柱为HP-5 (30m×0.25mm,0.25μm)] Agilent公司;旋转蒸发仪 德国Heidolph公司;BCD-539WT冰箱 海尔公司;Himac-CR22GII高速冷冻离心机 日本Hitachi公司 。
1.3 标准储备液的制备
取6种标准品适量,用正己烷溶解后,分别配制成100mg/L的标准储备液,于-20℃冰箱中保存。分别取适量的6种标准品于同一容量瓶中,用正己烷定容为10mg/L的混合标准储备液,于-20℃冰箱中保存。
1.4 蜂蜡样品的制备
市售蜂蜡样品,于-20℃冰箱中冷冻1h后粉碎,于-4℃冰箱中保存;巢蜡,以每100g蜂蜡加1L水的比例在大烧杯中煮沸后冷却,将底部杂质用小刀削除,重复提纯一次。制备好的纯蜂蜡样品如市售蜂蜡,冷冻后粉碎保存。
1.5 样品提取与净化
称取1.0g蜂蜡样品于50.0mL离心管中,加入20.0mL乙腈,在75℃水浴锅中充分加热溶解后,加入10.0mL正己烷充分摇匀。于-22℃冰箱内冷冻约45 mi n,10000r/min离心5min,取乙腈相于50.0mL离心管中,再次冷冻约45min,10000r/min离心5min,取上清液,旋转蒸发至干,用1.0mL正己烷复溶,0.45μm滤膜过滤备用。
1.6 标准工作曲线的制备
取不含该实验测定的6种杀螨剂残留的蜂蜡样品,按上述样品提取与净化方法制备好空白蜂蜡样品,加入一定量的标准储备液,配制成一定质量浓度梯度的标准曲线。
1.7 气相色谱条件
进样口:260℃,不分流进样;检测器:300℃;程序升温:100℃恒温1min,25℃/min升至200℃、恒温1min,5℃/min升到260℃、恒温5min,4℃/min升到300℃、恒温4min;载气:高纯氮(>99.999%);流速:1.0mL/min;进样体积:1.0μL。
2 结果与分析
2.1 提取和净化条件的优化
文献显示,乙腈、甲醇和丙酮、正己烷、二氯甲烷、石油醚常作为蜂蜡杀螨剂类药物残留的提取溶剂[3-4],因此本实验对这6种溶剂的提取效率进行验证。结果表明,乙腈、甲醇和丙酮均有满意的提取效率(表1),二氯甲烷和石油醚的提取效率偏低(19.2%~88.0%),而正己烷只能提取出微量的氰戊菊酯、氟氨氰菊酯和溴螨酯。甲醇对氟氨氰菊酯和蝇毒磷的提取可能受基质的影响,回收率高达130%。为去除基质影响,在经提取的空白基质上添加标样(标准加入法),以此来消除基质干扰。校正后的结果显示,乙腈、甲醇和丙酮均有更好的回收率(69.3%~119.4%),尤其是氟氨氰菊酯和蝇毒磷的回收率从外标法中的130%、119.8%和124%分别变为119.4%、114.6%和94.9%,由此可见氟氨氰菊酯和蝇毒磷受基质影响最大。由于上述6种提取溶剂中,正己烷基本对目标化合物提取无效且又与乙腈或甲醇不互溶,本实验将正己烷与乙腈或甲醇配比进行液-液分配提取研究其净化效率。结果显示,乙腈或甲醇与正己烷配比的提取溶剂具有很好的提取效率且有效地降低基质干扰,其中乙腈与正己烷配比的溶剂提取效率更高(表2)。因此,本实验选择乙腈和正己烷作为此方法的提取溶剂。

表1 6种溶剂不同定量方法的提取效率Table 1 Extraction rates of six kinds of solvents using different quantification methods
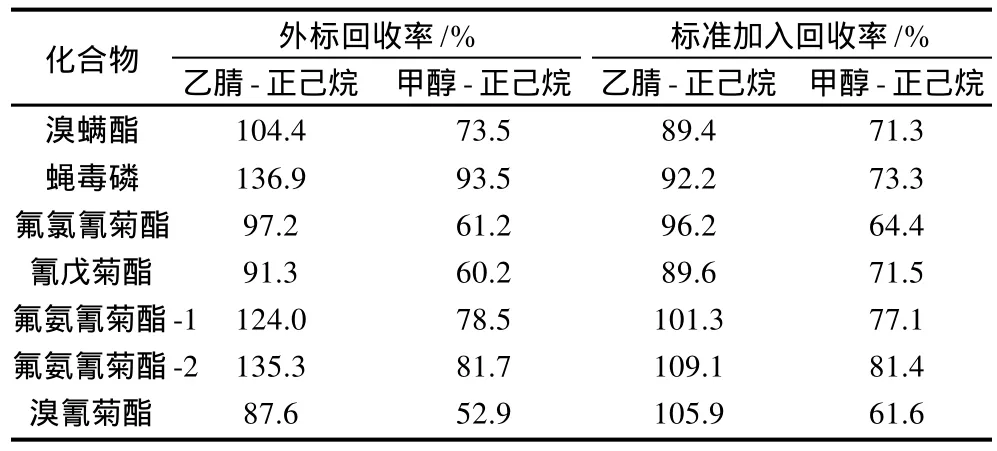
表2 两种不同液-液提取溶剂提取效率比较Table 2 Comparison of extraction rates using two different solvent extraction methods
研究提取溶剂的体积和提取次数,5.0mL正己烷和10.0mL乙腈提取,能够将除溴螨酯以外的其他5种药物充分提取出来,且提取效率达到88.0%~126.0%, 而第1次溶剂提取中溴螨酯的提取效率仅达到了60%,且在第2次提取液中仍然提取到了少量的溴螨酯。在第3次提取液中没有发现任何目标化合物。为了简化提取步骤,同时比较两次5.0mL正己烷和10.0mL乙腈提取与一次10.0mL正己烷和20.0mL乙腈提取,结果发现提取效率没有差异。
由于蜂蜡的组成以烃类、脂类和醇类为主,低温冷冻和高速离心的方法能将大部分的大分子脂类基质干扰物去除。因此,本实验对冷冻次数进行研究。结果表明,经一次冷冻后,可以将大部分的脂类物质去除。二次冷冻离心后,离心液基本澄清,且色谱图(图1)显示,目标化合物出峰时段内的干扰物更少。三次冷冻离心后,基本未见离心管壁上有脂类附着物,且色谱图与二次冷冻离心后的差异不大。因此,本实验选择两次冷冻离心作为净化方法。从样品的色谱图上可知,经液-液提取、冷冻离心后的样品基质杂质主要是一些小分子的极性物质,易气化且出峰时间较早,对目标化合物基本不干扰,也不会因残留在色谱柱中而污染色谱柱。因此,从实验简便易操作和实验成本的角度考虑,本方法将不进一步采用固相萃取的方法对样品进行净化。
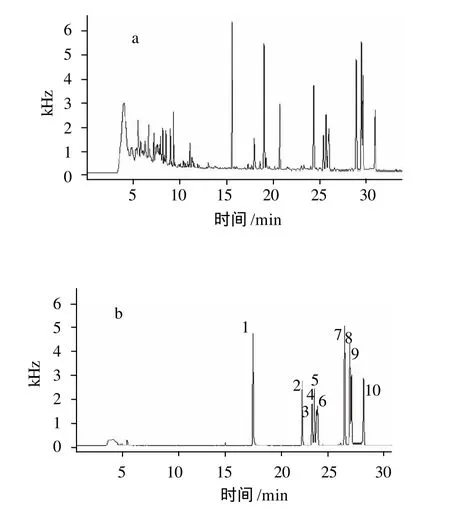
图1 6种杀螨剂标准品气相色谱图Fig.1 GC-MECD chromatogram of six kinds of acaricide residues
2.2 方法学研究
2.2.1 方法的线性范围和检出限
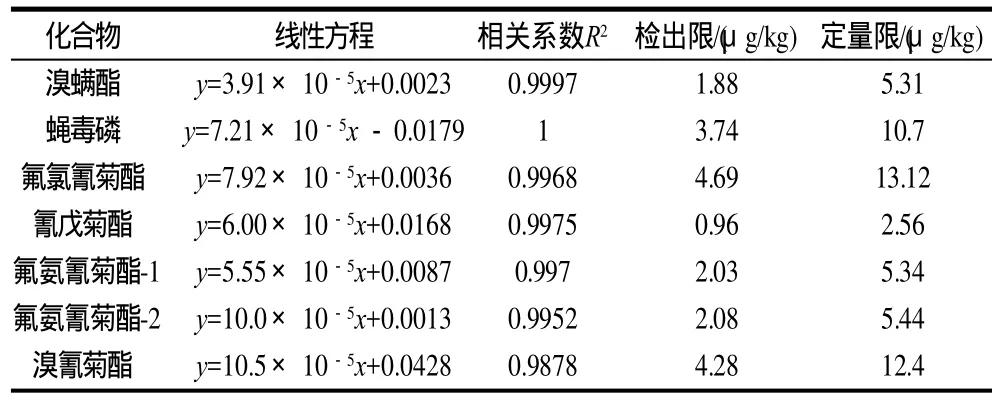
表3 方法的线性、检出限及定量限Table 3 Linear relationship and limit of detection (LOD) of the established method
杀螨剂是蜜蜂饲养过程中的常用药物,由于大部分的杀螨剂是脂溶性的,易累积在巢脾中[5]。且国外的研究资料表明,蜂蜡中的杀螨剂残留量通常在mg/kg的数量级上[6-7]。且各种组织和国家的残留限量也表明,双甲脒和蝇毒磷在蜂巢中的限量分别为6mg/kg和45mg/kg。本实验在0.01~4mg/L范围内选择了0.01、0.1、0.5、1、
2、4mg/L 6个质量浓度,以峰面积为X轴、质量浓度为Y轴建立标准加入工作曲线(表3)。6种杀螨剂均有很好的线性。斜率范围为3.92×10-5~10.5×10-5,截距为0.0013~0.0428,相关系数为0.9878。检出限是在空白加标的基础上测得的3倍信噪比对应的质量浓度,定量限为10倍信噪比对应质量浓度。结果显示6种杀螨剂的检出限为0.96~4.69μg/kg,其中氰戊菊酯的检出限最低为0.96μg/kg,氟氯氰菊酯的检出限最高。定量限为2.56~13.12μg/kg。
2.2.2 准确性和精密度
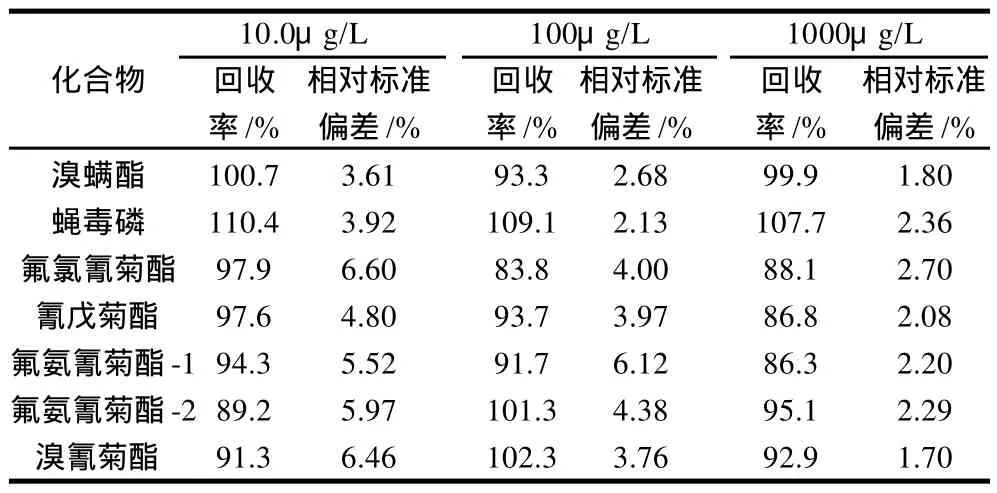
表4 不同质量浓度水平添加回收率及相对标准偏差(n=6)Table 4 Average recovery rates and relative standard deviations (RSD)of spiked samples with various concentration levels (n=6)
选择3个不同质量浓度添加水平的回收率来验证方法的准确性及精密度。结果显示,3个质量浓度均有很好的回收率,尤其是在10μg/L(氟氯氰菊酯添加了20μg/L)的添加水平上,其回收率和相对标准偏差均略高于其他两个水平的添加,分别为89.2%~110.4%、3.61%~6.60%(表 4)。
3 结 论
用20.0mL乙腈和10.0mL正己烷在75℃水浴溶解后的液-液提取,能够快速、完全地将目标化合物提取出来。提取液在冷冻后经高速离心等净化步骤,能够有效地去除样品基质中的脂类及其他大分子的干扰物质。方法学研究表明,本方法的定量限为2.56~13.12μg/kg,且在3个不同质量浓度添加水平上均取得很好的回收率。本方法具有快速、准确及试剂消耗少等特点。
[1] Food and Drug Administration of the United States. Pesticides tolerances[DB/OL]. http://www.cfsan.fda.gov.
[2] WTO/TBT-SPS Notification and Enquiry of China[DB/OL]. http://www.tbt-sps.gov.cn/foodsafe/xlbz/Pages/pesticide.aspx.
[5] FRIES I, WALLNER K, ROSENKRANZ P. Effects on varroa jacobsoni from acaricides in beeswax[J]. Apicult Res, 1998, 37(2):85-90.
[6] KAMEL A, AL-GHAMDI A. Determination of acaricide residues in saudi arabian honey and beeswax using solid phase extraction and gas chromatography[J]. Journal of Environmental Science and Health Part B, 2006, 41:159-165.
[7] KORTA E, BAKKALI A, BERRUETA L A, et al. Determination of amitraz and other acaricide residues in beeswax[J]. Analytica Chimica Acta, 2003, 475:97-103.
Determination of Six Acaricide Residues in Beeswax by Gas Chromatography Coupled with a Micro-electron Capture Detector
CHEN Fang1,LI Dan2,ZHANG Jin-zhen1,HUANG Jing-ping1,ZHAO Jing1,WU Li-ming1,*
(1. Apiculture Sub-Centers, National Agricultural Products Processing Center, Bee Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100093, China;2. Biological Medicine Department, Beijing City University, Beijing 100083, China)
TS207.53
A
1002-6630(2010)18-0244-04
2010-02-11
国家现代农业(蜂)产业技术体系建设专项(NYCYTX-43)
陈芳(1979—),女,助理研究员,硕士,研究方向为蜂产品质量安全。E-mail:fangchen326@126.com
*通信作者:吴黎明(1973—),男,副研究员,博士,研究方向为蜂产品质量安全。E-mail:apiswu@126.com

