华根霉脂肪酶催化合成乙酸香茅酯的研究
王 楠,王 栋,徐 岩,周艺博
(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡 214122)
华根霉脂肪酶催化合成乙酸香茅酯的研究
王 楠,王 栋,徐 岩*,周艺博
(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡 214122)
研究了华根霉菌丝结合脂肪酶(RCL)非水相直接酯化合成乙酸香茅酯的反应条件。在醇酸比为 1.2∶1,反应温度 40℃时得到较高的转化率。但由于底物乙酸较强的抑制性,使得高底物浓度下 RCL催化能力受限。通过采用分批流加的方法使在底物浓度 0.2mol/L时转化率提高至 94%。与 10种商品化脂肪酶进行了比较,发现在相同条件下RCL表现出较高的转化效率。产物乙酸香茅酯的色泽好,气味纯正。
华根霉,菌丝结合脂肪酶,乙酸香茅酯,非水相体系
1 材料与方法
1.1 实验材料
香茅醇、乙酸香茅酯的标准品 色谱纯,均购于Sigma公司;Lipozyme IM、南极假丝酵母 Candida antarctic脂肪酶 (CAL,即 N ovozym435) 购自 Novo Nordisk公司;玫瑰假丝酵母 Candida rugosa脂肪酶(CRL)、猪胰 Porcine pancreas脂肪酶 (PPL) 购自Sigma公司;荧光假单胞菌 Pseudom onas fluorescens脂肪酶 (AK)、青霉 Penicillium cam em berti脂肪酶 (G)、洋葱假单胞菌 Pseudom onas cepacia脂肪酶 (PS)、固定与硅藻土的洋葱假单胞菌脂肪酶 (PS-D)、爪哇曲霉 Aspergillus javanicus脂肪酶 (F-AP15) 购自Amano Phar maceutical公司;华根霉 Rhizopus chinensis CCTCC M201021菌丝结合脂肪酶(RCL)的制备见文献[8];其他试剂 均为分析纯。
1.2 脂肪酶合成活性的测定
分别取浓度为 1.2mol/L的辛酸和乙醇的庚烷溶液 0.5mL到 5mL离心管中,混合均匀后加入 10mg干菌体,在 40℃空气振荡器中反应 30min,反应结束后立即离心去除菌体,然后从上层清液中吸取 400μL反应液并加入 100μL内标 (己醇),气相检测生成的辛酸乙酯。气相柱为 PEG20000,检测器为 F ID,采用程序升温,起始温度 90℃维持 5min,以 10℃/min速率升温 11min,最终温度 200℃,保留时间 5min。在此条件下,1min生成 1μmol的辛酸乙酯所需的酶量定义为 1个合成酶活力单位。
1.3 水活度的控制
初始水活度平衡方法按徐岩等人的报道[6]。有机溶剂(包括反应的酸和醇)和 RCL均在 25℃密闭的容器内用饱和盐溶液平衡 3d。所采用的盐为LiCl (aw=0.113)、MgCl2(aw=0.30)、Mg(NO3)2(aw= 0.529)、NaNO3(aw=0.66)、NaCl(aw=0.75)和 K2SO4(aw=0.97)。
1.4 非水相酶促合成乙酸香茅酯反应
取 0.05mol/L香茅醇和等摩尔量的乙酸,置于磨口锥形瓶内,加入 10mL庚烷和脂肪酶。密闭后,置于恒温空气摇床上 200r/min反应。
定时从反应液中取 0.2mL,离心 (8000r/min 10min)取上清 0.1mL加入等体积 0.05mol/L正己醇作为内标。
1.5 乙酸香茅酯的检测
产物酯分析采用的气相色谱条件为:Agilent 6820气相色谱仪,采用 PEG 20M(AC20)毛细色谱柱(30m×0.22mm),载气为 N2;程序升温,100℃保持1min,升温速率 10℃/min至 200℃保持 3min。
乙酸香茅酯的转化率 C(%)=测得的乙酸香茅酯含量/完全酯化的乙酸香茅酯含量 ×100%
1.6 红外光谱分析
用 FT-I R SPECTROMETER红外光谱仪鉴定产品乙酸香茅酯的结构,制样方法采用液膜法。在400~4000cm-1范围内扫描。
1.7 产品品质鉴定
相对密度的检测方法:按照QB 796“香料统一检查方法——比重测定”;酸度的检测方法:按照QB 806“香料统一检查方法——酸值测定”;折光指数的检测方法:按照QB 798“香料统一检查方法——折光指数测定”。
2 结果与讨论
2.1 酶加量对华根霉脂肪酶合成乙酸香茅酯的影响
首先考察了酶加量对催化合成乙酸香茅酯的影响。通常在一定范围内酶浓度越大,酶与底物接触的几率越大,催化反应速度越快。如图 1所示,随着加酶量增加,从 30U/mL到 120U/mL,乙酸香茅酯的转化率几乎呈线性增长,由 43%增加至 80.1%。这是因为当底物浓度大于酶量时,随着酶量的增加,底物与酶形成酶-底物复合物量也逐渐增加,这种过渡态可迅速转化为产物。但随着酶加入量继续增加,转化率趋于平缓,无法进一步得到有效的提高。考虑产率和经济效益两方面因素,选定最适酶加量为120U/mL。

图 1 酶加量对 RCL合成乙酸香茅酯的影响
2.2 水活度对华根霉脂肪酶合成乙酸香茅酯的影响
在非水相催化研究中,一般认为初始水活度也是影响脂肪酶催化的一个重要因素。只有达到最佳水含量时,蛋白质结构的动力学刚性和热力学稳定性之间才能达到最佳平衡点[9]。为此考察了不同初始水活度对 RCL合成乙酸香茅酯的影响,结果如图2所示。

图 2 初始水活度对RCL合成乙酸香茅酯的影响
从图 2中可以看出,初始水活度对催化效果影响不是特别显著,初始水活度范围在 0.01~0.66之间时虽然转化率呈下降趋势,但 RCL均表现了较高的催化效率,从中可以看出,RCL可以耐受较为宽泛的水活度范围。Gandolfi等人也报道了菌丝结合脂肪酶在酯化反应中对水的存在表现的不是特别敏感[10]。但当初始水活度超过临界值时,转化率有较为明显的下降。这可能是由于水的过量存在有利于全细胞内水解酶催化从而影响反应平衡。
2.3 醇酸比对华根霉脂肪酶合成乙酸香茅酯的影响
通常优化底物摩尔比对转化率的提高是一个有效的策略[11]。实验考察了不同底物摩尔比对RCL催化合成乙酸香茅酯的影响,反应体系固定乙酸的量,将其和香茅醇按照一定摩尔比混合后加入反应体系中,结果如图 3所示。

图 3 不同醇酸比对RCL合成乙酸香茅酯的影响
开始时,随着醇酸摩尔比的加大,乙酸香茅酯的转化率明显增大。在醇酸比升高至 1.2∶1时,转化率由之前的 80.1%提高至 99.5%。其原因主要是酯化反应是可逆反应,过量香茅醇的存在有利于推动反应平衡向着酯合成方向移动,从而提高乙酸香茅酯的产率。但随着醇酸摩尔比的进一步增加,转化率及反应速率呈现下降趋势,原因可能是醇分子通过其疏水性侧链与脂肪酶活性中心周围的非极性氨基酸相互作用,引起酶构象的局部改变,不利于其与酸分子结合。所以综合考虑我们采用 1.2∶1作为最佳醇酸比。
2.4 分批添加底物酸对较高底物浓度下合成乙酸香茅酯的影响
为了进一步考察 RCL工业化应用前景,使下一阶段的提取分离更为有效。在一定的菌体量条件下,考察了增加底物浓度对酯化反应的研究。当反应体系中乙酸含量较高时,作为合成反应的底物乙酸的极性较强(log P=0.5),在底物浓度为 0.2mol/L时转化率大幅降低,只有 24%。为降低高浓度乙酸对 RCL的毒害作用。实验采用分批流加乙酸的方式完成酯化反应,在反应第一步转化率接近平衡时第二次添加底物乙酸,使得反应过程中乙酸浓度一直保持在较低的范围内,避免在反应过程中引起酶的失活。从图 4中可以看出,通过采用批次添加底物法使得在初速度较快,考虑原因是由于醇酸比高引起。最终转化率可达到 93.7%,在高底物浓度下有效提高了转化率。

图 4 分批次添加乙酸对 RCL合成乙酸香茅酯的影响
2.5 反应批次对华根霉脂肪酶合成乙酸香茅酯的影响
按照上述的优化条件,考察了 RCL催化合成乙酸香茅酯的重复使用情况。在第二批反应时酶活受到一定影响,接下来 5批次反应后乙酸香茅酯的产率仍可达 80%左右,说明多次重复使用后,RCL仍能保持较好的活性,整个反应体系在上述的优化条件下有较好的操作稳定性。
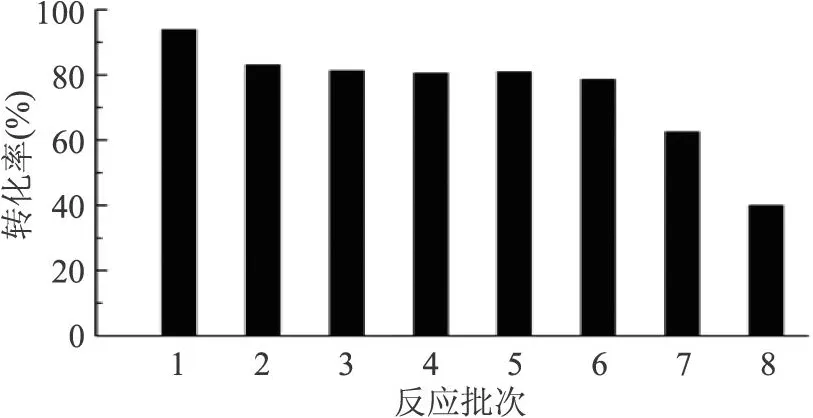
图5 RCL合成乙酸香茅酯的批次稳定性
2.6 华根霉脂肪酶与商品化脂肪酶合成乙酸香茅酯的比较
对具有相同酯合成酶活力单位的商品化脂肪酶和 RCL在相同的反应体系下对乙酸香茅酯的转化效果进行了研究,结果如表 1所示。

表 1 不同脂肪酶催化合成乙酸香茅酯的效果比较
从表 1中可以看出:脂肪酶的来源不同,其催化活性也不同。其中Novozym 435的转化效果最佳,最终转化率可以达到 95.1%,其次是 RCL,其转化效果与Novozym 435相差不大,转化率接近94%。考虑到RCL作为菌丝结合脂肪酶省去了复杂的纯酶提取与固定化等工艺,除了具有较高的转化率之外,在成本价格上与商品化脂肪酶相比具有一定的优势,所以RCL有利于酶法生产乙酸香茅酯工业化的应用。
2.7 产物表征分析与品质鉴定
2.7.1 产物红外光谱鉴定 将经过减压蒸馏分离的乙酸香茅酯与标样进行红外光谱的鉴定。结果如图 6所示。可见,样品的红外光谱图与美国 Sigma-Fluka公司的色谱醇标准品基本一致。可以证明产物为乙酸香茅酯。
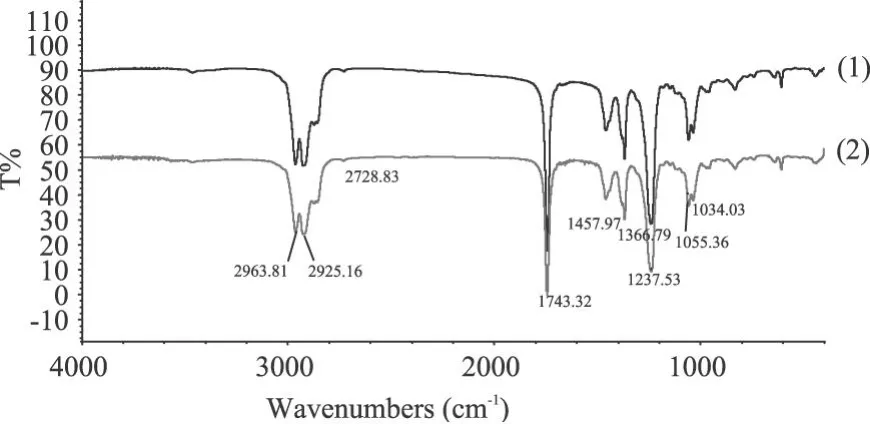
图 6 乙酸香茅酯产品与标准样品红外图谱分析注:1-标准样品;2-产物乙酸香茅酯。
2.7.2 产物品质鉴定 把产物乙酸香茅酯按照国标GB 14156-93“食品添加剂—乙酸香茅酯”的内容对其质量进行分析结果见表 2。

表 2 产品品质与乙酸香茅酯国标的对比结果
从表 2中所示,产物乙酸香茅酯色泽好、气味纯正,且各项指标均符合国家标准。
3 结论
本研究系统地考察了华根霉全细胞脂肪酶(RCL)有机相催化合成乙酸香茅酯的过程,研究结果表明,在有机相中 RCL对合成乙酸香茅酯有较高的催化效率。由于乙酸较强的极性会抑制 RCL的催化效率,通过采用分步添加底物乙酸的方法,可以在较高的底物浓度下达到较好的催化效果,而且 RCL本身具有成本优势,与其他商品化脂肪酶相比,在生物法合成乙酸香茅酯的工业生产中具有良好的应用前景。
[1]Melo L,Pastore G M,Macedo GA.Optimized synthesis of citronellyl flavour esters using free and immobilized lipase from Rhizopus sp[J].ProcessBiochem,2005,40(10):3181-3185.
[2]Yadav GD,Lathi PS.Synthesisof citronellol laurate in organic media catalyzed by immobilized lipases:kinetic studies[J].Jmol CatalB:Enzym,2004,27(2-3):113-119.
[3]Lozano P,Piamtongkam R,Kohns K,et al.Ionic liquids improve citronellyl estersynthesis catalyzed by immobilized Candida antarcticalipase B in solvent-free media[J].Green Chemistry,2007,9(7):780-784.
[4]Garcia T,Sanchez N,MartinezM,et al.Enzymatic synthesis of fatty esters Part I.Kinetic approach[J].Enzyme Microb Technol,1999,25(7):584-590.
[5]Fonteyn F,Blecker C,Lognay G,et al.Optimization of lipase -catalyzed synthesis of citronellyl acetate in solvent-freemedium [J].BiotechnolLett,1994,16(7):693-696.
[6]Xu Y,Wang D,Mu X,et al.Biosynthesis of ethyl esters of short-chain fatty acids using whole-cell lipase fromRhizopus chinesisCCTCC M201021 in non-aqueous phase[J].Journal ofmolecular CatalysisB,Enzymatic,2002,18(1-3):29-37.
[7]谢红想 .有机相中芳香酯合成用脂肪酶产生菌的筛选及其应用[D].无锡:无锡轻工大学硕士论文,1998.
[8]Wang D,Xu Y,Teng Y.Synthetic activity enhancement of membrane-bound lipase fromRhizopus chinensisby pretreatment with isooctane[J].Bioprocess and Biosystems Engineering,2007, 30(3):147-155.
[9]孙志浩 .生物催化工艺学[M].北京:化学工业出版社现代生物技术与医药科技出版中心,2005.
[10]Gandolfi R,Converti A,Pirozzi D,et al.Efficient and selective microbial esterification with dry mycelium ofRhizopus oryzae[J].J Biotechnol,2001,92(1):21-26.
[11]Gillies B YHaADW.Production of Flavor Esters by Immobilized Lipase J[J].BiotechnologyLetters,1987,9(10):709 -714.
Biosynthesis of citronellyl acetate using mycelium-bound lipase fromRhizopus chinesis
WANG Nan,WANG Dong,XU Yan*,ZHOU Y i-bo
(School ofBiotechnology,KeyLaboratory of IndustrialBiotechnology of theMinistry of Education,Southern Yangtze University,Wuxi 214122,China)
Seve ra l reac tion p a ram e te rs in the m yce lium-bound lip ase from Rhizop us chinens is(RCL)ca ta lyzes es te rifica tion we re inves tiga ted,high conve rs ion was ob ta ined by a lcohol/ac idm ola r rad io of1.2∶1a t40℃.But us ing highe r subs tra te concentra tions couldn’t achieve re la tive ly highe r conve rs ion.To imp rove the p roduc tion of the c itrone llyl ace ta te,an app roach by p ortion-w ise add ition of subs tra te was es tab lished.The conve rs ion of the p roduc t es te rwas inc reased to94%w ith highe r subs tra te leve l of0.2m ol/L.Comp a red w ith10comm e rc ia l l ip ases, RCL was p roved to be m os t suitab le for the synthes is of c itrone llyl ace ta te econom ica lly in non-aqueous p hase. The p roduc t of c itrone llyl ace ta te shows good color and p ure odor.
Rhizop us chinens is;m yce lium-bound lip ase;c itrone llyl ace ta te;non-aqueous p hase
TS202.3
B
1002-0306(2010)02-0307-04
乙酸香茅酯属于萜烯短链脂肪酸酯类化合物,天然存在于玫瑰油及香茅油中,具有清甜的柠檬果香及似玫瑰、薰衣草的香气。由于香气特征明显受到广大调香师的青睐,用于调配玫瑰、栀子、铃兰、香石竹、薰衣草和康乃馨等香型香精,是重要的香料成分并已广泛应用于饮食及化妆品等领域[1]。目前乙酸香茅酯的生产方式主要是化学合成的方法,还有极少量是从天然植物中分离提取。尽管化学合成的方法目前还比较经济,但是人们对天然产物和高品质产品兴趣逐渐增强,而从植物中提取又无法满足日益增长的需求,人们转向用生物技术的方法生产。与化学法相比,酶促法催化合成的乙酸香茅酯被认为是高质量的天然产品,加上酶法反应条件温和、转化率高等优点而吸引了许多人的研究,被看成是很有希望的工业化途径[2]。目前人们对脂肪酶催化合成乙酸香茅酯的研究较少,在国外研究中主要使用一些商品化脂肪酶[3-5]。由于商品化脂肪酶的价格普遍较高,如果在工业生产中使用,生产成本将会大幅度提高。因此开发具有较强催化能力且价格低廉的脂肪酶非常有吸引力。本实验室前期研究发现从酒曲中筛选得到的华根霉 Rhizopus chinensisCCTCC M201021在非水相中具有酯合成的能力[6-7],进一步研究发现该菌株所产的脂肪酶为膜结合脂肪酶,可以进一步稳定酶的构象[8]。通过冻干菌丝体可以直接投入使用,省去了提取、纯化和固定化等工序从而节省了催化剂的生产成本。本研究以提高产物得率为目标,对华根霉菌丝结合脂肪酶非水相合成乙酸香茅酯的特性进行研究。
2009-06-03 *通讯联系人
王楠 (1985-),女,硕士研究生,研究方向:非水相酶促催化。
国家高科技发展计划 (863)项目 (2007AA100401);江苏省自然科学基金 (BK2007020);生物反应器工程国家重点实验室开放课题。

