非水介质中脂肪酶催化合成蔗糖-6-乙酸酯*
王勍,郑璞,倪晔,孙志浩
(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡,214122)
非水介质中脂肪酶催化合成蔗糖-6-乙酸酯*
王勍,郑璞,倪晔,孙志浩
(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡,214122)
研究了以蔗糖为起始原料,在非水介质中脂肪酶催化合成蔗糖-6-乙酸酯。通过对反应介质、脂肪酶和酰基供体的筛选、转酯反应条件的优化得出,在DMSO/叔丁醇体系中,固定化脂肪酶Lipozyme TLIM能较好地催化乙酸乙烯酯和蔗糖进行转酯反应;反应的较佳条件为:DMSO/叔丁醇体积比1∶4,蔗糖与乙酸乙烯酯的摩尔比1∶10,蔗糖浓度0.06 mmoL/mL,固定化脂肪酶浓度80mg/mL,反应温度30℃,时间9 h,生成蔗糖-6-乙酸酯的产率为89.3%。并对产物进行了红外光谱及核磁共振分析,确证合成产物为蔗糖-6-乙酸酯。
蔗糖-6-乙酸酯,非水介质,脂肪酶,酰基供体,转酯反应
蔗糖-6-乙酸酯是单保护法合成超级甜味剂三氯蔗糖的关键中间体。三氯蔗糖是以蔗糖为原料经氯代而制得的一种非营养型强力甜味剂,甜度为蔗糖的600~700倍,且甜味纯正,甜味特性曲线几乎与蔗糖重叠。三氯蔗糖在人体内几乎不被吸收,热量值为零,可供肥胖、心血管病和糖尿病患者食用[1]。
合成蔗糖-6-乙酸酯的方法主要是传统的化学法,如乙酸酐酯化法[2]、有机金属合成法[3]、原酸酯法[4]等;也有关于酶法合成的报道[5-6]。蔗糖酯的化学合成反应条件一般比较苛刻,合成的产品颜色比较深,而且由于其选择性差,容易产生副产物[7];酶法合成主要是利用酶对催化区域的高效选择性,使反应在需要的位置进行。1984年Rathbone等[5]申请了生物法合成蔗糖-6-乙酸酯的专利,先用枯草杆菌发酵葡萄糖生成葡萄糖-6-乙酸酯,再用果糖转移酶催化葡萄糖-6-乙酸酯和蔗糖生成蔗糖-6-乙酸酯,第1步发酵及第2步转化的最高得率分别为56%和58%。1992年Jonathan等[6]使用脂肪酶P Amano在吡啶溶液中催化蔗糖和乙酸异丙烯酯进行转酯反应,反应4 d得到蔗糖-6-乙酸酯的产率为33%。脂肪酶法合成蔗糖-6-乙酸酯具有反应条件较温和,催化选择性较强,产品安全性好等优点,但同时也存在反应时间长,产率偏低的缺点。为提高脂肪酶催化合成蔗糖-6-乙酸酯的效率,本文对脂肪酶催化蔗糖与酰基供体生成蔗糖-6-乙酸酯的转酯反应进行了研究。
1 材料与方法
1.1 试剂与仪器
蔗糖-6-乙酸酯标样(纯度80%),加拿大TRC公司;枯草芽孢杆菌酶(游离态粉末),山东杰诺生物酶有限公司惠赠;脂肪酶L 1754(游离态粉末),西格玛奥德里奇(上海)贸易有限公司;固定化脂肪酶Lipozyme RMIM、Novozym 435、Lipozyme TLIM,北京高瑞森科技有限公司;TLC用薄层硅胶板,青岛海洋化学试剂公司;其他试剂均购自国药集团化学试剂有限公司。
高效液相色谱仪安捷伦1100系列,色谱柱Diamonsil C185 μm(250 ×4.6)mm;红外光谱仪 FTLA 2000-104,加拿大ABB Bomem公司;核磁共振波谱仪AVANCE III400 MHz,布鲁克·道尔顿公司。
1.2 方法
1.2.1 反应物料的预处理
将4 A分子筛于烘箱中105℃活化24 h以上,置于干燥器中冷却保存;将蔗糖于真空干燥箱中60℃下干燥24 h,置于干燥器中保存;液态反应物及所有的溶剂预先用活化好的4 A分子筛进行24 h以上除水。
1.2.2 酶促反应
在25mL的具塞单口反应烧瓶中加入0.3 mmol蔗糖,用5mL混合有机溶剂V(DMSO)∶V(叔丁醇)=1∶4完全溶解,预热至30℃后加入80 mg固定化脂肪酶TLIM,在相应温度下200 r/min振荡10 min,然后加入3 mmoL乙酸乙烯酯,置于振荡培养箱中继续振荡24 h。反应过程中间隔取样TLC检测分析,反应结束用HPLC检测鉴定并计算产率。除试验所考察因素外,其他反应条件均按该描述进行。
1.2.3 蔗糖-6-乙酸酯的分离纯化
反应结束后,离心除去脂肪酶;将得到的上清液于60℃真空蒸发,除去低沸点液体,搅拌母液同时加入过量的二氯甲烷,沉淀其中的蔗糖-6-乙酸酯,过滤得到淡黄色蔗糖-6-乙酸酯粗品。参照文献[8]的方法对粗品进行纯化。
1.3 分析方法
1.3.1 TLC 法定性分析
定性分析参照文献[9]。
1.3.2 HPLC 法定量分析
定量分析参照文献[10]。
1.4 蔗糖-6-乙酸酯产率计算

2 结果与讨论
2.1 脂肪酶催化合成蔗糖-6-乙酸酯的反应介质
基于蔗糖的溶解性和脂肪酶活性不受限制两方面因素选择反应介质。表1中比较了蔗糖在几种介质中的溶解性,以及分别以固定化脂肪酶Lipozyme TLIM和Novozym 435为催化剂,与乙酸乙烯酯合成蔗糖-6-乙酸酯的情况(TLC分析)。表1表明,在DMF、DMSO、吡啶、叔戊醇、叔丁醇中几乎不能合成蔗糖-6-乙酸酯。原因可能是:DMF、DMSO是极性较强的溶剂,具有较强的亲水性,会剥夺酶的“必需水”,从而导致酶的失活;蔗糖在叔戊醇、叔丁醇中的溶解度太低也导致反应无法进行,吡啶不适合该转酯反应。

表1 不同溶剂对合成蔗糖-6-乙酸酯的影响
在DMSO/叔丁醇体系中,少量的DMSO能促进蔗糖溶解,使转酯反应可以进行,由于反应介质大部分是叔丁醇,酶能够较稳定的存在,很大程度上降低了酶的失活[11];虽然在DMSO/叔戊醇体系中,脂肪酶的催化效果与DMSO/叔丁醇体系相同,但考虑到DMSO/叔丁醇体系溶解性更好,有利于提高蔗糖产物浓度,因此选用DMSO/叔丁醇作为反应体系。如图1,当混合介质中DMSO与叔丁醇的体积比为1∶4时,蔗糖-6-乙酸酯产率较高。因此选用该比例混合溶剂作为转酯反应的溶剂体系。

图1 DMSO与叔丁醇比例对产率影响
2.2 脂肪酶对合成蔗糖-6-乙酸酯反应的影响
不同的酶对蔗糖分子中不同位置上羟基的选择性不同,从而得到不同的异构体。实验中比较了几种脂肪酶催化蔗糖和乙酸乙烯酯进行转酯反应,TLC法分析结果如表2

表2 不同脂肪酶的影响
根据HPLC检测结果得知,用Lipozyme TLIM做催化剂时,产率为80.1%。用Novozym 435做催化剂时产率只有37% 左右,同时还产生了差不多等量的异构体,而其他脂肪酶几乎不能催化反应。
进一步对酶的用量进行考察,比较不同浓度Lipozyme TLIM催化合成蔗糖-6-乙酸酯的产率。如图2,当 Lipozyme TLIM的浓度为 80mg/mL,产率为80.1%。随着酶量增加到一定程度,产率反而开始下降,其原因可能是过量的酶吸附了一定量的溶剂,导致底物过饱和而部分析出,无法参加反应而影响了产率。
2.3 乙酸乙烯酯对合成蔗糖-6-乙酸酯反应的影响
脂肪酶催化酰化的反应,是通过形成酰基-酶这个中间体发生的,因此酰基供体对反应有着显著的影响。通过比较乙酸乙烯酯、乙酸乙酯、乙酰乙酸乙酯和乙酸酐等酰基供体的转酯反应,TLC法分析检测发现乙酸乙烯酯是比较有效的酰基供体,而其他酰基供体几乎不能用于此转酯反应。这是因为,酶催化的转酯反应是一个亲核取代反应,酰基供体中的α碳原子的正电荷性越强,越容易被酶攻击;而生成的离去基团越易去除,则反应平衡方向越容易向合成新酯的方向移动。乙酸乙烯酯作为酰基供体时,生成的乙烯醇快速的转变为乙醛挥发掉,使得平衡方向向转酯反应移动。

图2 Lipozyme TLIM浓度对产率影响

图3 乙酸乙烯酯摩尔浓度对产率影响
根据图3可知,当酰基供体乙酸乙烯酯的用量达到0.6 mmol/mL,即蔗糖摩尔浓度的10倍时,产率为81.4%,再提高乙酸乙烯酯浓度已经对产率没有明显影响。
2.4 含水量对合成蔗糖-6-乙酸酯反应的影响
非水相酶促酯化反应中,体系中的含水量会影响反应的速率和反应的平衡位置。含水量过多会抑制平衡向产物方向的移动。因此,使用分子筛对各试剂进行预处理,以达到减少水分影响的目的。含水量对转酯反应的影响见图4,当体系中含水量为0.2mg/mL时,转酯效果明显低于无水状态下的效果;在反应前对试剂进行充分除水并在密闭条件下反应时,产率与在反应中加入分子筛时的产率基本相同。可见,反应前充分除水对转酯反应很有必要。

图4 含水量对产率影响
2.5 温度对合成蔗糖-6-乙酸酯反应的影响
温度对酶活有很大的影响,选择合适的温度能够使脂肪酶更好地催化反应进行。考察不同温度对反应的影响,结果如图5所示。30℃时,产物产率达到83.1%。超过40℃,酶活性明显下降,产率也随之降低。考虑到脂肪酶的回收与再利用,反应温度以30℃为宜。
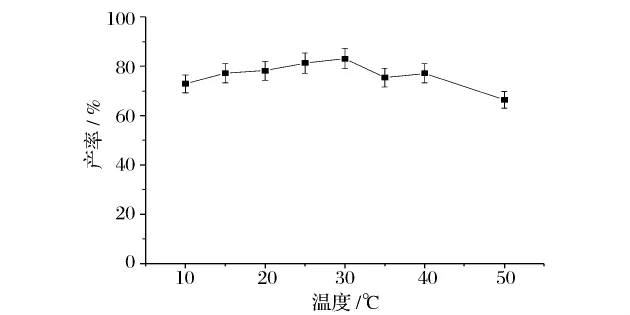
图5 温度对产率的影响
2.6 蔗糖浓度对合成蔗糖-6-乙酸酯反应的影响
对于产品的生产来说,除了产率之外,产量也是一个很重要的指标。反应中增加底物的浓度可以使产量提高。蔗糖浓度在0.06~0.18 mmoL/mL时合成蔗糖-6-乙酸酯的产率情况见图6。
从图6可知,蔗糖浓度低于0.09 mmoL/mL时,蔗糖-6-乙酸酯产率为83%左右。如果蔗糖浓度过高,在振荡反应的过程中会有底物析出,使得产率降低。
2.7 蔗糖-6-乙酸酯的反应进程与脂肪酶的重复使用

图6 不同蔗糖浓度对产率的影响
从图7可看出,从反应开始到6 h这段时间里,蔗糖-6-乙酸酯随着时间的延长而急剧增加,然后变成缓慢增长。反应至9 h,产率达到最高值89.3%。随着时间的继续,副产物(主要是蔗糖二酯)逐渐产生,产率反而有所下降。

图7 蔗糖-6-乙酸酯的反应进程
将反应至9 h的固定化脂肪酶Lipozyme TLIM过滤取出,重新投入新的反应,观察重复使用后的产率。如图8,Lipozyme TLIM反复使用6次后,产率下降至初始产率的50%左右。酶活下降的主要因素可能是反应介质中的DMSO以及反应生成的乙醛对脂肪酶造成了伤害,从而降低了脂肪酶的催化效能。

图8 Lipozyme TLIM重复使用的产率
2.8 蔗糖-6-乙酸酯结构鉴定
蔗糖-6-乙酸酯粗品经过纯化后,得到蔗糖-6-乙酸酯晶体,对其进行红外光谱和核磁共振分析。
红外光谱分析(盐片涂膜法,溶剂为丙酮):如图9所示,3 417.6cm-1处的强宽吸收峰为羟基 O—H的伸缩振动的特征吸收,2 931.6cm-1处的弱吸收峰为烷烃饱和 C—H伸缩振动的特征吸收,1 735.8cm-1处的吸收峰为C=O的伸缩振动吸收峰,1 253.6cm-1处有酯基中C—O伸缩振动吸收峰,1 006~1 103cm-1处为—CH2OH中C—O伸缩振动的特征吸收峰,其中1 056.9cm-1处的强吸收峰为糖环特征吸收。另外929.6cm-1处的吸收峰,是 α-糖苷键的特征吸收。综合红外图谱分析,符合蔗糖-6-乙酸酯的结构特征。

图9 蔗糖-6-乙酸酯红外光谱分析
蔗糖-6-乙酸酯的核磁共振13C分析结果:13CNMR(C2D6SO,400MHz):170.41(—COCH2),103.86(C2'),91.40(C1),82.73(C5'),76.96(C3'),74.53(C4'),72.70(C3),71.52(C2),70.22(C5),69.96(C4),63.79(C'),62.60(C6'),62.27(C1'),20.63(—COCH2)。13C图谱结果与文献[12]提供的理论值相一致,从而可以认定该产品就是目标产物蔗糖-6-乙酸酯。
3 结论
固定化脂肪酶Lipozyme TLIM催化合成蔗糖-6-乙酸酯的较佳反应条件为:在30℃、200 r/min下,0.06 mmol/mL蔗糖溶液中加入80mg/mL的固定化脂肪酶Lipozyme TLIM和0.6 mmol/mL乙酸乙烯酯,反应9 h,蔗糖-6-乙酸酯的产率达到89.3%。产物经过TLC、HPLC、FTIR和NMR等分析鉴定,确认为蔗糖-6-乙酸酯。脂肪酶重复使用6次后,反应产率下降到初始产率50%左右,说明需要对脂肪酶进行再修饰,以达到多次利用,降低成本的目的。
[1]胡国华,马正智,沈云飞.高倍甜味剂三氯蔗糖在我国的发展现状及前景[J].中国食品添加剂,2007(1):58-61.
[2]郑建仙.单基团保护法制备三氯蔗糖的研究[J].食品与发酵工业,2001,27(9):1-6.
[3]张彦洲,李金来.二丁基氧化锡法合成三氯蔗糖单酯及过程分析研究[J].河北省科学院学报,2007,24(1):58-61.
[4]晏日安,杨伟,杜淑霞,等.单酯法合成三氯蔗糖的研究[J].食品工业科技,2007(6):180-181;199.
[5]Rathbone E B,Hacking A J.Trihalo-Trideoxy Galactosucrose Compounds[P].GB,2145080.
[6]Jonathan S.Dordick.Selective Acrylation of Sugar[P].US,5128248.
[7]陈志刚,宗敏华,娄文勇.非水介质中酶促糖酯合成研究进展[J].分子催化,2007,21(1):90-95.
[8]邓丽杰,陈平.柱色谱分离蔗糖酰化产物中蔗糖-6-乙酸酯的研究[J].化学研究与应用,2006,18(12):1 456-1 459.
[9]沈冬,宋杰灵,金时俊等.薄层色谱在三氯蔗糖合成控制中的应用[J].分析化学,1994,22(9):902-904.
[10]张英,粟晖,韦异,等.反相高效液相色谱法监测蔗糖-6-乙酸酯合成[J].化学研究与应用,2004,16(2):245-247.
[11]Plou F,Cruces M.Enzymatic acylation of di-and trisaccharides with fatty acids:choosing the appropriate enzyme,support and solvent[J].Journal of Biotechnology,2002,96(1):55-66.
[12]付贤树.三氯蔗糖的制备及表征[D].天津:天津大学硕士学位论文,2006.
Lipase-catalyzed Synthesis of Sucrose-6-acetate in Nonaqueous Medium
Wang Qing,Zheng Pu,Ni Ye,Sun Zhi-hao
(The Key Laboratory of Industrial Biotechnology,Ministry of Education;School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Synthesis of sucrose-6-acetate in non-aqueous medium from sucrose using lipase was studied.The transesterification conditions including reaction medium,acyl donor,enzyme,water content and temperature were investigated.Results showed that immobilized-lipase Lipozyme TLIM could effectively catalyzed sucrose and vinyl acetate to produce sucrose-6-acetate in the medium composing of DMSO and tert-butyl alcohol.A mole yield of 89.3%was reached when the transesterification was performed as follows:volume ratio of DMSO to tert-butyl alcohol 1∶4,mole ratio of vinyl acetate to sucrose 10∶1,concentration of sucrose 0.06 mmoL/mL,concentration of,enzyme 80mg/mL,reaction temperature of 30℃ and reaction time of 9 h.The structure of the products was also characterized as sucrose-6-acetate by FTIR and NMR.
sucrose-6-acetate,nonaqueous medium,lipase,acyl donor,esterification reaction
硕士研究生(郑璞教授为通讯作者)。
*国家重点基础研究发展计划“973”(No.2003CB716008),国家自然科学基金(No.20473049)项目。
2010-07-13,改回日期:2010-10-08

