吡格列酮对脂多糖诱导的星形胶质细胞炎性细胞因子释放的影响
隋海娟,金 英,潘月星,刘婉珠,闫恩志
星形胶质细胞是中枢神经系统的免疫吞噬细胞,在致炎因素作用下被激活成反应性星形胶质细胞。激活的星形胶质细胞具有吞噬功能,并增加分泌细胞因子如白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)、肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)及 NO 等,这些物质对神经细胞有毒性作用,使神经细胞凋亡并坏死[1,2]。同时星形胶质细胞在神经系统中又起支持并维护脑神经元突触联系的正常功能,它的损伤常导致脑组织正常结构和功能的改变,最终导致神经退行性病变的发生。已有研究表明阿尔采末(Alzheimer′s disease,AD)患者脑内伴有明显胶质细胞反应,斑块周围出现大量星形胶质细胞,激活星形胶质细胞在老年斑的形成中起到重要作用。
过氧化物酶增殖物激活受体γ(peroxisome proliferator-activated receotor-γ,PPARγ)激动剂噻唑烷二酮类药物(thiazolidinedione drugs,TZDs)作为胰岛素增敏剂目前在临床主要用于2型糖尿病和胰岛素抵抗的治疗。研究表明[3-4]吡格列酮(pioglitazone,Pio)可能通过上调脂联素受体(Adipo R1)或增加visfatin蛋白表达而改善胰岛素抵抗。除了调节糖代谢,这类药物还能抑制神经胶质细胞的激活及中枢炎症介质的分泌[5-6]。研究发现TZDs对神经细胞还有直接的保护作用,但其保护作用机制研究尚不全面。新近国外研究[7]又提出了TZDs通过激活PPARγ来抑制沉积作用的新理论。本研究采用LPS损伤模型,观察吡格列酮对培养的大鼠乳鼠皮质星形胶质细胞产生的炎性细胞因子和NO的影响,并进一步探讨其作用机制。
1 材料
1.1 动物 1~2 d的Sprague-Dawley(SD)大鼠乳鼠[动物合格证号:SCXK(辽)2003-0007],辽宁医学院动物实验中心提供。
1.2 药品和试剂 吡格列酮由日本Takeda公司提供 (批号:060901,纯度>99%),临用时用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解。DMSO、LPS、DMEM、胰蛋白酶(trypsin,1 ∶250)、L-多聚赖氨酸(poly-L-lysine)、GFAP单克隆抗体均购自Sigma公司;PPARγ受体特异性阻断剂GW9662和JNK特异性阻断剂SP600125购于厦门励远有限公司;选择性诱导型一氧化氮合酶阻断剂SMT和NO检测试剂盒购于碧云天生物技术研究所;新生胎牛血清、HEPES、马血清购于北京华美转导科技有限公司;IL-1β、IL-6及TNF-α的ELISA试剂盒为武汉博士德生物科技有限公司产品。
1.3 仪器与器材 CO2培养箱(TEHER)、倒置显微镜(PM-6 Olympus)为日本产品;离心沉淀器(800型)为上海产品;水浴恒温振荡器为武汉产品;Mini-REPOTEANⅡ 电泳槽为Bio-Red公司产品;TGL-16G高速冷冻离心机为日本日立公司产品;DYY-Ⅲ型电转移槽为北京六一仪器厂产品;Biocell2010酶标仪为Anthos Labtec Instruments公司产品;低温冰箱为日本三洋公司产品;免疫荧光显微镜(ZDM-500Z)产于德国。
2 方法
2.1 大脑皮层星形胶质细胞的培养及鉴定 取出生1~2 d的SD大鼠乳鼠,体积分数为75%乙醇浸泡消毒,无菌条件下取出大脑皮层,置于培养基中,剔除血管和软脑膜,剪成1 mm3左右的小块。加入0.125%胰蛋白酶37℃消化10 min。待细胞分散后,加入含10%胎牛血清的DMEM培养基终止消化。200目筛网过滤,1 000×g离心10 min,用含10%胎牛血清的DMEM培养基制成细胞悬液,调整细胞密度为1×108·L-1~1×109·L-1,接种在铺有L-多聚赖氨酸75 cm2培养瓶中,置于37℃、5%CO2培养箱中培养。以后每3 d换液1次,d 9将培养的星形胶质细胞置于水浴恒温振荡器上,37℃、260 r·min-1、2 h,移除上层液体,去除贴壁不牢固的小胶质细胞和少突胶质细胞。仍贴壁的细胞大部分为星形胶质细胞,用0.25%胰蛋白酶溶液消化后离心,完全培养基重悬,接种于两个75 cm2培养瓶中,传2~3代后进行实验。用GFAP染色以鉴定星形胶质细胞纯度,结果表明星形胶质细胞纯度在95%以上(Fig 1)。

Fig 1 The expression of GFAP in cultured cortical astrocytes in rats(×400).
2.2 ELISA 方法测定 IL-1β、IL-6 和 TNF-α 表达水平 星形胶质细胞传2~3代后进行分组,药物处理后,收集细胞培养上清液,1 500 r·min-1,4℃,离心10 min,分装,-80℃冻存。取上清,根据IL-1β、IL-6和TNF-α检测试剂盒说明书所示的操作方法,用酶标仪测定样品在450 nm的吸光度值(A450值),根据标准品的结果绘制标准曲线,直线回归分析,得出其直线回归方程。将测得的不同待检标本的A值代入相应的直线回归方程中,即可得到IL-1β、IL-6和TNF-α的含量。
2.3 细胞培养上清液中NO含量的测定 星形胶质细胞传2~3代后进行分组,药物处理后,收集细胞培养上清液,1 500 r·min-1,4℃,离心 10 min,分装,-80℃冻存。取上清,根据Griess法测定培养液中NO的含量[8]。具体测定方法按试剂盒说明书进行。
2.4 统计学处理 实验结果数据用表示,采用oneway ANOVA和LSD’s post hoc test进行统计学分析。
3 结果
3.1 吡格列酮对抗LPS引起的星形胶质细胞IL-1β、IL-6和TNF-α释放增加 Tab 1,2结果显示,加入LPS作用后星形胶质细胞培养液中IL-1β、IL-6及TNF-α含量开始增加,24 h达高峰,48 h后开始降低。Pio(0.1 μmol·L-1)组可降低星形胶质细胞IL-1β的表达水平 (P<0.05),也可明显抑制星形胶质细胞IL-6的分泌(P<0.01),而对星形胶质细胞分泌 TNF-α 则无作用。Pio(1、10 μmol·L-1)组均能明显抑制LPS引起的IL-1β、IL-6和TNF-α的水平增加,并呈一定浓度依赖性(Tab 2)。GW9662(10 μmol·L-1)能够明显对抗吡格列酮对LPS引起的 IL-1β、IL-6和 TNF-α 增加的抑制作用。SP600125可对抗 LPS引起的 IL-1β、IL-6和 TNF-α产生增加,单独应用SP600125对正常IL-1β、IL-6和TNF-α 无作用(Tab 2)。
Tab 1 Effect of LPS on the level of IL-1β,IL-6 and TNF-α in cultured medium of astrocytes in rats(±s,n=5)

Tab 1 Effect of LPS on the level of IL-1β,IL-6 and TNF-α in cultured medium of astrocytes in rats(±s,n=5)
Cultured astrocytes were incubated with 10 mg·L-1LPS for 1,2,4,8,16,24,and 48 h.After the incubation with LPS,the culture medium was collected.*P<0.05,**P<0.01 vs control
Group IL-1β level/ng·L-1 IL-6 level/μg·L-1 TNF-α level/ng·L -1 Control 6.59±1.06 1.82±0.21 2.03±0.19 LPS 1 h 7.09±0.98 2.23±0.36 2.84±0.47 LPS 2 h 15.16±3.57* 4.09±0.18* 4.36±0.77*LPS 4 h 43.67±5.18** 6.54±0.52** 7.52±0.52**LPS 8 h 80.56±6.47** 8.13±0.64** 9.53±0.82**LPS 16 h 126.49±7.38** 9.67±0.57**11.76±0.61**LPS 24 h 163.46±7.81**13.46±1.59**14.53±1.16**LPS 48 h 135.62±6.43**10.89±0.73**12.09±0.94**
Tab 2 Inhibitory effect of pioglitazone on IL-1β,IL-6 and TNF-α production in cultured astrocytes in rats(±s,n=5)

Tab 2 Inhibitory effect of pioglitazone on IL-1β,IL-6 and TNF-α production in cultured astrocytes in rats(±s,n=5)
**P<0.01 vs control;#P<0.05,##P<0.01 vs LPS.▲▲P <0.01 vs LPS+Pio 1 μmol·L-1.
Group IL-1β level/ng·L-1 IL-6 level/μg·L-1 TNF-α level/ng·L -1 Control 6.85±1.17 1.76±0.20 1.91± 0.23 LPS 158.99±8.20** 11.80±1.72**12.42±1.48**LPS+Pio/μmol·L-1 0.1 136.44±10.82# 6.72±0.85 11.15±0.97##1 104.71±12.91## 3.10±0.91## 3.06±0.77##10 97.68±5.94## 2.07±0.62## 1.82±0.52##LPS+Pio 1 μmol·L-1+GW 149.56±9.48▲▲ 10.76±1.24▲▲ 11.83±1.05▲▲GW 9662 6.29±0.95 1.56±0.19 2.03±0.18 LPS+SP 50.68±5.73## 3.47±0.58## 4.85±0.47##SP600125 6.57±1.05 1.64±0.22 1.88±0.21
3.2 吡格列酮对LPS引起体外培养星形胶质细胞NO含量的影响 从Fig 2和Tab 3可以看出,加入LPS作用后星形胶质细胞培养液中NO含量开始增加,24 h达高峰,48 h NO含量开始降低。吡格列酮(0.1、1 和 10 μmol·L-1)可明显抑制 LPS 引起的NO含量增加,呈明显浓度依赖性。而吡格列酮(0.1 μmol·L-1)部分抑制LPS引起的NO含量增加,未达到统计学意义。
GW9662(10 μmol·L-1)能够明显对抗吡格列酮对LPS引起的NO增加的抑制作用。SMT(1.0 mmol·L-1)几乎完全对抗LPS诱导NO产生的增加,单独应用SMT对正常培养NO产生有轻微的抑制作用,但未达到统计学意义。SP600125可对抗LPS引起的NO产生增加,单独应用SP600125对正常NO无作用(Tab 3)。
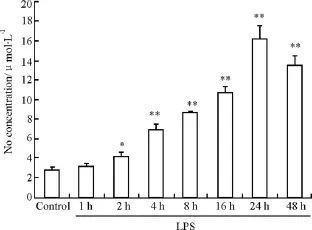
Fig 2 Effect of LPS on the content of NO in cultured medium of astrocytes in rats±s,n=5)
Tab 3 Effect of pioglitazone on the content of NO in cultured medium of astrocytes in rats(±s,n=5)

Tab 3 Effect of pioglitazone on the content of NO in cultured medium of astrocytes in rats(±s,n=5)
**P<0.01 vs control;##P<0.01 vs LPS;▲▲P<0.01 vs LPS+Pio1 μmol·L-1
Group Dose/μmol·L-1 NO content/μmol·L -1 Control 5.44±0.24 LPS 15.08±1.24**LPS+Pio 0.1 13.81±1.06 LPS+Pio 1 7.67±0.64##LPS+Pio 10 6.54±0.93##LPS+Pio 1+GW 10 15.70±0.84▲▲GW9662 10 5.62±0.47 LPS+SMT 103 6.69±0.54##SMT 103 5.01±0.35 LPS+SP 5 7.97±0.98#SP600125 5 5.34±0.31
4 讨论
AD的关键性特征之一是脑内炎症。在中枢神经系统炎症环境下,星形胶质细胞和小胶质细胞共同承担着免疫细胞的角色,尤其是星形胶质细胞,在很多脑部疾病中通过产生和释放有害的促炎症反应调节因子如NO、IL-1β、IL-6及TNF-α等来启动和促进炎症反应进展[9],从而引起神经细胞损伤。PPARγ 激活能明显抑制炎症反应[10],如 Combs等[11]发现PPARγ激活可明显抑制Aβ引起的培养小胶质细胞的激活和炎症细胞因子的释放。本研究发现LPS可增加星形胶质细胞分泌IL-1β、IL-6及TNF-α,吡格列酮能够明显抑制LPS的这些作用。说明吡格列酮对LPS引起的IL-1β、IL-6和 TNF-α增加的抑制作用是通过激活PPARγ而产生其抑制作用的。JNK特异性阻断剂 SP600125(5 μmol·L-1)亦能有效对抗LPS诱导星形胶质细胞IL-1β、IL-6、TNF-α及NO分泌的增加。说明吡格列酮对星形胶质细胞的保护作用可能与抑制JNK信号传导通路有关。最新研究还表明[12],IL-1可通过JNK信号传导通路来介导诱导型一氧化氮合酶 (inducible nitric oxide synthase,iNOS)的表达。吡格列酮抑制JNK激活可能是产生神经保护作用机制之一。我们前期的研究发现吡格列酮通过抑制JNK信号传导通路保护神经细胞凋亡[13-14],也进一步支持了这一结果。
激活的小胶质细胞和星形胶质细胞大量表达iNOS,产生大量的 NO[15-16]。Pang 等[17]研究发现NO的产生和iNOS的表达与JNK通路有关。本研究发现加入LPS后其NO分泌增加,而吡格列酮能明显的抑制LPS诱导的NO的产生,抑制神经细胞损伤,SMT几乎完全对抗LPS诱导NO产生的增加。吡格列酮的这种作用可能是通过抑制JNK通路进一步抑制iNOS,从而使NO产生降低,抑制神经细胞凋亡。吡格列酮是噻唑烷二酮类(Thiazolidinedione drugs,TZDs)化合物的一种,是PPARγ受体有效的激动剂。故认为吡格列酮对LPS致星形胶质细胞的损害可能与其激活PPARγ及抑制JNK通路进一步抑制 iNOS,减少了 IL-1β、IL-6、TNF-α 及 NO 的生成有关。
[1]Eikelenboom P,Veerhuis R,Scheper W,et al.The significance of neuroinflammation in understanding Alzheimer′s disease[J].J Neural Transm,2006,113(11):1685-95.
[2]McGeer P L,Rogers J,McGeer E G.Inflammation,anti-inflammatory agents and Alzheimer disease:the last 12 years[J].J Alzheimers Dis,2006,9(3):271-6.
[3]郑 敏,刘小莺,刘晓红,等.吡格列酮对波动性高糖处理的人脐静脉内皮细胞脂联素受体表达的影响[J].中国药理学通报,2008,24(9):1216-20.
[3]Zheng M,Liu X Y,Liu X H,et al.The effects of pioglitazone on the adiponectin receptors expression of HUVECs induced by intermittent high glucose[J].Chin Pharmacol Bull,2008,24(9):1216-20.
[4]吕齐欢,王佑民,丁晓洁,程 媛.吡格列酮对高脂喂养SD大鼠visfatin蛋白表达的影响[J].中国药理学通报,2009,25(8):1117-8.
[4]Lü Q H,Wang Y M,Ding X J,Cheng Y.Effect of pioglitazone on visfatin expression in high-fat diets fed SD rats[J].Chin Pharmacol Bull,2009,25(8):1117-8.
[5]王世兴,金 英,李亚男,等.吡格列酮对淀粉样β蛋白片段1-42引起的大鼠学习记忆障碍及海马炎症反应的影响[J].中国药理学与毒理学杂志,2008,22(5):348-54.
[5]Wang S X,J in Y,Li Y N,et al.Effects of pioglitazone on amyloid beta-protein fragment 1-42-induced learning and memory disorders and inflammatory reaction in hippocampus in rats[J].Chin J Pharmacol Toxicol,2008,22(5):348-54.
[6]Kim E J,Kwon K J,Park J Y,et al.Effects of peroxisome proliferator-activated receptor agonists on LPS-induced neuronal death in mixed cortical neurons:associated with iNOS and COX-2[J].Brain Res,2002,941(1-2):1-10.
[7]d′Abramo C,Massone S,Zingg J M,et al.Role of peroxisome proliferator-activated receptor gamma in amyloid precursor protein processing and amyloid beta-mediated cell death[J].Biochem J,2005,391(3):693-8.
[8]Bennett B L,Sasaki D T,Murray B W,et al.SP600125,an anthrapyra-zolone inhibitor of c-Jun N-terminal kinase[J].Proc Natl Acad Sci USA,2001,98(24):13681-6.
[9]Lee J W,Lee Y K,Yuk D Y,et al.Neuro-inflammation induced by lipopolysaccharide causes cognitive impairment through enhancement of beta-amyloid generation[J].J Neuroinflammtion,2008,29(5):37.
[10]Bernardo A,Gasparini L,Ongini E,et al.Dynamic regulation of microglial functions by the non-steroidal anti-inflammatory drug NCX 2216:implications for chronic treatments of neurodegenerative diseases[J].Neurobiol Dis,2006,22(1):25-32.
[11]Combs C K,Bates P,Karlo J C,et al.Regulation of beta-amyloid stimulated proinflammatory responses by peroxisome proliferator-activated receptor alpha[J].Neurochem Int,2001,39(5-6):449-57.
[12]Chen L W,Chang W J,Wang J S,et al.Interleukin-1 mediates thermal injury-induced lung damage through c-Jun NH2-terminal kinase signaling[J].Crit Care Med,2007,35(4):1113-22.
[13]隋海娟,金 英,潘月星等.吡格列酮对脂多糖引起大鼠大脑皮质神经元损伤的保护作用[J].中国药理学与毒理学杂志,2009,23(6):423-30.
[13]Sui H J,Jin Y,Pan Y X,et al.Protective effects of pioglitazone on lipopolysaccharide-induced neurotoxicity in the cultured cortical neurons[J].Chin J Pharmacol Toxicol,2009,23(6):423-30.
[14]王 蕊 ,金 英 ,闫恩志,等.吡格列酮对谷氨酸诱导皮质神经元损伤保护作用及其抑制JNK信号的机制[J].中国药理学通报,2010,26(3):362-7.
[14]Wang R,Jin Y,Yan E Z,et al.Pioglitazone protects cortical neurons from glutamate induced neurotoxicity via inhibiting the JNK pathway[J].Chin Pharmacol Bull,2010,26(3):262-7.
[15]Saha R N,Pahan K.Regulation of inducible nitric oxide synthase gene in glial cells[J].Antioxid Redox Signal,2006,8(5-6):929-47.
[16]Saha R N,Pahan K.Signals for the induction of nitric oxide synthase in astrocytes[J].Neurochem Int,2006,49(2):154-63.
[17]Pang H Y,Liu G,Liu G T.Compound FLZ inhibits lipopolysaccharide-induced inflammatory effects via down-regulation of the TAK-IKK and TAK-JNK/p38MAPK pathways in RAW264.7 macrophages[J].Acta Pharmacol Sin,2009,30(2):209-18.

