我院2004~2007年间革兰阴性菌分离及耐药情况分析
张红艳 吴绪伟 肖谊 黄云昆 李娅
由于抗菌药物的大量使用和细菌变异,致病性耐药菌株越来越多,感染菌对抗菌药物的耐药性成为研究控制感染的一个重大课题,连续性的药敏监测可为临床用药提供更好的指导。感染病原菌中,革兰阴性菌占据重要地位,是临床常见的病原菌和院内感染菌,其耐药性发生变迁并呈严重多重耐药,给临床治疗带来极大挑战。为了解我院临床分离革兰阴性菌的分布及耐药情况,指导临床合理使用抗菌药物,我们对2004年1月至2007年12月我院临床分离的革兰阴性菌进行分析,结果报告如下。
1 资料与方法
1.1 菌株来源 昆明市延安医院2004年1月至2007年12月门诊及住院患者临床标本中分离的革兰阴性菌共2612株。细菌培养和鉴定按《全国临床检验操作规程》,同一患者多次同一细菌按一株计算。
1.2 细菌鉴定和药敏试验 细菌鉴定采用API鉴定系统,药敏试验采用纸片琼脂扩散法(K-B法),结果按NCCLS标准判定。
1.3 质控菌株 采用大肠埃希菌ATCC25922、肺炎克雷伯杆菌ATCC 700603和铜绿假单胞菌ATCC27853。以标准菌株大肠埃希菌ATCC25922和肺炎克雷伯菌ATCC700603分别作为产超广谱β-内酰胺酶(ESBLs)阴性和阳性对照菌。
1.4 数据统计分析 采用世界卫生组织WHONET-5软件分析结果。
2 结果
2.1 病原菌分布情况 分离革兰阴性菌中居前五位的常见病原菌为大肠埃希菌(32.81%)、铜绿假单胞菌(17.38%)、克雷伯菌属(12.28%)、嗜麦芽窄食单胞菌(6.89%)和枸橼酸杆菌(6.01%)。大肠埃希菌和铜绿假单胞菌占分离革兰阴性菌的一半多(50.19%),大肠埃希菌分离率每年均居第1位,并呈逐年增加趋势;铜绿假单胞菌仅在2006稍次于克雷伯菌属而居第3位,其余年份均居第2位。肠杆菌属和非发酵菌在革兰阴性菌感染中占据着首要地位(见表1)。
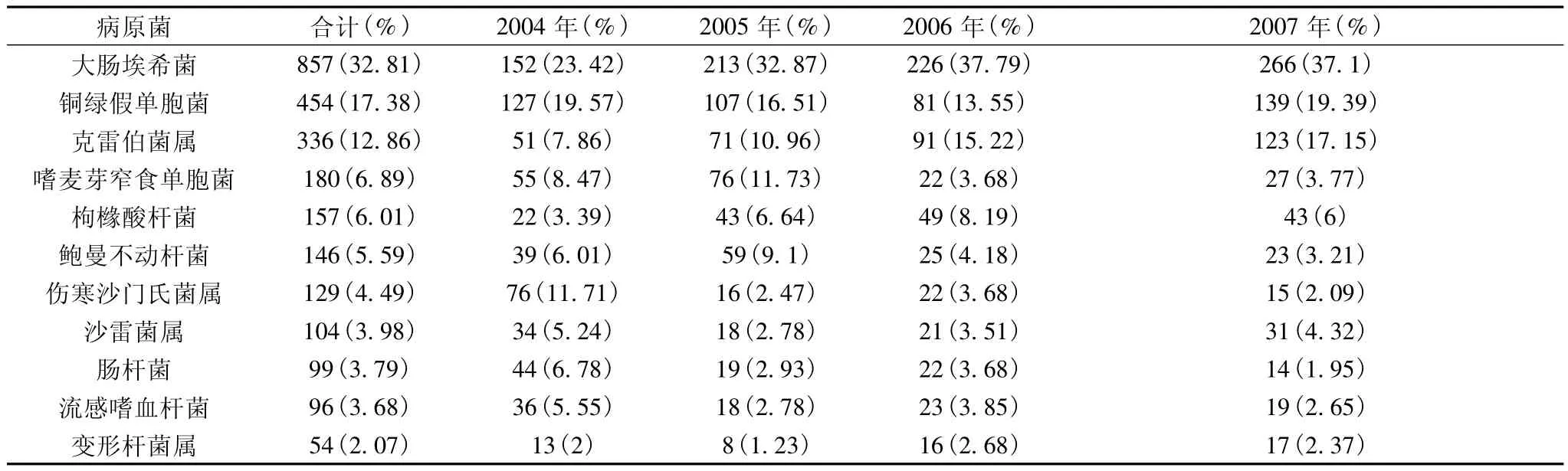
表1 2004~2007年我院临床分离革兰阴性菌的分布
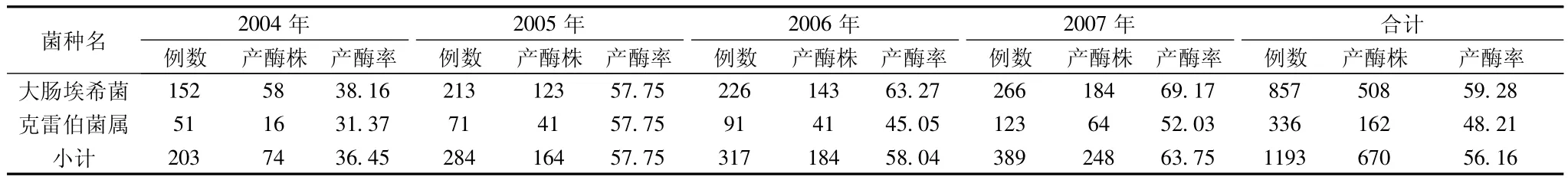
表2 2004~2007年我院产ESBLs大肠埃希菌和克雷伯菌属的分离
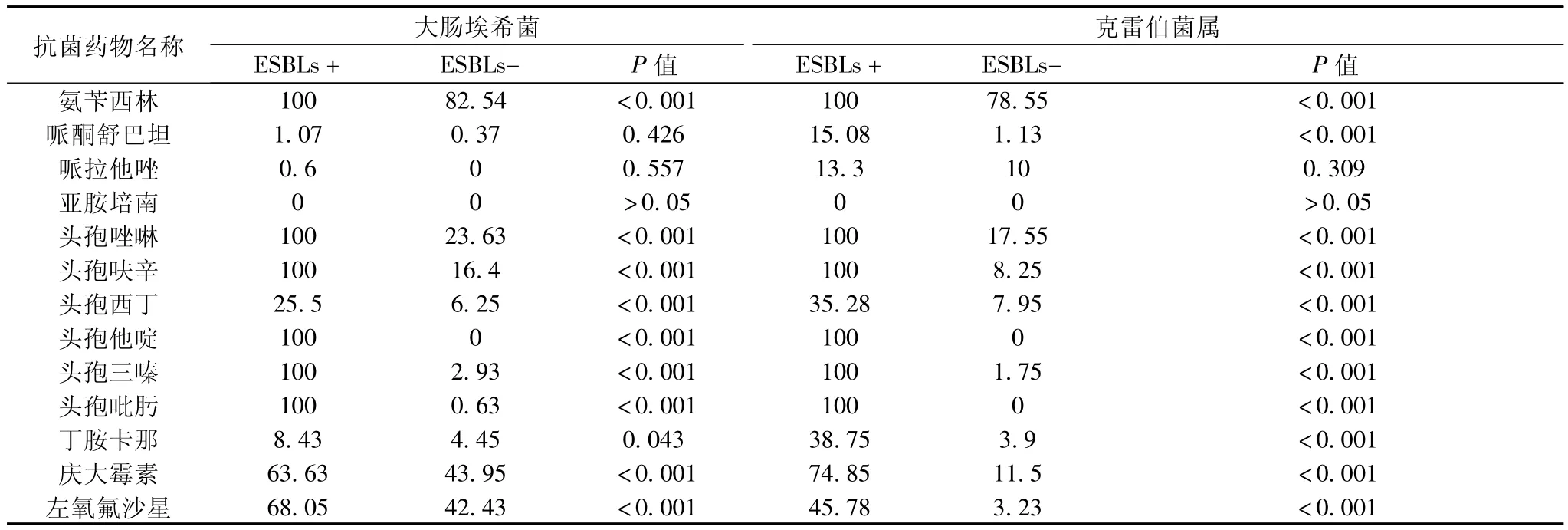
表3 产ESBLs菌与阴性ESBLs菌耐药率比较
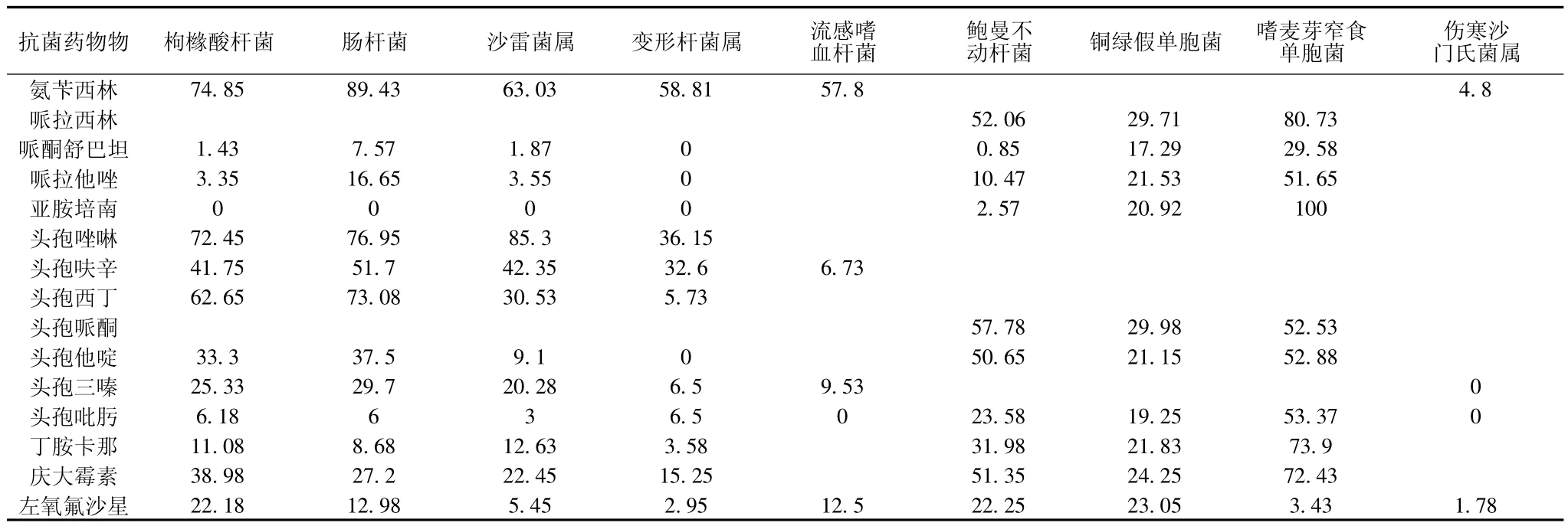
表4 革兰阴性菌对各类抗菌药物物的耐药性
2.2 产ESBLs检出情况 四年间,产ESBLs大肠埃希菌、肺炎克雷伯菌的检出率分别为59.28%、48.21%。ESBLs菌总检出率为56.16%。ESBLs检出率呈逐年上升趋势(详见表2)。
2.3 产ESBLs菌与阴性ESBLs菌耐药率比较见表3。
2.4 其他革兰阴性菌对各类抗菌药物的耐药性见表4。
3 讨论
从2004年1月至2007年12月我院临床标本共分离的革兰阴性菌分布情况看,肠杆菌科细菌和非发酵菌是临床分离的主要革兰阴性杆菌,肠杆菌科细菌又以大肠埃希菌和肺炎克雷伯菌为主;非发酵菌以铜绿假单胞菌、嗜麦芽窄食单胞菌和鲍曼不动杆菌为主。肠杆菌科细菌的分离率高于非发酵菌,与国内报道一致。但我院分离伤寒沙门氏菌属比例升高,居革兰阴性菌的第七位,与本地区连续细菌监测报道一致[1],表明伤寒菌在本地区仍有散在流行,在病原菌感染的诊断中不容忽视,应加强食品卫生管理和预防工作。
产超广谱β-内酰胺酶(ESBLs)是由革兰阴性杆菌产生的最重要的一类β-内酰胺酶,是大肠埃希菌和肺炎克雷伯菌属产生耐药的主要机制。自1983年最先在德国发现一株肺炎克雷伯菌产ESBLs后,世界各国陆续发现了产ESBLs菌株,检出率逐年增多。ESBLs是一种质粒介导的β-内酰胺酶,能赋予细菌水解头孢菌素类、单酰胺类抗菌药物以及青霉素类药物,在体外试验中可使第3代头孢菌素和氨曲南的抑菌环缩小,加入酶抑制剂如克拉维酸、舒巴坦等可使其抑菌环扩大,临床对β-内酰胺类药物耐药,但对碳青霉烯类和头霉烯类药物敏感[2]。本研究也显示ESBLs阳性菌仅对β-内酰胺酶抑制剂复合剂、碳氢酶烯类药物敏感,对头霉素类的头孢西丁和氨基糖甙类的丁胺卡那较敏感,对青霉素类药物、头孢类包括头孢四代头孢吡肟的耐药率高达100%;但克雷伯对酶抑制剂头孢哌酮舒巴坦和哌拉西林他唑巴坦的耐药率也已达到15.08%和13.3%,ESBLs阴性菌除大肠埃希菌对青霉素类、头孢唑啉、庆大霉素、左氧氟沙星耐药率较高,克雷伯菌属对青霉素、头孢唑啉耐药明显外,对其他类药物均较敏感。产ESBLs菌可以通过接合、转化和转导等形式使耐药ESBLs阳性菌基因在细菌间扩散,从而造成严重的医院交叉感染,我院四年间,产ESBLs大肠埃希菌、肺炎克雷伯菌的检出率分别为59.28%、48.21%,ESBLs菌总检出率为56.16%,高于国内报道[3,4],ESBLs检出率呈逐年上升趋势与报道一致。提示我院应该加强耐药菌监测和抗菌药物的合理应用,控制耐药菌的产生和扩散。
革兰阴性杆菌对亚胺培南敏感率最高,肠杆菌科细菌对亚胺培南敏感率100%,但对非发酵菌除对鲍曼不动杆菌敏感外余都有较高的耐药性,对嗜麦芽窄食单胞菌的耐药率达100%,对绿假单胞菌耐药率为20.92%,这与李苏利等[5]报道稍有差异,与严碧琼等报道相接近[6]。对嗜麦芽窄食单胞菌的高耐药性,主要是该菌可产生一种染色体介导的金属β-内酰胺酶,可水解碳青酶烯类抗菌药物而对其呈现天然耐药。碳青霉烯类药物产生β-内酰胺酶是次要耐药机制,外膜通道的缺失是其主要耐药机制,而外膜通道的缺失在非发酵菌中尤为突出有关;有报道,用过亚胺培南抗菌药物物治疗的患者,产生耐药的概率是未使用过的24倍[7],此外,抗菌药物应用产生的选择性压力,是导致细菌耐药率上升的重要因素,细菌耐药率增高与抗菌素使用密度呈正相关[8],碳青霉烯类用药密度的演变导致细菌(铜绿假单胞菌)耐药性的变异正体现了这一结论[9],高密度用药会产生快速耐药。目前药敏试验显示亚胺培南有较强的抗药原性,临床上应严格控制亚胺培南的使用,规范用药,合理用药,控制用药,延缓耐药菌株的产生。
革兰阴性菌对大多数β-内酰胺类抗菌药物有较高的耐药率。青霉素中抗革兰阴性菌较优的氨苄西林除了对伤寒沙门氏菌还保留较好的敏感性外(耐药率4.8%),对其他革兰阴性菌的耐药率最低达57.8%;在部分合成青霉素类中抗菌谱最广、抗菌作用最强、对铜绿假单胞菌有强大抗菌作用的哌拉西林,在本次研究中,对铜绿假单胞菌的耐药率达29.7%,而对鲍曼不动杆菌和嗜麦芽窄食单胞菌的耐药率则达52.06%和80.73%。单纯头孢类抗菌药物则除伤寒沙门氏菌外对大部分革兰阴性菌均表现出较高的耐药性,一代头孢菌素头孢唑啉对变形杆菌耐药率为最低也达36.15%,二代头孢菌素头孢呋辛对流感嗜血杆菌较敏感,耐药率为6.73%,而对肠杆菌等阴性菌耐药率高于32%。头孢三、四代抗菌药物对主要非发酵菌的耐药均较高,其中对铜绿假单胞菌的耐药率为最低也达19.25%,头孢他啶则对沙雷菌属和变形杆菌属敏感;头孢吡肟则对革兰阴性杆菌属细菌保持较好的活性。β-内酰胺酶抑制剂复合剂和碳青霉烯类抗菌药物对大部分革兰阴性菌保持较好的敏感性,但对铜绿假单胞菌和嗜麦芽窄食单胞菌敏感性减低,嗜麦芽窄食单胞菌对头孢哌酮舒巴坦、哌拉西林他唑巴坦的耐药率分别达29.58%和51.65%。广谱β-内酰胺酶是革兰阴性菌产生最普遍的酶,也是其对此类药物耐药的普遍机制,β-内酰胺酶抑制剂复合剂对大部分革兰阴性菌保持较好的敏感性正体现了这一机制。同时,β-内酰胺类抗菌药物在临床上使用最多,其高密度使用带来了细菌高耐药的发生。
氨基糖甙类药物中,丁胺卡那对变形杆菌、肠杆菌和枸橼酸杆菌较敏感外,余均有较高的耐药性。氨基糖苷类钝化酶是革兰阴性菌对此类药物产生耐药的最重要原因,此外整合子在细菌的多重耐药尤其是对氨基糖苷类抗菌药物的耐药中也起着重要作用[10];喹诺酮类药物对大部分革兰阴性菌和嗜麦芽窄食单胞菌保持较好的活性,这可能与此类抗菌药物应用相对较少有关。研究显示[11],革兰阴性菌对氨基糖甙类和喹诺酮类药物的耐药性也与这些药物的使用量密切相关。
本研究表明,革兰阴性菌对大部分抗菌药物有耐药性,存在多重耐药和交叉耐药,产ESBLs酶细菌比例逐年增多,抗感染治疗依然成为新世纪的严峻问题,耐药基因在细菌间的水平传播是细菌获得耐药性的重要机制,加强对抗菌药物物使用的管理,建立耐药性监测系统,根据药敏结果合理选用抗菌药物,减少耐药菌株的传播,提倡抗菌药物的循环使用,以减缓细菌耐药的步伐,达到有效控制感染。同时,有创检查要做好消毒和监管工作,减少医源性病原菌的感染和带来的耐药加重。
[1]杨利荣,单斌,王雪娟,等.昆明地区革兰阴性菌耐药性连续5年监测结果分析.中国呼吸与危重监护杂志,2005,4(4):298-302.
[2]马莉,张桂华,戚凤.革兰阴性菌的耐药机制.中国医药指南,2009,7(11):45-47.
[3]曾贱高,刘利辉,张华,等.1055株革兰阴性杆菌菌种分布及耐药性分析.中国感染控制杂志,2006,5(1):62-64
[4]施保华,楮娜丽,孙胤,等.产超广谱β-内酰胺酶革兰阴性杆菌在医院内的分布及对抗菌药物物耐药性监测.中华医院感染学杂志,2006,16(7):814-816.
[5]李苏利,华川,李杨.临床分离主要病原菌菌群分布及耐药分析.当代医学,2009,15(25):95-96.
[6]严碧琼,高英鸿,冯汉斌,等.321株非发酵革兰阴性杆菌耐药性报道.中华医院感染杂志,2008,18(1):97-98.
[7]林昌锋,邢贻雄,陈如寿.综合性医院病原菌分布及耐药性分析.中华医院感染杂志,2009,19(3):335-337.
[8]Magee JT,Pritchard L,Fitzgerald k,et al.Antibiotic prescribing and antibiotic in community practice:retrospective,1996-1998.Br Med J,1999,19:1231-1232.
[9]殷秀贞,姜思通,辛晓玮.β-内酰胺类抗菌药物用药密度与革兰阴性菌耐药性变异.中国药师,2007,10(9):892-894.
[10]姚芬,黄源春,陈淑贞,等.临床分离革兰阴性菌整合子研究.中国抗菌药物杂志,2009,34(5):313-315.
[11]张丽华,于庆萍,孟昭彦,等.革兰阴性菌的耐药性与抗菌药物物使用量的相关性分析.中国抗菌药物杂志,2006,31(3):1-2.

