一株产低温右旋糖苷酶海洋细菌的筛选和鉴定
吕明生, 王淑军, 房耀维, 焦豫良, 刘 姝, 葛 亮, 吴彬彬, 李 佳
(1. 淮海工学院 海洋学院, 江苏 连云港 222005; 2.江苏省海洋资源开发研究院, 江苏 连云港222001; 3. 上海海洋大学食品学院, 上海 201306)
一株产低温右旋糖苷酶海洋细菌的筛选和鉴定
吕明生1,2, 王淑军1,2, 房耀维1,2, 焦豫良1,2, 刘 姝1,2, 葛 亮3, 吴彬彬1, 李 佳1
(1. 淮海工学院 海洋学院, 江苏 连云港 222005; 2.江苏省海洋资源开发研究院, 江苏 连云港222001; 3. 上海海洋大学食品学院, 上海 201306)
从连云港海域筛选得到一株产低温右旋糖苷酶的菌株 LP621, 经形态特征、生理生化特征以及16S rDNA序列分析和鉴定, 该菌株为Pseudoalteromonas tetraodonis。该菌产生低温右旋糖苷酶的最适作用温度为 30℃, 在 80℃保温 2.5 h后该酶仍具有 40%以上的活性。目前尚无Pseudoalteromonas tetraodonis产生低温右旋糖苷酶的报道。菌株 LP621产生的右旋糖苷酶作用温度低, 耐热性好, 有较大的潜在工业应用价值。
低温右旋糖苷酶; 交替假单胞菌(Pseudoalteromonas tetraodonis); 筛选; 鉴定
右旋糖苷(Dextean)主要是 α-1,6-糖苷键连接的葡萄糖。右旋糖苷酶(Dextranase, α-D-1,6-Glucan-6-D-Glucanohydrolase, EC3.2.1.11), 又叫α-葡聚糖酶,是专一切割右旋糖苷中α-1,6糖苷键的水解酶[1]。右旋糖苷酶有很重要的应用价值, 右旋糖苷酶在制糖工业中降解多糖聚合物, 降低多糖的相对分子质量,从而降低糖的黏性[2]。而在口腔疾病研究的领域中,右旋糖苷酶能有效阻滞唾液糖蛋白和黏性葡聚糖所组成的口腔牙菌斑形成, 对龋齿和牙周病的防治具有重要的意义[3]。在血液替代品制造中该酶被用于控制右旋糖苷的水解; 并且可以增强抗菌药物的疗效[4]。
目前国内外报道的产生右旋糖苷酶微生物主要为青霉(Penicilliumsp.)[5-9]、斯达油脂酵母(Lipomyces starkeyi)[10-11]、对角毛壳菌(Chaetomium gracile)[12]、曲霉(Aspergillus ustus)[13]、芽孢杆菌(Bacillussp.)[1]、链球菌(Streptococcussp.)[14-17]均能产生右旋糖苷酶。
根据Margsin 等1991年的定义, 通常把最适催化温度在 30℃左右, 在 0℃左右仍有一定催化效率的酶称为低温酶。低温酶具有最适温度低, 低温下催化活性高, 高温下容易失活等性质, 在工业生产中可以节约能源及减少中温菌的污染, 这些催化性质使低温酶在工业生产应用中具有很大的优势[18]。目前右旋糖苷酶主要分离于人的口腔、陆地及温泉的微生物, 大部分酶为中温酶, 最适温度大多为 50℃。低温酶主要来源于低温生态环境如海水、海底沉积物、冰川、高山、南北极的低温微生物产生, 随着陆地资源的不断开发而面临枯竭, 近年来人们逐渐将海洋微生物作为获得低温蛋白酶的新来源。目前国内外对海洋微生物产右旋糖苷酶的研究尚未见报道。
在本研究中, 作者从连云港海域贝类中筛选到一株产生低温右旋糖苷酶的海洋细菌, 初步研究表明酶的最适作用温度为 30℃; 对该菌株的生理生化特征和分子鉴定进行了研究, 鉴定为交替假单胞菌(Pseudoalteromonas tetraodonis)LP621。本研究为海洋细菌低温右旋糖苷酶的进一步研究和开发奠定了基础。
1 材料和方法
1.1 样品采集
连云港海州湾海域、港口及远洋捕捞船采集各类海鱼、贝类、海水和海泥。
1.2 培养基
2216E培养基: 蛋白胨 0.5%, 酵母粉 0.1%, 陈海水配制, pH 8.0。初筛培养基: 蛋白胨1%, 牛肉膏0.5%, 右旋糖苷 0.2%, 琼脂 2%, 陈海水配制, pH 8.0。复筛培养基: 蛋白胨1%, 牛肉膏0.5%, 右旋糖苷0.2%, 陈海水配制, pH 8.0。产酶培养基: 酵母粉0.1%, 蛋白胨0.1%, 右旋糖苷 1%, 陈海水配制, pH 8.0。微量盐溶液(g/L): VOSO4·2H2O 0.005, LiCl 0.05,H3BO30.1, NiCl2·6H2O 0.01, BaCl2·2H2O 0.005,CuSO4·5H2O 0.01, ZnSO4·7H2O 0.1, CoCl2·6H2O 0.005, MnCl2·4H2O 0.2, Na2MoO4·2H2O 0.1, KBr 0.05,KI 0.05, NaF 0.05, Al2(SO4)30.05, H2WO40.005,SrCl2·6H2O 0.005。
1.3 菌株的筛选
海泥直接取1 g放入50 mL 2216E培养基中, 海鱼、贝类将内脏剪碎后放入无菌海水浸泡过夜, 过滤后取1 mL上清放入2216E培养基中, 20℃、180 r/min培养2~5 d。选取合适的培养液的稀释液涂布初筛培养基, 20℃培养3~4 d, 用Simonson快速透明圈筛选法进行筛选有透明圈的单菌落[19]。挑取有透明圈的单菌落菌株接入复筛培养基, 20℃、180 r/min培养2 d, 10 000 r/min离心15 min取上清液测定酶活力大小。选出透明圈大和酶活力高的菌株进行下面试验。
1.4 菌株生长特性
1.4.1 种子液培养
菌种接种到 2216E培养基中, 转速 180 r/min,装液量20%, 培养16 h。
1.4.2 温度对菌体生长的影响
种子液2%接种于2216E培养基, pH 8.0, 转速180 r/min, 装液量20%, 在不同温度(4~37℃)下培养,于A600下测定在不同时间的细胞浓度, 同时将菌株放在0℃下培养观察其生长状况。
1.4.3 pH对菌株生长的影响
pH范围5.0~11.0, 在最适温度下培养36 h, 其余条件同1.4.2, 为了防止培养过程中pH的变化, 加入到2216E培养基至终浓度为10 mmol/L的缓冲液: pH5.0~6.0用MES缓冲液, pH7.0用PIPES缓冲液, pH8.0用HEPES缓冲液, pH 9.0~11.0直接用NaOH调[20]。
1.4.4 NaCl质量分数对菌株生长的影响
培养基用微量盐溶液配制(不含 NaCl), NaCl质量分数 0~14%, 在最适温度和 pH培养, 其余条件同 1.4.2。
1.5 菌株生理生化特性
按照 Bergey’s Manual of Systematic Baceriology(second edition)[21]的方法进行各种生理生化反应试验。
1.6 16S rRNA基因序列分析
抽提细菌基因组DNA, 菌株 16S rRNA基因全长序列 PCR 扩增参照文献[22]进行。正向引物 P1:5′-GAGAGTTTGATCCTGGCTCAG-3′, 反向引物 P2:5′-CGGCTACCTTGTTACGAC-3′。PCR 产物纯化后由上海生物工程公司测序。将所测得的16S rRNA基因序列与 GenBank数据库中的已有序列进行 Blast分析, 从GenBank中选择近缘菌株的16S rRNA基因序列, 采用 Bioedit软件程序进行序列分析并用Neighbor- Joining法构建系统发育树, 以确定该菌株的分类地位。
1.7 菌株低温右旋糖苷酶研究
1.7.1 酶液制备
将种子液以 2%的接种量接种于产酶培养基,180 r/min, 25℃培养24 h, 10 000 r/min离心5 min, 沉淀即为菌体; 用pH 7.0的50 mmol/L磷酸钠缓冲液悬浮菌体, 冰水浴中经超声波破碎 5 min, 12 000 r/min离心 10 min, 取上清液即为右旋糖苷酶粗酶液。
1.7.2 酶作用温度和热稳定性
将右旋糖苷酶粗酶液置于不同温度下与底物右旋糖苷发生反应, 测定酶活力。取适量酶液分别在不同温度下保温2.5 h, 每隔0.5到1 h取出一组保温处理的样品, 迅速置于 4℃冰箱内, 待保温结束后统一在标准条件下测定残余酶活, 以未处理酶液的酶活设为100%。
1.8 酶活力测定
将100 µL酶液加入到100 µL 1%的右旋糖苷磷酸钠缓冲液(50 mmol/L, pH 7.0)中, 在30℃水浴反应15 min, 用 3,5-二硝基水杨酸(DNS)法测定还原糖量[23]。酶活力单位定义: 在上述反应条件下, 每分钟催化产1 µg麦芽糖的酶量为一个活力单位。
2 结果与讨论
2.1 菌株的筛选
经过初筛得到 10株能够产生水解透明圈的菌株, 选择水解圈较大, 生长良好的5株菌进行摇瓶复筛, 分别测定24、48 h发酵液酶活力, 结果发现菌株 LP621产生的酶活力最高。菌株 LP621为革兰氏阴性杆状菌, (2.2~2.7)μm×(0.7~1.3)μm。在初筛平板上菌落形态为直径4 ~7mm, 乳白色、湿润、边缘光滑、中间突起、菌落周围有明显的透明圈,见图1。
图1 菌株LP621在初筛平板上形成的透明圈Fig. 1 The clear zone on the screening plate formed by strain LP621
2.2 菌株的生长特性
2.2.1 温度和时间对菌株生长的影响
菌株LP621在0℃能生长, 但生长缓慢, 菌株的最适生长温度为 25℃, 生长温度范围为 4~37℃, 该菌株是适冷菌。如图 2所示, 该菌株在 15℃时生长较为缓慢, 延滞期较长, 生物量较少; 随着温度的升高, 生长速率加快, 当培养温度达到 25℃后, 生物量最高, 但培养温度高于 25℃延滞期逐渐变短, 生物量减少。菌株 LP621最适生长温度为25℃, 10 h进入对数期, 24 h进入平衡期。

图2 温度对菌株LP621生长的影响Fig. 2 Effect of temperature on the growth of strain LP621
2.2.2 pH对菌株生长的影响
菌株LP621菌株生长pH为6.0~11.0, 在pH低于6时不生长, 最适pH为10.0(图3)。
2.2.3 NaCl质量分数对菌株生长的影响
菌株 LP621生长 NaCl质量分数为 0.5%~12%,不加 NaCl菌株不生长, 其最适生长 NaCl质量分数为 7%(图 4)。
2.3 菌株LP621的生理生化反应

图3 pH对菌株LP621生长的影响Fig. 3 Effect of pH on the growth of strain LP621
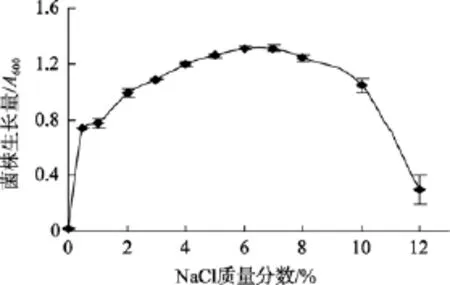
图4 NaCl质量分数对菌株LP621生长的影响Fig. 4 NaCl concentration on the growth of strain LP621

表1 菌株LP621的生理生化特性Tab. 1 Physiological and biochemical properties of strain LP621
菌株 LP621无氯化钠不能生长, 是嗜盐菌, 能利用葡萄糖、乳糖、甘露糖、蔗糖、半乳糖、鼠李糖、纤维二糖、糖原、淀粉, 具体见表1。通过Bergey’s Manual of Systematic Bacteriology(second edition)分析比较, 初步鉴定该菌株为交替假单胞菌属(Pseudoalteromonassp.)的细菌。
2.4 16S rRNA基因分析
将菌株 LP621的 16S rRNA基因序列提交GenBank数据库(登录号是 EU849123), 通过 16S rDNA序列同源性比较, 可以初步确认该菌为交替假单胞菌属(Pseudoalteromonas)。将亲缘关系较近的菌株16S rDNA应用MEGA软件进行多重比较, 用中邻接法(Neibor-joining method)建系统进化树(图 5),从进化树可以看出菌株LP621与Pseudoalteromonas tetraodonisDQ520896亲缘关系最近, 且在一个分支中, 进一步证明菌株 LP621属于交替假单胞菌属。交替假单胞菌(又称假交替单胞菌)是新建立的一个海洋细菌属,它独特的生物学特性引起了越来越多研究者的关注, 目前在世界范围海洋中, 包括南极洲严寒海洋环境中分离到多株交替假单胞菌, 已经鉴定到种的有P. tunicata、P. agarolytic和P. bacteriolytica等30多种, 每年都有新种发现[24-25]。目前尚未见交替假单胞菌属产低温右旋糖苷酶的报道。
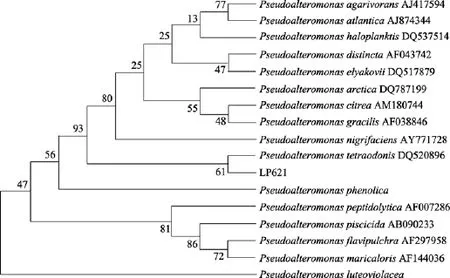
图5 以16 S rDNA序列为基础的系统发育树Fig. 5 A phylogenetic relationship based on 16S rDNA
2.5 菌株 LP621右旋糖苷酶的作用温度和热稳定性
目前交替假单胞菌产生低温酶主要有脂肪酶、琼脂糖酶、α-半乳糖酶、DNA连接酶、蛋白酶、纤维素酶和淀粉酶等[25-31]。
菌株LP621产生的右旋糖苷酶的最适作用温度为30℃, 0℃仍有45%的酶活力, 是低温酶, 见图6。酶的热稳定性较好, 如在50℃下保温2.5 h后酶活仍能保持65%以上, 80℃保温2 h后该酶依然有58%的活性, 2.5 h后该酶仍具有40%以上的活性, 见图7。
据目前报道的右旋糖苷酶中, 酶的最适作用温度多在50℃左右[1,5,8,13-14], 仅见Millson在2007年报道的斯达油脂酵母(Lipomyces starkeyi)重组右旋糖苷酶的最适作用温度为30℃[11]。关于右旋糖苷酶热稳定性研究不多, 仅见程秀兰[13]在1992报道的焦曲霉(Aspergillus ustus)产生的右旋糖苷酶在50℃保温30分钟酶活力损失55%[13]; 菌株LP621产生的右旋糖苷酶50℃下保温2.5 h后酶活仍能保持65%以上。低温酶与中温酶相比有以下特点: (1)酶的最适反应温度较同功能的中温酶低0℃~30℃; (2)在较低温度下(<40℃), 酶的转换数(Kcat)或生理系数(Kcat /Km)高于来自中温菌中的同类酶; (3)低温酶的热稳定性差[32]。据文献报道[31-34]大多右旋糖苷酶在高于50℃丧失大部分的酶活。因此菌株 LP621产生的右旋糖苷酶作用温度低, 耐热性较好, 具有较好的应用前景。
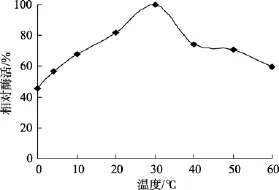
图6 酶作用温度对酶活性的影响Fig. 6 Effect of temperature on the activity of dextranase

图7 温度对酶热稳定性的影响Fig. 7 Effect of temperature on the stability of dextranase
[1]Khalikova E, Susi P, Usanov N, et al. Purification and properties of extracellular dextranase from aBacillussp. [J]. J Chromatogr B, 2003, 796(2): 315-326.
[2]Eggleston G., Monge A. Optimization of sugarcane factory application of commercial dextranases[J].Process Biochem, 2005, 40(5): 1881-1894.
[3]Marotta M, Martino A, Rosa A D, et al. Degradation of dental plaque glucans and prevention of glucan formation using commercial enzymes[J]. Process Biochem,2002, 38(1): 101-108.
[4]程秀兰, 孙晋武, 国杨敬, 等. 淡紫拟青霉右旋糖酐酶的形成条件[J]. 微生物学报, 1992, 32 (5): 334-339.
[5]Aslan Y, Tanriseven A. Immobilization ofPenicillium lilacinumdextranase to produce isomaltooligosaccharides from dextran[J]. Biochem Eng J, 2007, 34(1): 8-12.
[6]Betancourt L H, García R, González J, et al. Dextranase(α-1,6 glucan-6-glucanohydrolase) fromPenicillium minioluteumexpressed inPichia pastoris: two host cells with minor differences in N-glycosylation[J].FEMS Yeast Res, 2001, 1(2): 151-160.
[7]Anna M L, Rolf A, Jerry S, et al. Dextranase fromPenicillium minioluteum:reaction course, crystal structure, and product complex[J]. Structure, 2003,11(9): 1111-1121.
[8]Pleszczyńska M, Rogalski J, Szczodrak J, et al. Purification and some properties of an extracellular dextranase fromPenicillium notatum[J], Mycological Res,1996, 100(6): 681-686.
[9]Abdel-Naby M A, Ismail A S, Abdel-Fattah A M, et al.Preparation and some properties of immobilized Penicillium funiculosum 258 dextranase[J], Process Biochem, 1999, 34: 391-398.
[10]Chen L, Zhou X, Fan W, Zhang Y, et al. Expression,purification and characterization of a recombinant Lipomyces starkey dextranase in Pichia pastoris[J].Protein Expr Purif, 2008, 58(1): 87-93.
[11]Millson S H, Evans I H. Multiple dextranases from the yeastLipomyces starkeyi[J], Antonie van Leeuwenhoek,2007, 92: 399-404.
[12]Hattori A, Ishibashi K, Minato S. The purification and characterization of the dextranse ofChaetomium gracile[J], Agri Bio Chem, 1981, 45(11): 2409-2416.
[13]程秀兰, 孙晋武, 王海燕, 等. 焦曲霉右旋糖酐酶的纯化和性质[J], 微生物学报, 1992, 32(3): 218-226.
[14]蒋丹, 仇元新, 胡涛, 等. 口腔链球菌右旋糖酐酶分子结构和功能的研究进展[J], 国际口腔医学杂志,2008, (3): 249-251.
[15]Ohnishi Y, Kubo S, Ono Y, et al. Cloning and sequencing of the gene coding for dextranase fromStreptococcus salivarius[J], Gene, 1995, 156(1): 93-96.
[16]Russell R R, Ferretti J J. Nucleotide sequence of the dextran glucosidase (dexB) gene ofStreptococcus mutans[J]. J Gene Micro, 1990, 136(5): 803-810.
[17]Kim Y M, Seo M Y, Kang H K, et al. Construction of a fusion enzyme of dextransucrase and dextranase: Application for one-step synthesis of isomalto-oligosaccharides[J], Enzy Micro Tech , 2009, 44(3): 159-164.
[18]Cavicchioli R, Siddiquia K S, Andrewsb D, et al. Low temperature extremophiles and their applications[J]. Current Opinion in Biotechnology. 2002. 13(3), 253-261.
[19]孙晋武. 右旋糖酐酶及其应用[J]. 生物工程进展,1986, 4: 35-41.
[20]Jolivet E, Corre E, L, Haridon S, et al.Thermococcus marinussp. nov., andThermococcus radiotoleranssp.nov., two hyperthermophilic archaea from deep-sea hydrothermal vents that resist ionizing radiation[J].Extremophiles, 2004, 8: 219-227.
[21]George M G, JμLia B, Timothy G L. Bergey’s Manual of Systematic Bacteriology (second edition) [M]. 2004:467-478.
[22]Kuwahara T, Norimatsu L, Nakayama H, et al. Genetic variation in 16S-23S rDNA internal transcribed spacer regions and the possible use of this genetic variation for molecular diagnosis of bacteroides species[J]. Micro Immunol, 2001, 45(3): 191.
[23]王镜岩, 朱圣庚, 徐长法.生物化学[M]. 北京: 高等教育出版社, 2004.
[24]Al Khudary R, Stösser NI, Qoura F, Antranikian G.Pseudoalteromonasarcticasp. nov., an aerobic,psychrotolerant, marine bacterium isolated from Spitzbergen[J]. 2008, 58(9), 2018-2024.
[25]Yu Y, Li H, Zeng Y, et al, Extracellular enzymes of cold-adapted bacteria from Arctic sea ice, Canada Basin[J]. Polar Biology, 2009, 32(10): 1539-1547.
[26]Vera J, Aluarez R, Murano E, et al. Identification of a Marine AgarolyticPseudoalteromonasIsolate and Characterization of Its Extracellular Agarase[J]. Appl Emirom Microbiol, 1998, 64(11): 4378-4383.
[27]Bakunina I Y, Sova V V, Nedashkovskaya O I, et al.Alpha-galactosidase of the marine bacteriumPseudoalteromonassp. KMM701[J]. Biochemisty (Masc),1998, 63(10): 1209-1215.
[28]Ceorlette D, Jonsson Z O, Van Petegem F, et al. A DNA ligase from the psychrophilePesudoalteromonas haloplankitisgives insights into the adaptation of proteins to low temperatures[J]. Eur J Biochem, 2000,267(12): 3502-3512.
[29]李丹, 陈丽, 李富超, 等. 一株海洋细菌Pseudoalteromonas flavipulchraHH407产低温碱性蛋白酶的筛选与生长特性的研究[J]. 食品与生物技术学报, 2007, 26(6): 74-80.
[30]吕明生, 吕凤霞, 房耀维, 等. 低温纤维素酶产生菌的筛选、鉴定及酶学性质初步研究[J]. 食品科学,2007, 28(12): 235-239.
[31]刘红飞, 吕明生, 王淑军, 等. 产低温淀粉酶海洋细菌Pseudoalteromonassp. GS230发酵条件与酶学性质的研究[J]. 中国酿造, 2008, 13: 13-18.
[32]朱非, 王珊, 周培瑾, 低温酶冷适应的分子机制及其在生物技术中的应用[J]. 微生物学报, 2002, 42(5):640-644.
[33]Marx J C, Collins T, Amico S D, et al. Cold-adapted enzymes from marine Antarctic microorganisms[J].Marine Biotechnology, 2007, 9(3): 293-304.
[34]徐庆强, 张志明, 王延明, 等. 产碱性纤维素酶海洋细菌的筛选、鉴定及酶学性质研究[J]. 海洋科学,2009, 33(7): 1-5.
Screen and identification of a marine psychrotrophic bacterium strain producing cold-adapted dextranase
LÜ Ming-sheng1,2, WANG Shu-jun1,2, FANG Yao-wei1,2, JIAO Yu-liang1,2,LIU Shu1,2, GE Liang3, WU Bin-bin1, LI Jia1
(1. College of Marine Science and Technology, Huaihai Institute of Technology, Lianyungang 222005, China;2. Jiangsu Marine Resource Development Research Institute, Lianyungang 222001, China; 3. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
Nov., 5, 2010
cold-adapted dextranase;Pseudoalteromonas; Isolation; Identification
Strain LP621 producing cold-adapted dextranase was isolated from sea mud in Lianyungang seaside.Based on the 16S rDNA gene sequence and morphological, biochemical and physiological characteristics, the isolate was classified asPseudoalteromonas tetraodonis. Strain LP621 produced cold-adapted dextranase with an optimal temperature at 30℃. Forty percent of the dextranase remained active after incubation at 80℃ for 2.5 h. No work onPseudoalteromonas tetraodonisproducing cold-adapted dextranase has been reported so far. The dextranase showed high activity at low temperature and better thermostability, and may have a potential value to industrial application.
Q93-3
A
1000-3096(2011)05-0032-06
2010-11-05;
2011-01-22
国家863计划项目(2011AA09070302); 江苏省海洋生物技术重点建设实验室开放课题项目(2008HS008); 连云港市自然科学基金项目(ZH200801)
吕明生(1963-), 男, 安徽旌德人, 副教授, 从事海洋生物技术研究, 电话: 0518-85895421, E-mail: mingshenglu@hotmail.com
梁德海)

