云南省2006-2010年狂犬病病毒N和G基因分子结构特征分析*
张文东,赵焕云,吕 粤,程万明,岳 亮,张应国,张富强
云南省2006-2010年狂犬病病毒N和G基因分子结构特征分析*
张文东1,赵焕云1,吕 粤1,程万明1,岳 亮1,张应国1,张富强2
目的了解云南省狂犬病毒的流行情况以及街毒株N、G基因结构特征,为有效控制狂犬病疫情提供初步科学依据。方法对云南省2006-2010年10株狂犬病街毒株N、G基因进行全基因克隆、测序,并与已知国内外代表毒株核苷酸及推导氨基酸进行序列比对及系统发育分析。结果序列分析表明所研究的10个云南毒株与Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ型代表毒株N、G基因核苷酸序列同源性分别为72.1%~78.5%、58.4%~71.0%,与基因Ⅰ型毒株序列同源性为85.2%~90.1%、82.7~99.6%,云南毒株之间核苷酸序列同源性为89.3%~99.2%、86.0~99.6%。云南10个毒株均为基因Ⅰ型和血清1型毒株,分为2个进化分支,除YNTC06与GXN119和HM88单独属于分支Ⅲ外,其余云南毒株均分布在分支Ⅰ上,且进一步分为3个小亚分支。遗传进化分析表明,各毒株氨基酸位点均存在不同程度的变异,其中YNTC06在360、369、375等多个NP抗原位点存在变异;云南毒株在GP330、333位毒力决定位点未发生变异,均为强毒株。结论云南狂犬病毒属于基因Ⅰ型,存在2个分支;云南狂犬病毒NP和GP存在特异性氨基酸变异位点,其基因结构及变异、亚组群划分与地理位置无相关性。
狂犬病毒;核蛋白基因(N);糖蛋白基因(G);分子结构特征
狂犬病(Rabies)是由狂犬病毒(Rabies virus, RV)感染引起的一种人畜共患传染病[1],全世界每年报告的狂犬病死亡人数约有55 000例,亚洲和非洲是人狂犬病发生最为严重的地区,占全世界总死亡人数的99%[2]。我国属狂犬病高发国家,人狂犬病95%以上由犬咬伤引起,2006-2009年因狂犬病死亡人数平均每年在3 000人左右。云南省是狂犬病高发区,近几年来不断出现“疯狗”咬人事件,已成为云南的公共卫生问题和社会问题。为了解云南省狂犬病病毒遗传特点和进化规律,2006-2010年我们对本实验室确定的10株狂犬病病毒株N和G基因进行RT-PCR扩增、克隆、测序,并与已知国内外代表毒株进行序列比对和系统发育分析,以期阐明云南狂犬病毒株N和G基因结构特征及与已知毒株的遗传相关性,为云南狂犬病病毒分子流行病学、致病机制等方面的研究奠定基础,同时为云南狂犬病防控提供病原学依据。
1 材料与方法
1.1 狂犬病病毒街毒样品 对云南省动物疫病预防控制中心收集的2006-2010年疑似狂犬病的犬脑组织和棉拭子进行RT-PCR和套式PCR检测,根据不同地域和时间选出10份具有代表性的阳性样品。详细信息见表1。
1.2 质粒与菌种 大肠杆菌DH5α感受态细胞,由本实验室制备、保存;p MD18-T Vector购自宝生物工程(大连)有限公司。
1.3 主要试剂 病毒RNA/DNA提取试剂盒(Body Fluid Viral DNA/RNA miniprep Kit)购自Axygen公司;DH5a感受态快速制备试剂盒、Ta KaRa One Step RNA PCR Kit(AMV)、DL2000DAN Marker均购自宝生物工程(大连)有限公司;DNA胶回收试剂盒及小量质粒柱式提取试剂盒购自上海华舜生物工程有限公司。氯仿、异丙醇采用分析纯试剂。

表1 10份阳性样品时间和地域分布Table 1 Distribution of 10 positive samples by time and geography
1.4 引物设计与合成 根据已知狂犬病毒N基因和G基因测序数据,参照近年国外发表的引物序列,在线设计(http://www.yeastgenome.org/cgibin/web-primer)N、G 基因克隆引物(表2)。质粒测序引物参照试剂手册提供的序列。由宝生物工程(大连)有限公司合成。
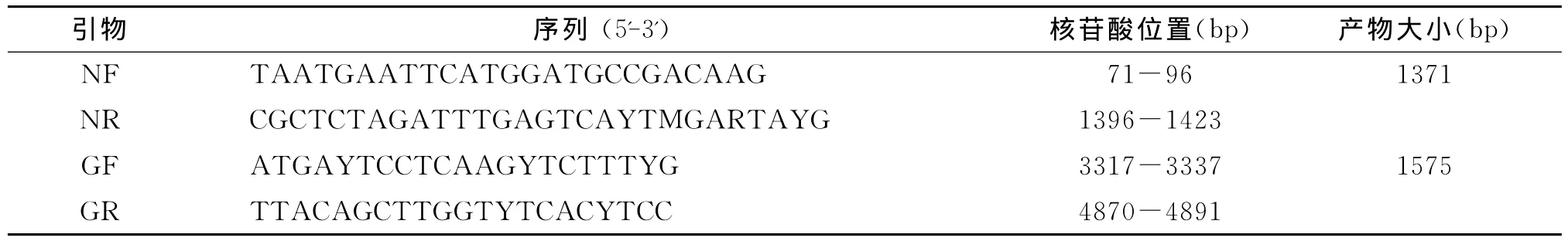
表2 N和G基因克隆引物Table 2 Oligonucleotide primers used in N and G gene cloning
1.5 核酸提取 采用病毒RNA/DNA提取试剂盒,参照操作手册,分别提取组织样品、弱毒疫苗(阳性对照)、健康组织样品(阴性对照)的总RNA,加RNA酶抑制剂后-80℃保存备用。
1.6 狂犬病病毒的检测 根据本实验室已建立的狂犬病病毒检测方法,经RT-PCR及套式PCR扩增后,产物经电泳分离,凝胶成像仪系统观察结果,确定阳性样品。
1.7 N和G基因的扩增、克隆 采用N、G基因克隆引物,RT-PCR扩增N和G基因,产物经电泳分离,凝胶切割纯化,定量,确定目的基因浓度后,按T载体克隆试剂盒提供的手册进行克隆反应。
1.8 重组质粒构建和鉴定 取10μL克隆反应物转化DH5α感受态细胞后,涂布Ampcilin抗性平板过夜,挑取孤立的白色菌落,采用PCR鉴定阳性菌落。阳性菌落增殖培养后,提取质粒,再经PCR进行重组质粒鉴定,-20℃保存。
1.9 序列分析 阳性重组质粒送北京三博科技有限公司进行测序。采用DNAMAN Version 5.2.2软件进行序列比对和系统发育分析。
2 结 果
2.1 狂犬病病毒检测及N、G基因扩增 对收集到的2006-2010年疑似狂犬病的犬脑组织和唾液棉拭子进行RT-PCR和套式PCR检测,对筛选出的10份阳性样品用N、G基因测序引物进行一步法RT-PCR扩增,然后对产物进行凝胶电泳,与DL2000 DNA Marker相比较,扩增出与预期片段大小相符片段,结果见图1。

图1 云南狂犬病毒株N和G基因RT-PCR结果Fig.1 RT-PCR results of N and G genes of Yunnan rabies virus strains M.DL2 000 DNA marker;1、2、3 N gene;4、5、6 G gene;1、4:positive control;3、6:negative control
2.2 重组质粒的构建与鉴定 N、G基因与18-T载体连接转化后,涂布Ampcilin抗性平板过夜培养后菌落数分别为41个和37个,空白质粒自连接对照板无菌落生长。分别挑取3个孤立菌落,采用目的片段引物和质粒引物经PCR鉴定均为阳性。结果见图2。
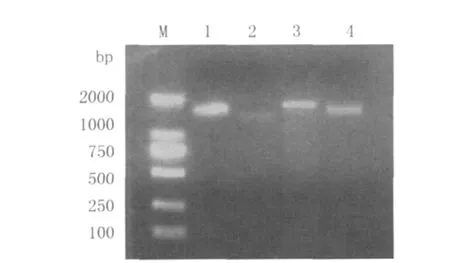
图2 N、G基因重组质粒PCR鉴定结果Fig.2 PCR results of N and G genes Recombinant Plasmid M.DL2 000 DNA marker;1、2:N gene Recombinant Plasmid;3、4:G gene Recombinant Plasmid;1、3 M13-47/RV-M Primer;2、4:NF/NR、GF/GR Primer
2.3 序列比对及系统发育分析 采用DNAMAN Version 5.2.2软件,以狂犬病毒基因I型中的疫苗株作为参考毒株,以Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ基因型代表毒株作为外群对云南省2006-2010年间不同地州分离到的10株狂犬病毒株进行序列比对和系统发育分析。
2.3.1 N基因序列比对及系统发育分析 所测10个云南毒株与Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ型代表毒株N基因核苷酸序列同源性为72.1%~78.5%,与PV、CTN及3aG株的同源性为85.2%~90.1%,云南毒株之间的同源性为89.3%~99.2%,属于基因Ⅰ型和血清1型毒株(参考毒株见表3)。系统发育分析表明,基因Ⅰ型毒株至少存在5~6个独立的进化分支,本研究所测的10个云南毒株除了YNTC06与我国广西(GXN119)毒株和泰国人毒株(HM88)单独属于分支Ⅲ外,其余云南毒株均分布在分支Ⅰ上,且进一步分为3个小的亚分支,其中YNMD06与上海(SH06)、浙江(ZJWx0)毒株属于一个进化亚分支,同 源性为 97.3% ~99.3%;YNH H10、YNZT07与安徽(AHFY1)、湖南(Hu NDK1)、江苏(JSWx1)属于另一亚分支,同源性为97.2%~99.1%;其余云南毒株与我国贵州(GZQx5)、广西(GXY166、GXYue1)等地毒株则属于第三亚分支,同源性为97.3%~99.6%。固定毒株、疫苗毒株、属于不同的进化分支,可划分为不同亚组群(图3)。

图3 狂犬病毒N基因系统发育分析Fig.3 Phylogenetic analysis based on N gene of Rabies virus
2.3.2 G基因序列比对及系统发育分析 所测10个云南狂犬病毒株G基因核苷酸序列同源性为86.0~99.6%,与基因Ⅰ型毒株核苷酸序列同源性为82.7~99.6%,与其它6个基因型代表毒株(Lagosbat5,Mokolacat,Duvenhage,EBLV-1,EBLV-2,ABLV)核苷酸序列同源性为58.4%~71.0%。G基因建立的分子系统进化树与N基因建立的进化树毒株之间呈现出同样的进化关系。云南毒株(YNTC06)与泰国毒株(HM88)G基因核苷酸的同源性为94.7%,属于第Ⅲ分支;其余云南毒株均分布在分支Ⅰ上,其中YNHH10、YNZT07与安徽毒株(AHFY1)同源性高达99.2%~99.6%,立为第一 亚 分 支;YNMD06 与 上 海 (SH06)、江 苏(JSWx1)、浙 江 (ZJWz0)同 源 性 为 99.3% ~99.4%,属 于 另 一 进 化 亚 分 支;YNZT09、YNHH09、YNKM10、YNNJ08、YNQJ07、YNQJ08与贵州(GZQx5)、广西(GXY166、GXYue1)等地毒株属于第三亚分支。从G基因的进化树中发现,各个毒株之间呈现了比较复杂的进化关系,同一基因型的毒株之间形成了更多的平行组群,呈现出平行的进化关系,见图4。

表3 序列比对及系统发育分析中引用毒株Table 3 rabies virus strains in the sequence alignment and phylogenetic analysis
2.4 氨基酸变异位点分析

图4 狂犬病毒G基因系统发育分析Fig.4 Phylogenetic analysis based on G gene of Rabies virus
2.4.1 NP氨基酸变异位点分析 NP至少存在4个抗原区,抗原区Ⅰ、Ⅱ、Ⅲ、Ⅳ分别定位于358~367、76~90、313~337、359~383位区段。通过比对推导的N蛋白氨基酸序列,大多数均为同义变异,除YNTC06和浙江毒株(ZJWZ0)在抗原区Ⅰ的360位氨基酸发生变异外(F→S),其余基因Ⅰ型毒株抗原区Ⅰ未发生变异(表4);云南毒株与其它毒株比较,在抗原区Ⅱ未发生变异;除YNZT09在抗原区Ⅲ的317位发生变异外(C→S),其余基因Ⅰ型毒株在该位点都未发生变异;YNTC06在抗原区Ⅳ的360(F→S)、369(Y→H)、375(T→M)、379(L→V)位存在变异,其余云南毒株在该抗原区未发生差异;NP氨基端对抗原区Ⅳ也存在影响,如当氨基端第13位谷氨酰胺(Q)突变为精氨酸(R)后,会降低单克隆抗体的识别能力,云南毒株NP第13位氨基酸未发生变异。NP具有一个共同的389位丝氨酸(S)磷酸化位点和一个次要的375位苏氨酸(T)磷酸化位点,其存在与否直接影响NP与先导RNA的结合以及病毒基因组的转录和复制。云南毒株中仅YNTC06在375位磷酸化位点存在变异,参考毒株中GXN119和HM88在该位点也存在同样变异(T→M)。
与国内外参考毒株相比,在所测得的10个云南狂犬病毒株中,YNTC06氨基酸位点发生变异最多,其他云南毒株也存在多个氨基酸位点的变异(见表4)。

表4 云南狂犬病毒株NP抗原变异位点Table 4 Mutations of antigen sites on nucleoprotein of rabies virus strains from Yunnan
2.4.2 GP氨基酸变异位点分析 研究表明狂犬病毒G蛋白至少具有3个抗原决定簇,分别为GⅠ(226~231)、GⅡ(34~42、198~200)、GⅢ(330~357),GP的抗原性变化常常是由抗原决定簇某些位点的变异造成的。本研究对3个抗原决定簇内的重要位点进行了比较,发现仅有YNTC06在Ⅱ群中的39位(S→P)及Ⅲ群中的332位(I→V)、355位(V→A)存在变异,其余云南毒株在关键性抗原位点均未发生变异,说明各野毒株抗原性变化不明显。
糖基化是糖蛋白的一个重要特点,不同狂犬病毒糖基化位点的数目和位置不完全相同,可能存在的糖基化位点位于37、70、247、319、465、480位氨基酸。YNTC06的39位氨基酸由丝氨酸(S)变为脯氨酸(P),导致37位糖基化位点消失,仅存在319位这一个糖基化位点,其余云南毒株和国内外参考毒株都有37位和319位两个糖基化位点。
GP的第189~214氨基酸区段可与乙酰胆碱受体(Ach R)结合,与病毒的组织嗜性有关,所测毒株除YNZT07在186位为精氨酸(R)外,其余毒株均为甘氨酸(G);YNTC06在204位为丝氨酸(S),其它云南毒株204位为甘氨酸(G),而通常此位点为丝氨酸(S)、天冬酰胺(N)或天冬氨酸(D)。所测10个云南毒株在330、333位毒力位点未发生变异,均为强毒株。云南毒株 GP信号肽区-2、-5、-16氨基酸位点存在变异;在成熟的G蛋白肽上共有34个氨基酸位点与参考毒株比较存在差异,其中仅YNTC06毒株就有21个位点发生了特异性变异。
3 讨 论
据我国卫生部报道,近几年我国法定公布的传染病中狂犬病发病率居首位,呈急剧上升趋势,自2003年以来,每年报道的病例均在2 500例以上,因此,预防和控制狂犬病已成为目前亟待解决的难题之一。国内外对狂犬病的流行病学及分子流行病学研究报道较多[3-7]。云南省自2007年后陆续有狂犬病病例的报道[8-9],本研究就云南省2006-2010年间的10株狂犬病病毒株N和G基因进行序列分析,根据其N和G基因的核苷酸同源性及建立的遗传进化树,可将云南毒株分为2个进化分支,其中YNTC06单独属于第Ⅲ分支,其余云南毒株均分布在分支Ⅰ上,且进一步分为3个小的亚分支。广西狂犬病分离毒株属划分为3个分支,不同分支毒株间N基因核酸序列同源性小于90%,同一分支毒株间核酸序列同源性大于96%[10],与云南2个分支毒株分析结果一致。
根据推导的N、G蛋白氨基酸序列,对N基因和G基因的主要抗原位点分析表明,这两个基因上的抗原位点都有变异发生,YNTC06毒株在NP抗原区Ⅳ的360、369、375、379位存在变异,其余云南毒株在371、375、379位存在差异。除YNTC06在抗原区Ⅰ的360位发生变异外,其余基因Ⅰ型毒株抗原区Ⅰ未发生变异。除YNTC06毒株在375位(T-M)磷酸化位点存在变异外,其余毒株在389、375位的2个磷酸化位点都未变异。YNNJ08在394(Y→C)、YNZT07在397(G→S)、416(L→P)位T细胞表位发生变异。YNTC06在369(Y→H)、375(T→M)、379(L→V)位B细胞表位发生变异。
YNTC06毒株在GP抗原区Ⅰ未发生变异,抗原区Ⅱ的39位(S→P)及Ⅲ的355位(V→A)存在变异。其余云南毒株抗原区Ⅰ及Ⅱ的关键性位点未发生变异,抗原区Ⅲ的332位氨基酸为异亮氨酸(I),而通常此位点为缬氨酸(V),其它位点未发生变异。YNTC06的39位氨基酸由丝氨酸(S)突变为脯氨酸(P),导致37位糖基化位点消失,仅存在一个糖基化位点(319位)外,其余云南毒株都是有37位和319位两个糖基化位点。云南毒株在GP330、333位毒力位点未发生变异,均为强毒株。
本次所测的10株云南狂犬病毒基因结构及变异、亚组群划分与地理位置无相关性,如在分支Ⅰ中的3个亚分支上,第二亚分支的红河毒株(HH10)和昭通毒株(ZT07)分别位于滇东南和滇东北,第三亚分支的怒江毒株(NJ08)、曲靖毒株(QJ08、QJ09)、昭通毒株(ZT09)、红河毒株(H H09)、昆明毒株(KM10)分别位于滇西北、滇东、滇东北、滇东南、和滇中,且同一地点不同年份毒株却不在一个亚分支上(YNZT07和YNZT09),说明云南狂犬病毒变异频繁,起源复杂,这可能与云南省所处特殊地理位置有关,因为云南省与东南亚发展中国家缅甸、越南、老挝接壤,邻近泰国、柬埔寨、印度等,边民贸易往来频繁,境外动物自由出入。
[1]殷震,刘景华.动物病毒学 [M].2版.北京:科学出版社,1997:779-783.
[2]Organization WH.WHO Expert Consultation on Rabies,2004.first report;WHO technical report series#931.[C].Geneva:World Health Organization,2005:16-20.
[3]徐葛林,Li ku,吴杰,等.中国19个狂犬病病毒街毒分离株N基因的序列分析[J].病毒学报,2002,18(1):48-51.
[4]Meng S L,Yan J X,Xu GL,et al.A molecular epidemiological study targeting t he glycoprotein gene of rabies virus isolates from China[J].Virus Re,2007,124:125-138.
[5]熊毅,罗廷荣,刘棋,等.广西12株狂犬病野毒株的g基因序列测定与分析[J].中国病毒学,2006,21(2):131-135.
[6]Ming P,Du J,Tang Q,et al.Molecular characterization of the complete genome of a street rabies virus isolated in China[J]:Virus Research,2009,143:6-14.
[7]Carnieli P Jr,Castilho JG,Fahl Wde O,et al.Molecular characterization of Rabies Virus isolates from dogs and crab-eating foxes in Northeastern Brazil[J].Virus Research,2009,141:81-89.
[8]赵焕云,张文东,金卫华,等.云南牟定狂犬病诊断及病毒部分N基因测序[J].畜牧与兽医,2007,39(11):56-59.
[9]赵焕云,张文东,金卫华,等.云南4株狂犬病毒N和G基因的克隆及测序[J].中国卫生检验杂志,2008,18(3):413-419.
[10]熊毅,罗廷荣,刘棋,等.广西狂犬病野毒株N基因的测序与分析[J].中国传染病杂志,2007,25(3):147-151.
Molecular characteristics of N and G genes of rabies virus from Yunnan Province during 2006 to 2010
ZHANG Wen-dong,ZHAO Huan-yun,LU Yue,CHENG Wan-ming,YUE Liang,ZHANG Ying-guo,ZHANG Fu-qiang
(Centre for Animal Disease Control and Prevention,Kunming 650001,China)
In order to understand the current prevalence of rabies and the molecular characteristics of rabies virus N and G genes in isolates found in Yunnan Province,the N and G genes of 10 street strains isolated from different regions of Yunnan Province from 2006 to 2010 were sequenced and these sequencing data were used to alignment and phylogenetic analysis with known representative strains.The phylogenic analysis showed that the nucleotide homologies of N and G genes of Yunnan strains with genotypeⅡ,Ⅲ,Ⅳ,Ⅴ,Ⅵ andⅦrepresentative strains were 72.1%-78.5%,58.4%-71.0%,with other strains of genotypeⅠwere 85.2%-90.1%,and 82.7-99.6%,the nucleotide homologies were 89.3%-99.2%,and 86.0-99.6%among the Yunnan strains.All rabies virus strains isolates from Yunnan belonged to genotypeⅠand could be divided into 2 groups,besides YNTC06 belonged to groupⅢ,the other Yunnan strains belonged to groupⅠand divided into 3 subgroups more.Genetic analysis showed that there are some specific mutations of amino acid on nucleoprotein and glycoprotein of Yunnan strains,The amino acid mutations of YNTC06 strain at 360、369、375 et al NP antigenic site,there were no mutation at GP330、333 of Yunnan strains,all of them are strong virus.The gene structure、mutations and subgroup divided of Yunnan rabies virus strains have no relationship with the geographical location.
Rabies virus;Nucleoprotein gene;Glycoprotein gene;Molecular characteristic
1.云南省动物疫病预防控制中心,昆明 650051;2.成都军区疾病预防控制中心,昆明 650032
R373.9
A
1002-2694(2011)10-0871-06
*国家农业公益性行业科研专项(201103008),军队“十一五”科技攻关项目(08G034)
张富强,Email:zfq1968@yahoo.com.cn
2010-11-12;
2011-15-18

