重组角质酶的发酵制备及其对涤纶纤维的表面改性
张瑶,陈晟,吴丹,何淼,朱孔亮,陈坚,吴敬
1 江南大学 食品科学与技术国家重点实验室,无锡 214122
2 江南大学生物工程学院 工业生物技术教育部重点实验室,无锡 214122
涤纶 (Poly (ethylene terephthalate),PET) 是世界上需求量最大的合成纤维之一[1]。作为一种服用性纤维,涤纶具有很多优良的特性,如强度高、弹性好、耐拉伸、抗皱耐磨、抗有机溶剂、耐热耐腐蚀等等。然而,由于涤纶内部分子排列紧密,结晶度高,结构中无高极性基团,因此亲水性较差,这就在很大程度上限制了它的舒适性、可染性等[2-5]。为了改进涤纶的亲水性和染色性,必须对其进行表面改性。传统化学处理方法,需要消耗大量的能源,对生态环境造成严重威胁。近来,生物酶处理作为一种节能降耗、环境友好的纺织品清洁生产技术,已成为国内外染整行业发展的新趋势[3,5-6]。
角质酶作为一种多功能解酯酶,可以水解涤纶表面的酯键,能有效提高织物亲水性,改善纤维品质[2-7]。角质酶用于纺织纤维改性的研究主要以发现最早、研究最为广泛的茄病镰刀菌 Fusarium solani角质酶为研究对象[8-13]。后来的研究发现来自尖孢镰刀菌 Fusarium oxysporum[14-15]、植物病原真菌Pyrenopeziza brassicae[16-17]和腐质霉菌 Humicola insolens[18]的角质酶同样能用于涤纶的改性,提高涤纶纤维的亲水特性。然而真菌来源的角质酶耐热性差、生长周期长、生产成本高等问题使角质酶在纤维改性中的应用受到了限制。本实验室前期成功鉴定了来源于嗜热子囊菌 Thermobifida fusca WSH 03-11的耐热角质酶编码基因,并将该基因克隆表达于E. coli BL21(DE3) 中[19]。重组T. fusca角质酶表现出良好的热稳定性和酸碱抗性,在纺织纤维改性中具有潜在的应用前景[19-20]。
本研究考察了重组大肠杆菌在摇瓶及3 L发酵罐中生产角质酶的调控策略,并探讨了细菌来源角质酶对涤纶纤维表面改性的处理效果。
1 材料与方法
1.1 菌种和培养基
大肠杆菌 BL21(DE3) 含 pET-20b(+)/Tfu_0883重组质粒作为生产菌种。该菌株由江南大学食品科学与技术国家重点实验室构建及保藏。
种子培养基 (g/L):工业级蛋白胨 10,工业级酵母粉5,NaCl 10,氨苄青霉素0.1,pH 7.1。
TB发酵培养基 (g/L):甘油 6,工业级蛋白胨12,工业级酵母粉24,KH2PO42.31,K2HPO43H2O 16.43,氨苄青霉素0.1,pH 7.1。
补料液 (g/L):甘油 500。乳糖诱导液 (g/L):乳糖 200。IPTG诱导液 (mmol/mL):IPTG 0.5。
1.2 材料与试剂
涤纶织物:无锡市益宏化纤有限公司提供,115 g/m2工业级酵母粉购于宜昌安琪酵母有限公司;工业级蛋白胨购于上海西王淀粉糖有限公司;氨苄青霉素购于上海生工生物工程有限公司;亚甲基蓝(上海染料厂);其他常规试剂均购于国药集团化学试剂有限公司。
1.3 培养方法
1.3.1 种子液
将−80 ℃甘油管保存的菌种接100 μL菌液于50 mL (250 mL锥形瓶) 含100 μg/mL Amp的种子培养基中,使用回转恒温调速摇床进行培养;控制转速200 r/min,培养温度37 ℃,初始pH值7.1,培养时间6~8 h。
1.3.2 摇瓶培养
将种子液以5%的接种量加入50 mL (250 mL锥形瓶) TB培养基中,30 ℃、200 r/min摇床培养3 h,当菌体生长到对数生长期 (OD600≈1) 时,加入诱导剂开始诱导。继续培养至7 h,当菌体生长到对数生长期 (OD600≈5) 时添加 0.5%甘氨酸。摇床转速与培养温度不变。
1.3.3 发酵培养
分批培养:将培养好的种子液按 5%接种量接入3 L全自动发酵罐NBS (New Brunswick Scientific Co., Ltd,美国) 中进行发酵培养 (装液量1 L)。向发酵罐中通入无菌空气,通气量1.5 L/min,控制搅拌转速维持溶氧浓度在 20%~30%左右,流加质量浓度为 1 000 g/L的氨水控制发酵培养 pH 在7.0~7.1。5 h后添加0.5%甘氨酸,6 h后加入乳糖至终浓度为2 g/L进行诱导。
补料分批培养:1 L TB培养基中以10%接种量接入种子液后进行分批培养,甘油耗尽后 (溶氧徒然上升) 流加生长培养基,并维持甘油浓度2~3 g/L左右。6 h后开始添加0.5%甘氨酸。当OD600=30时开始流加 2 g/L乳糖诱导液。生长和诱导温度均为30 ℃。整个发酵过程由发酵罐控制系统软件进行在线控制和数据采集。
1.4 分析方法
1.4.1 菌体生物量的测定
采用分光光度计检测菌液定在 600 nm波长处的吸光度值,即OD600,以此测定菌体的生物量。
1.4.2 角质酶发酵液酶活测定
发酵液经12 000 r/min 离心10 min,上清液为粗酶液,用于后续酶活测定。酶活测定采用连续分光光度法。反应液体积为1 mL,包括20 μL粗酶液和 980 μL 50 mmol/L的硫磺脱氧胆酸钠缓冲液(pH 8.0,含50 mmol/L对硝基苯丁酸酯)。20 ℃反应1 min后,在波长405 nm处记录对硝基酚的生成速率。酶活定义:20 ℃时每分钟催化对硝基苯丁酸酯水解生成1 μmol对硝基苯酚的酶量即为一个酶活力单位。
1.4.3 甘油及乳糖浓度测定
安捷伦高效液相色谱 (HPLC),色谱条件为色谱柱:Shodex Sugar SH1011,流动相:0.01 mol/L H2SO4,流速:0.8 mL/min,柱温:50 ℃,进样量:5 μL,检测器:示差折光检测器,检测器温度:30 ℃。
1.5 涤纶的角质酶处理工艺及性能测试
1.5.1 角质酶处理涤纶织物
将1 g 涤纶织物在60 ℃水浴振荡清洗30 min后,按浴比1∶40放入磷酸盐缓冲液 (pH 7) 中。取一定剂量 (400 U) 的角质酶发酵罐培养液上清至上述处理液中,使角质酶最终酶浓度为 10 U/mL;用Triton X-100表面活性剂来增强酶的活性,浓度为0.1% (W/V)。密封置于水浴恒温振荡器中处理3 h,取出纤维,用60 ℃蒸馏水充分洗涤。
1.5.2 涤纶织物的染色
将处理后的涤纶织物于50 ℃振荡水洗1 h后,浸入40 mL染液中染色5 h。取出织物用50 ℃去离子水洗20 min,重复3次,然后在60 ℃烘箱中平衡2 h。
染色条件:亚甲基蓝,浓度0.05 g/L,pH 6.0,浴比1∶40。
1.5.3 测试方法
角质酶处理残液紫外吸光度的测定:用紫外分光光度计测试不同处理时间下 240 nm处的紫外吸光度值。参比样为相同条件下不加入涤纶纤维的角质酶处理液。
润湿性能 (滴水时间) 按AATCC 79-1979测定。
上染率用UV-2100紫外可见分光光度计测定,以空白染浴的吸光值为基准计算上染率。
2 结果
2.1 IPTG和乳糖诱导效果比较
将种子接入种子培养基中37 ℃培养过夜,后接入发酵培养基30 ℃培养至OD600达1.0后,分别用终浓度0.4 mmol/L IPTG和5 g/L乳糖进行诱导 (图1)。从图1中可知,发酵20 h时,无论添加何种诱导剂,菌体生长都达到最大值,此后菌体生长进入平衡期,50 h菌体开始衰亡。IPTG对菌体生长有较明显的抑制作用,而乳糖对菌体生长影响较小。以IPTG或乳糖作为诱导剂,角质酶酶活50 h达最高值,分别为120 U/mL和96 U/mL。由于IPTG价格昂贵并对菌体生长有明显的抑制作用,而乳糖没有毒性,价格低廉,可用于工业化生产,因而本研究选用乳糖作为诱导剂进行后续研究。
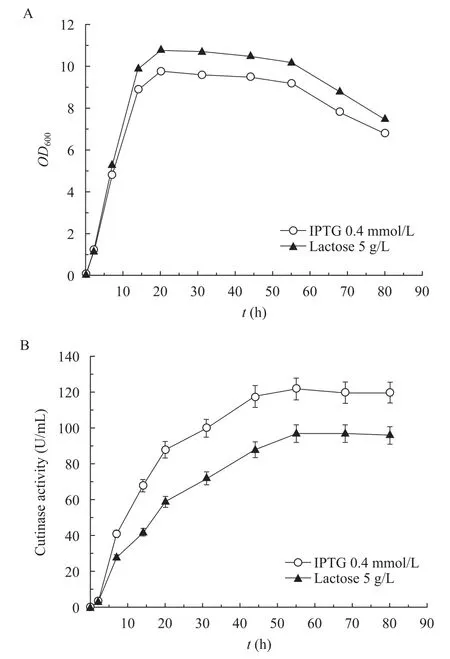
图1 IPTG 或乳糖诱导的重组大肠杆菌生长 (A) 及产角质酶情况 (B)Fig. 1 Growth and cutinase production by IPTG or lactose induction. (A) The growth of E. coli. (B) The cutinase production.
2.2 乳糖浓度及诱导时间对角质酶产量的影响
根据文献报道[21-22],过高或过低的乳糖浓度都会影响酶表达量。为进一步确定合适的乳糖诱导浓度,分别以1~20 g/L不同浓度的乳糖进行诱导。从图2中看出,乳糖浓度为2 g/L时,角质酶的表达量最大,达102 U/mL。随着乳糖浓度的增大,角质酶的表达量逐渐降低,菌体量也下降 (数据未显示),说明高浓度乳糖对菌体生长有一定的抑制作用,这同以往的研究一致[21-22]。
实验考察了在菌体对数生长前期 (OD600≈1)、中期 (OD600≈5) 和后期 (OD600≈8) 分别添加2 g/L乳糖诱导对角质酶产量的影响。结果表明,在菌体对数生长后期加入乳糖诱导,重组角质酶的表达量略高于前期和或中期乳糖诱导的表达量。
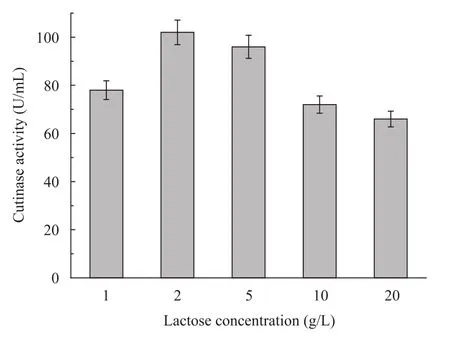
图2 不同乳糖浓度对大肠杆菌发酵生产角质酶的影响Fig. 2 Cutinase production of E. coli by lactose induction at different concentrations.
2.3 甘氨酸对角质酶产量的影响
据文献报道[23],甘氨酸可导致大肠杆菌细胞膜透性的明显增加,能提高重组蛋白的胞外产量和生产强度。程婧等[24]前期实验结果表明在对数生长前期添加甘氨酸能提高蛋白的胞外表达量。为能进一步提高角质酶的产量,考察了甘氨酸对乳糖诱导下的重组大肠杆菌生长及产角质酶的影响。如图 3所示,在菌体生长的对数前期 (OD600≈5) 添加0.5%甘氨酸和终浓度2 g/L乳糖后,菌体生长没有受到明显影响,角质酶酶活持续增加,最终达到128 U/mL。
2.4 分批发酵培养
在摇瓶实验的基础上,在3 L发酵罐内,采用工业级 TB培养基,进一步进行了重组大肠杆菌产角质酶分批发酵培养,结果见图4。发酵培养5 h至OD600≈8时添加0.5%甘氨酸,当进入菌体对数生长后期 (OD600≈12) 时加入终浓度 2 g/L乳糖进行诱导。结果表明,发酵 6 h后培养基中的甘油几乎消耗殆尽,此时溶氧开始上升。但由于乳糖作为诱导剂的同时,本身也是一种碳源,可以被菌体利用[21],因此生物量维持稳定,角质酶的表达量开始逐渐增

图3 甘氨酸对乳糖诱导下大肠杆菌生长及产角质酶的影响Fig. 3 Growth and cutinase production of E. coli by lactose induction and glycine addition.
加。发酵16 h后,酶活快速增长,至发酵28 h时达到最大值,为180 U/mL。
2.5 分批补料发酵培养
在分批发酵生产角质酶的过程中,由于甘油完全不能满足菌体生长需求,所以菌体生物量和产酶量较低。为进一步提高角质酶的产量,进行了补料发酵培养生产角质酶的研究。甘油作为菌体生长的碳源尤为重要,但高浓度的甘油对菌体生长不利,因而将甘油浓度控制到较低水平,可以有效利用原料,解除底物抑制,提高产物水平[25]。本实验中发酵培养约6 h后,待溶氧陡然上升,开始以1.5 g/h的速率补加甘油补料液,随着生物量的增长,逐步提高补料速率。发酵培养且自补料开始,每隔1小时,对发酵液中甘油浓度进行一次测定,使发酵液中甘油浓度维持在2~4 g/L。进入对数生长期后,随着代谢产物的增多,发酵液pH会下降,需加入氨水以维持pH在7左右。此时,也需通入纯氧将溶氧浓度维持在 20%~30%,为菌体生长提供足够的氧气。发酵培养 6~7 h (OD600=15) 后,采用一次性添加的方式,加入0.5%甘氨酸。在对数生长后期,生物量达到OD600=30时,加入乳糖开始诱导。由摇瓶实验结果可知,高浓度乳糖存在抑制效应,故乳糖以0.8 g/h速率进行补加。发酵每隔 1小时,测定一次发酵液中乳糖浓度,使发酵液中乳糖浓度维持在2~3 g/L。结果如图5所示,在整个发酵过程中,随着限制性碳源甘油的加入,OD600值呈线性增加,发酵12 h,OD600达到最大值35,随后OD600保持稳定。角质酶的表达量在诱导8 h后大幅增加,至发酵30 h酶活达到最高,为506 U/mL,比分批发酵培养提高了2.81倍。
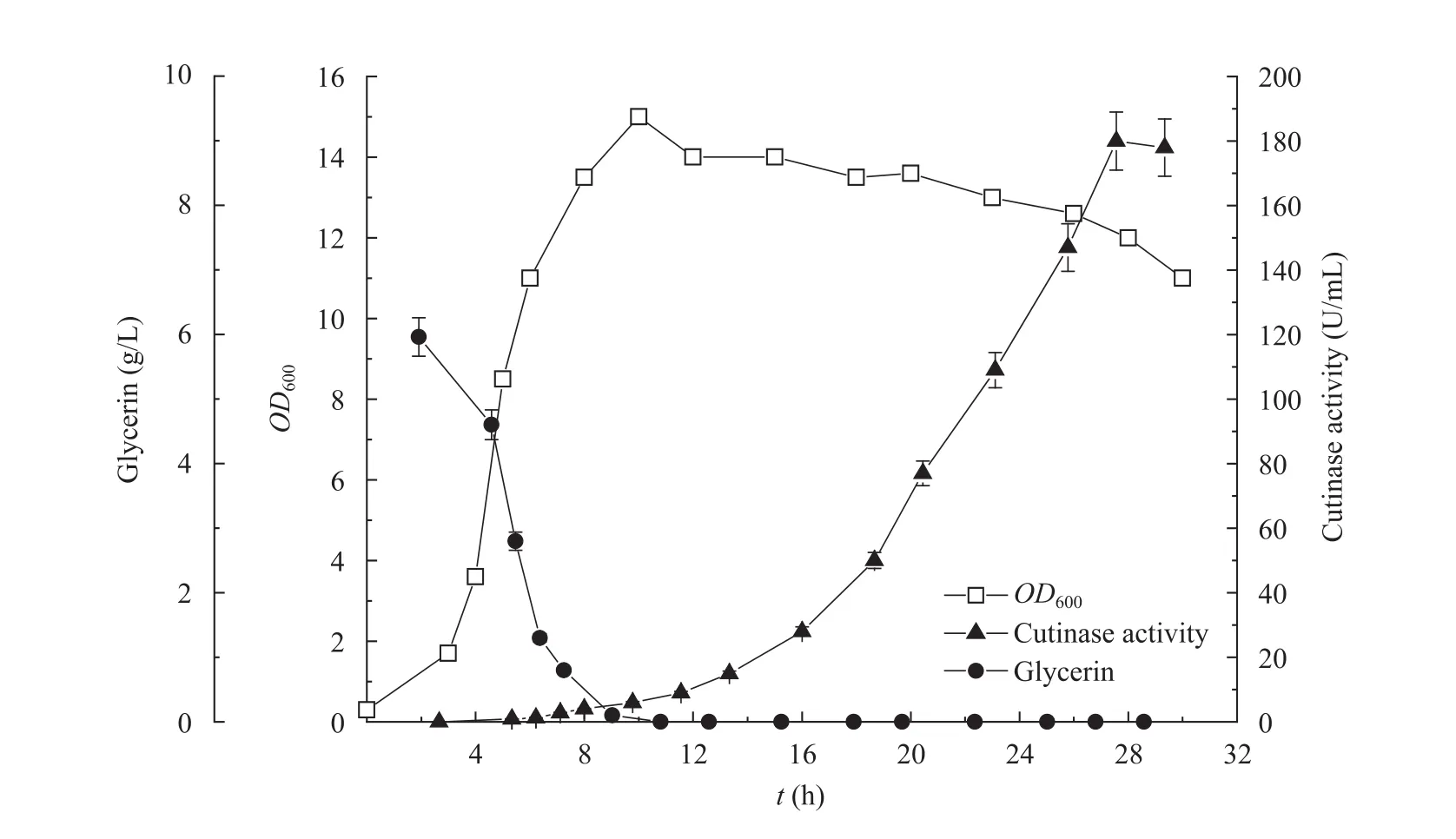
图4 分批发酵培养重组大肠杆菌的生物量及角质酶产量Fig. 4 Growth and cutinase production of E. coli in batch culture.
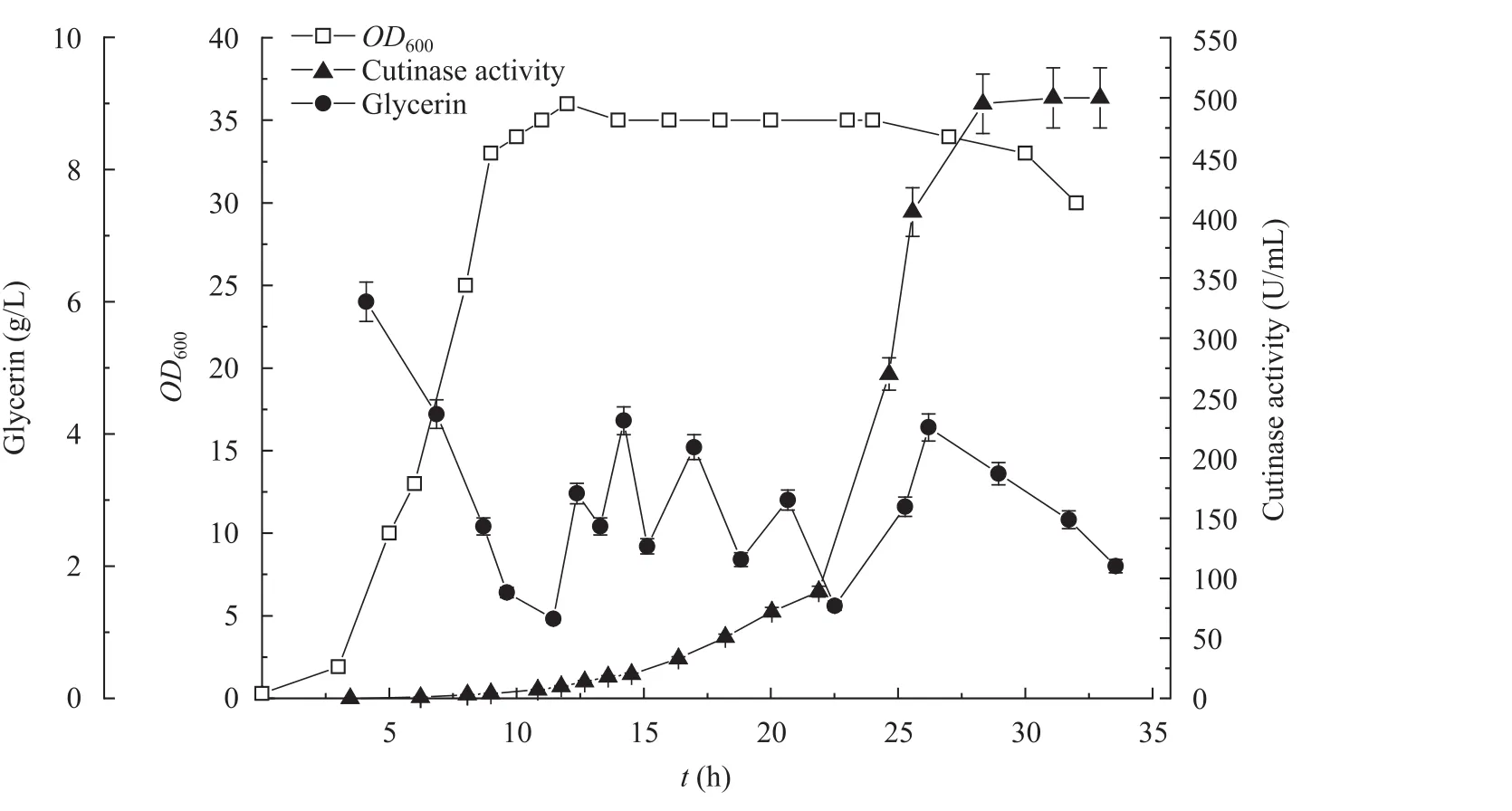
图5 分批补料发酵培养重组大肠杆菌的生物量及角质酶产量Fig. 5 Growth and cutinase production of E. coli in fed-batch culture.
2.6 角质酶处理涤纶纤维反应液的紫外分析
采用上述补料培养角质酶发酵液处理涤纶织物,进一步开展角质酶对涤纶表面改性的研究。Yoon等[1]和Alisch等[5]研究表明,涤纶的水解产物对苯二甲酸及其酯在240 nm处有强烈的吸收峰,因此测定了角质酶处理液在240 nm下的紫外吸光度变化,以表示角质酶对涤纶的处理效果。结果如图 6所示,随着处理时间的延长,紫外吸光度随之上升,但当处理时间大于12 h时,紫外吸光度的增加逐渐趋于平缓。这说明反应初期底物释放的小分子对苯二甲酸衍生物类化合物的量随处理时间的延长而增大,从而证明了角质酶可以催化作用于涤纶纤维。当纤维表面酯键水解到一定程度时,即使再延长处理时间,反应产物量也不会增加,紫外吸光度曲线逐渐趋向平缓。
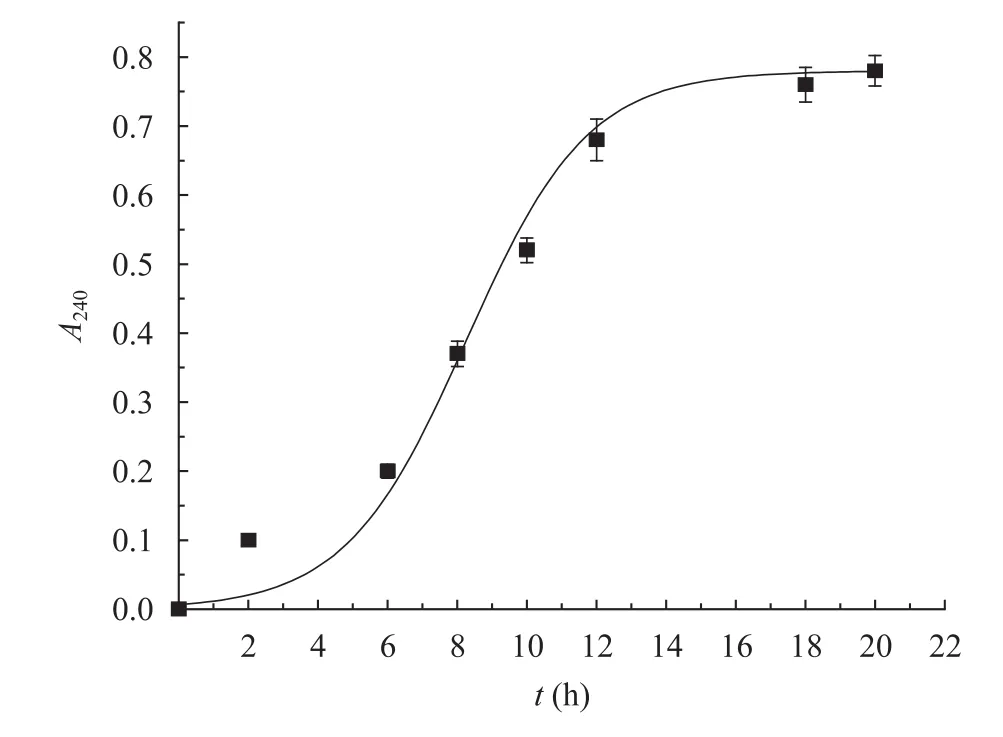
图6 角质酶对涤纶水解反应的紫外吸光度Fig. 6 UV absorbency after hydrolysis of PET by cutinase.
2.7 角质酶处理对涤纶纤维润湿性能的影响
紫外吸光度分析结果表明,角质酶可以催化涤纶纤维的水解,使涤纶纤维表面上的羧基和羟基增加,从而提高涤纶的亲水性。本研究通过滴水试验对角质酶处理效果进行评价,结果如图所 7示。实验发现,仅用缓冲液空白液试样和失活角质酶试样处理的涤纶亲水性改变不大,说明酶蛋白和涤纶纤维之间的吸附作用较小。角质酶单独处理样与Triton X-100单独处理样的润湿时间均在30~40 s,两者联合处理后润湿时间降至5 s。这说明,角质酶和表面活性剂协同作用能有效降低涤纶表面张力,提高对角质酶的亲和力,从而增强对涤纶的处理效果,与刘延波等的研究结果一致[18]。
2.8 角质酶处理对涤纶纤维染色性能的影响
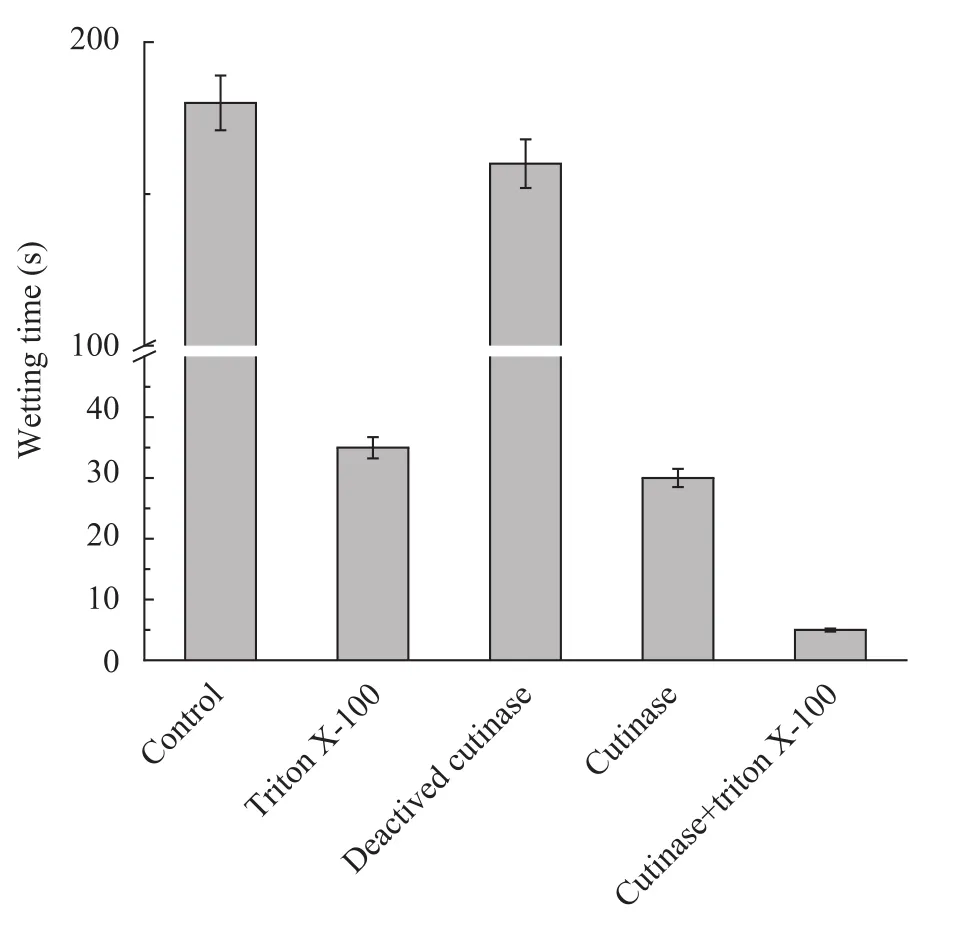
图7 角质酶处理对涤纶润湿时间的影响Fig. 7 Effect of cutinase treatment on wetting time of PET.
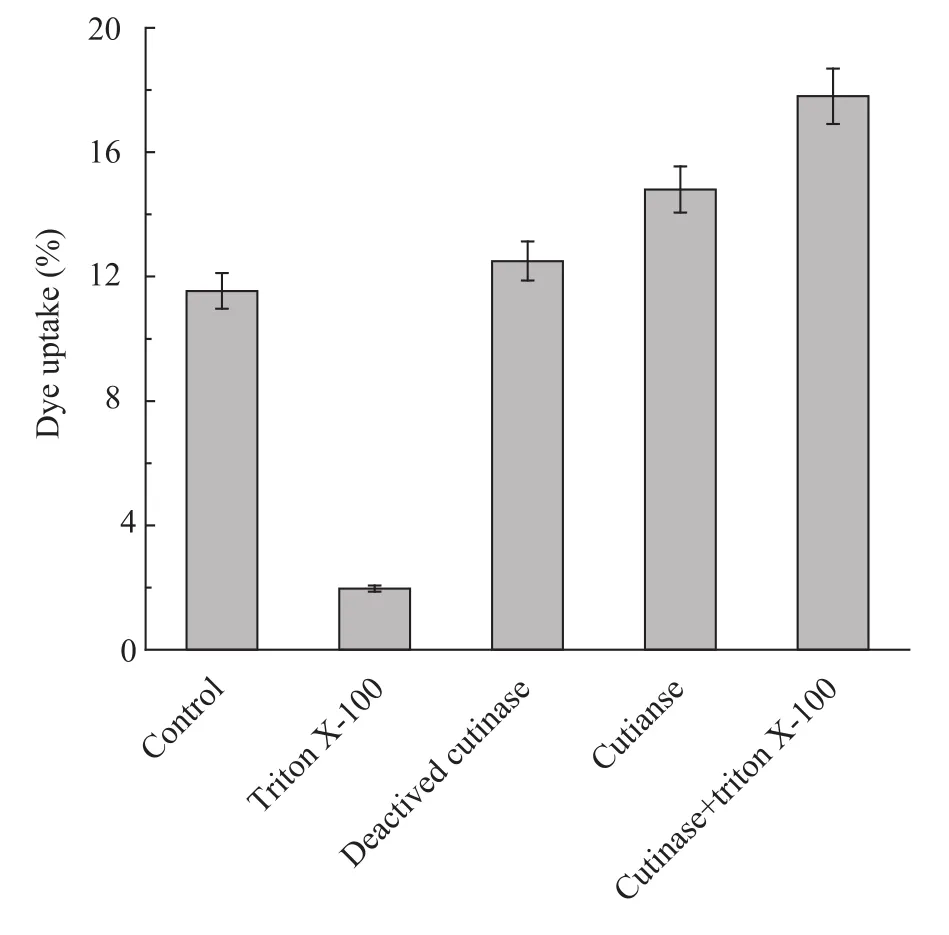
图8 角质酶处理对涤纶上染率的影响Fig. 8 Effect of cutinase treatment on dyeing percent of PET.
据文献报道[4-5,9],角质酶处理涤纶纤维可以使其染色性能得到提高。本文通过测定染液的吸光度值计算上染率,以此衡量角质酶对涤纶纤维的水解程度,结果见图 8。由图 8可知,与对照样相比,失活酶处理样的上染率变化不大,这说明涤纶在整个酶处理及洗涤过程中酶吸附的干扰较小。角质酶处理样的上染率均高于对照样和失活样,这是由于角质酶催化水解涤纶纤维表面产生了羧基和羟基基团。而羧基结构可以与阳离子染料中的阳离子基团发生吸附作用,从而达到使纤维染色的目的。表面活性剂Triton X-100单独处理的涤纶纤维染色性能很差,这是因为Triton X-100处理涤纶表面并不能产生羧基和羟基亲水基团,因而不能与阳离子染料结合进行染色。但Triton X-100与角质酶共同作用涤纶的效果要好于角质酶单独作用,这是因为Triton X-100是良好的纤维渗透剂,有助于酶“接近”纤维,从而提高角质酶处理涤纶的效果。
3 结论
本研究考察了重组 T. fusca角质酶发酵的摇瓶诱导条件、分批培养和分批补料培养调控策略,以及角质酶处理涤纶纤维的润湿性能和染色性能。
摇瓶发酵采用工业级TB培养基,用2 g/L乳糖诱导,菌体培养至对数生长前期添加0.5%甘氨酸,角质酶产量可以达到128 U/mL。在3 L发酵罐扩大培养中,分批培养角质酶产量为180 U/mL;补料培养生物量 (OD600) 最大达到35,角质酶酶活最高达506 U/mL,该酶活是迄今国内外报道细菌来源角质酶的最高水平。
本文在国内首次报道了细菌来源角质酶对涤纶纤维改性的研究。紫外分光光度法分析结果初步表明,涤纶纤维经角质酶水解产生了对苯二甲酸类物质。角质酶处理涤纶纤维的滴水性和染色性均明显高于对照样,说明角质酶的作用效果较为明显。且角质酶与 Triton X-100联合作用,能显著提高涤纶的润湿性和染色性。
REFERENCES
[1] Yoon MY, Kellis J, Poulose AJ. Enzymatic modification of polyester. AATCC Rev, 2002, 2(6): 33−36.
[2] Silva C, Cavaco-Paulo PA. Biotransformations in synthetic fibers. Biocatal Biotransform, 2008, 26(5): 350−356.
[3] Araújo R, Casal M, Cavaco-Paulo A. Application of enzymes for textile fibres processing. Biocatal Biotransfor, 2008, 26(5): 332−349.
[4] Guebitz MG, Cavaco-Paulo A. Enzymes go big: surface hydrolysis and functionalisation of synthetic polymers. Trends Biotechnol, 2008, 26(1): 32−38.
[5] Alisch M, Feuerhack A, Müller H, et al. Biocatalytic modification of polyethylene terephthalate fibres by esterases from actinomycete isolates. Biocatal Biotransfor, 2004, 22(5/6): 347−351.
[6] Mueller RJ. Biological degradation of synthetic polyesters-enzymes as potential catalysts for polyester recycling. Proc Biochem, 2006, 41(10): 2124−2128.
[7] Carvalho CM, Aires-Barros MR, Cabral JM. Cutinase: from molecular level to bioprocess development. Biotech Bioeng, 1999, 66(1): 17−34.
[8] Nimchua T, Punnapayak H, Zimmermann W, et al. Comparison of the hydrolysis of polyethylene terephthalate fibers by a hydrolase from Fusarium oxysporum LCH I and Fusarium solani f. sp. pisi. Biotechnol J, 2007, 2(3): 361–364.
[9] O’Neill A, Araújo R, Casal M, et al. Effect of the agitation on the adsorption and hydrolytic efficiency of cutinases on polyethylene terephthalate fibres. Enzyme Microb Tech, 2007, 40(7): 1801−1805.
[10] Eberl A, Heumann S, Brückner, et al. Enzymatic surface hydrolysis of poly (ethylene terephthalate) and bis (benzoyloxyethyl) terephthalate by lipase and cutinase in the presence of surface active molecules. J Biotechnol, 2009, 143(3): 207−212.
[11] Vertommen MAME, Nierstrasz VA, Veer MVD, et al. Enzymatic surface modification of poly (ethylene terephthalate). J Biotechnol, 2005, 120(4): 376−386.
[12] Alisch-Mark M, Herrmann A, Zimmermann W. Increase of the hydrophilicity of polyethylene terephthalate fibres by hydrolases from Thermomonospora fusca and Fusarium solani f. sp. pisi. Biotechnol Lett, 2006, 28(10): 681−685.
[13] O’Neill A, Cavaco-Paulo A. Monitoring biotransformations in polyesters. Biocatal Biotransfor, 2004, 22(5/6): 353−356.
[14] Piod TF, Macedo GA. Optimizing the production of cutinase by Fusarium oxysporum using response surface methodology. Enzyme Microb Tech, 2007, 41(5): 613−619.
[15] Macedo G, Fraga L. Production of cutinase by Fusarium oxysporum in solid-state fermentation using agroindustrial residues. Biotechnol, 2007, 131(2): 211−241.
[16] Davies KA, Lorono ID, Foster SJ, et al. Evidence for a role of cutinase in pathogenicity of Pyrenopeziza brassicae on brassicas. Physiol Mol Plan P, 2000, 57(2): 63−75.
[17] Li DH, Ashby AM, Johnstone K. Molecular evidence that the extracellular cutinase Pbc 1 is required for pathogenicity of Pyrenopeziza brassicae on oilseed rape. Mol Plant Microbe Interact, 2003, 16(6): 545−552.
[18] Liu YB, Wu GF, Gu LH. Enzymatic treatment of PET fabrics for improved hydrophilicity. China Textile Leader, 2008, (6): 96−98.刘延波, 吴桂芳, 顾榴红. 使用生物酶法提高涤纶织物的亲水性. 纺织导报, 2008, (6): 96−98.
[19] Chen S, Tong X, Woodard RW, et al. Identification and characterization of bacterial cutinase. J Biol Chem, 2008, 283(38): 25854−25862.
[20] Chen S, Su LQ, Billig S, et al. Biochemical charaterization of the cutinases from Thermonbifida. J Mol Catal B-Enzym, 2010, 63(3/4): 121−127.
[21] Li ZP, Zhang X, Xu B, et al. Expression of hBLyS in the E. coli cell density culture using lactose as an inducer. Chin J Process Eng, 2005, 5(4): 446−449.李兆鹏, 张栩, 徐斌, 等. 重组大肠杆菌高密度发酵中乳糖诱导表达 hBLyS. 过程工程学报, 2005, 5(4): 446−449.
[22] Lin F, Qin S. Lactose-induced expression of recombinant allophycocyanin in Escherichia coli JM109(DE3). Mat Sci, 2005, 29(11): 22−27.林凡, 秦松. 乳糖诱导重组别藻蓝蛋白基因在大肠杆菌中的表达. 海洋科学, 2005, 29(11): 22−27.
[23] Li ZF, Li B, Liu ZG, et al. Calcium leads to further increase in glycine-enhanced extracellular secretion of recombinant α-cyclodextrin glycosyltransferase in Escherichia coli. J Agric Food Chem, 2009, 57(14): 6231−6237.
[24] Cheng J, Wu D, Chen S, et al. Effect of complex and synthetic medium on extracellular production of α-cyclodextrin glycosyltransferase in E. coli. China Biotechnol, 2010, 30(9): 36−42.程婧, 吴丹, 陈晟, 等. 复合与合成培养基对大肠杆菌胞外生产 α-环糊精葡萄糖基转移酶的影响. 中国生物工程杂志, 2010, 30(9): 36−42.
[25] Zhang HW, Wang L, Xu GR, et al. Fed-batch fermentation of ethanol from glycerol by mixed culture of microorganisms. Chin J Appl Environ Biol, 2008, 14(5): 678−683.张宏武, 王璐, 许赣荣, 等. 混合培养微生物利用甘油补料发酵生产乙醇研究. 应用与环境生物学报, 2008, 14(5): 678−683.

