PLGA与大鼠嗅鞘细胞的生物相容性研究
崔颖 崔志明 徐冠华 王玲玲 孙郁雨 储惊蛰
PLGA与大鼠嗅鞘细胞的生物相容性研究
崔颖 崔志明 徐冠华 王玲玲 孙郁雨 储惊蛰
目的观察聚乳酸-乙醇酸聚合物[Poly(DL-lactic-co-glycolic acid),PLGA](LA∶GA=75∶25)与大鼠嗅鞘细胞的生物相容性。方法将分离提纯的大鼠嗅鞘细胞接种于PLGA膜上,对照组以相同的细胞接种于多聚赖氨酸包被的圆玻片上。使用倒置显微镜、扫描电镜观察细胞的黏附和生长情况,并采用MTT法及荧光染色后电子图像统计分析检测支架对细胞的毒性。结果嗅鞘细胞接种于PLGA膜上后良好生长,S-100阳性细胞计数、胞体面积和细胞周长与对照组无显著差异(P>0.05)。结论PLGA聚合物与嗅鞘细胞生物相容性良好,有望用于脊髓损伤修复的组织工程研究。
嗅鞘细胞聚乳酸-乙醇酸聚合物生物相容性脊髓损伤
脊髓神经组织工程中理想的支架材料应具有良好的生物相容性,无毒副作用。聚乳酸-乙醇酸共聚物[poly(DL-lactic-co-glycolic acid),PLGA]是一种可降解的高分子有机化合物,由不同比例的乳酸(LA)与乙醇酸(GA)聚合而成,是一种较理想的神经组织工程支架材料[1]。嗅鞘细胞(Olfactory ensheathing cells,OECs)是一种特殊的神经胶质细胞,它可以通过神经营养、抑制胶质增生和瘢痕形成、成鞘作用等促进损伤脊髓的修复[2-4]。本研究用大鼠OECs与LA∶GA=75∶25的PLGA膜进行体外共同培养,观察PLGA与OECs的生物相容性。
1 材料与方法
1.1 材料
出生1~3 d的SD大鼠(南通大学医学院实验动物中心);PLGA(LA∶GA=75∶25,IV=2.0 dl/g,济南岱罡生物材料有限公司);DMEM/F12培养基、胎牛血清(Gibco公司);NGFRp75抗体(Santa Cruz公司);Hoechst 33342、S-100抗体(Sigma公司);Alexa fluor 568、Alexa fluor 488(Invitrogen公司)。
1.2 PLGA膜的制备和体外降解检测
将PLGA溶于氯仿,配制成10%(w/v)的溶液,倒入模具中,液高为0.5 mm,待溶剂自然挥发,脱模后放入真空干燥机干燥成膜。PLGA膜用70%的乙醇灭菌,再用无菌生理盐水清洗3次,经紫外灯照射后无菌保存备用。
将PLGA膜剪成2 cm×2 cm大小,电子天平称重,然后将样品膜浸泡于pH 7.2的PBS缓冲液中,放入37℃恒温箱内,每周换液。定期取样,蒸馏水冲洗,干燥至恒重后称重。最后将降解的PLGA膜表面喷金,在扫描电子显微镜下观察其表面形态。重量损失公式如下,其中M1是降解前的质量,M2是降解后的质量。
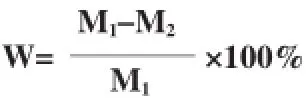
1.3 原代OCEs的培养及纯化
出生后1~3 d的SD大鼠腹腔麻醉后断头处死,无菌条件下分离双侧嗅球,置于DMEM/F12基础培养液中。培养液清洗嗅球2次,用眼科弯剪剪碎嗅球成1 mm3的组织块,加入0.125%胰酶置于5% CO2、37℃培养箱中消化20 min。用毛细吸管反复吹打至悬液呈乳白色,用含10%胎牛血清(FBS)的完全培养液中止消化5 min。用400目不锈钢筛网滤过后收取细胞悬液,1 000 r/min离心10 min,弃上清后加入培养液,吹打均匀,再次离心后弃上清,加入含10%FBS的完全培养液及青霉素100 U/mL、链霉素100 mg/mL,毛细吸管吹打制成单细胞悬液,接种于培养瓶中,置于37℃、5%CO2培养箱中,分别培养18 h和36 h后,将细胞悬液转移至另一培养瓶中。培养48 h后将细胞悬液吸至刻度离心管,离心后弃上清,加入完全培养液吹打均匀,台盼蓝染色计数。培养至第7天的OECs,用Hoechst 33342、S-100、NGFRp75特异性抗体作免疫荧光染色鉴定纯度。
1.4 OECs与PLGA膜共同培养
将浓度为1×106cells/mL的纯化OECs悬液接种于无菌PLGA膜上,对照组则将同样的细胞接种于多聚赖氨酸(PLL)包被的圆玻片上。两者均置于37℃、5%CO2、饱和湿度的培养箱中,每3天行半量换液,倒置显微镜下观察细胞形态。将与OECs共培养1 d、3 d、5 d、7 d的PLGA膜经过浸洗、固定、脱水、干燥、表面喷金后行扫描电镜观察。
1.5 免疫荧光抗体标记
分别于培养第1、3、5、7天吸出培养液,4%多聚甲醛固定30 min,PBS缓冲液浸洗3次,封闭血清孵育1 h,加入兔抗大鼠NGFRp75与小鼠抗大鼠S-100一抗混合液4℃过夜,PBS缓冲液浸洗3次,加入Alexa fluor 568羊抗小鼠与Alexa fluor 488羊抗兔IgG混合液,室温下作用2 h,封片,荧光显微镜观察摄片。
1.6 OECs在PLGA膜上的细胞增殖能力检测
共培养1 d、3 d、5 d、7 d后加入5 mg/mL MTT溶液,37℃孵育,再加入二甲基亚砜震荡溶解结晶,用酶标仪测570 nm的OD值,计算细胞相对增殖率(RGR)。毒性分级标准如下:0%为Ⅴ级,1%~24%为Ⅳ级,25%~49%为Ⅲ级,50%~74%为Ⅱ级,75%~99%为Ⅰ级,≥100%为0级。RGR值越大,级数越低,则材料毒性越小。
1.7 图像处理和统计分析
在放大200倍的荧光显微镜下,将摄取的照片导入图像处理系统,应用捷达801系列形态学分析软件,计数200倍视野内S-100阳性细胞数,并通过图像处理系统得到相应照片中S-100阳性细胞的胞体面积和细胞(包括突起)周长,每组均取3张切片的平均值作为统计数据,以均数±标准差表示,使用SPSS13.0统计软件进行分析,P<0.05表示差异有显著性意义。
2 实验结果
2.1 PLGA膜的体外降解检测
PLGA膜在PBS中的质量损失随时间延长而增加(图1),开始2周质量损失较多,但前8周平均降解速度较慢,8周后降解速度加快,至第12周达到14%。电镜下,PLGA膜表面逐渐皱缩并出现纹理(图2)。
2.2 OECs的鉴定
Hoechst 33342、S-100、NGFRp75特异性抗体作免疫荧光染色,鉴定为OECs细胞,纯度大于91%(图3)。
2.3 OECs与PLGA膜共培养形态学观察
OECs与PLGA膜共培养后,逐渐由悬浮状态沉降到膜表面,并在膜上附着展开,至12 h后,约80%细胞已黏附,细胞呈圆形和椭圆形,突起少,胞体大,聚集成团。接种1 d后,细胞团的外围细胞伸出短小突起,并向外周辐射散开,细胞团较共培养前面积增大。接种第3天,见细胞团扩散,大部分细胞生成突起,呈双极或三极,以双极为主。接种第5天,细胞在膜上迁移,分布均匀,突起伸长,出现多极细胞,并分泌较多细胞基质。接种第7天,细胞密度增加,突起伸展,与对照组比较,在膜上迁移的距离较小,细胞较聚集,细胞数量和形态与对照组无明显差异(图4)。
2.4 细胞增殖能力
OECs与PLGA膜共培养,不同时间点的OD值见表1,细胞毒性评级为Ⅰ,显示PLGA膜与OECs具有良好的相容性。
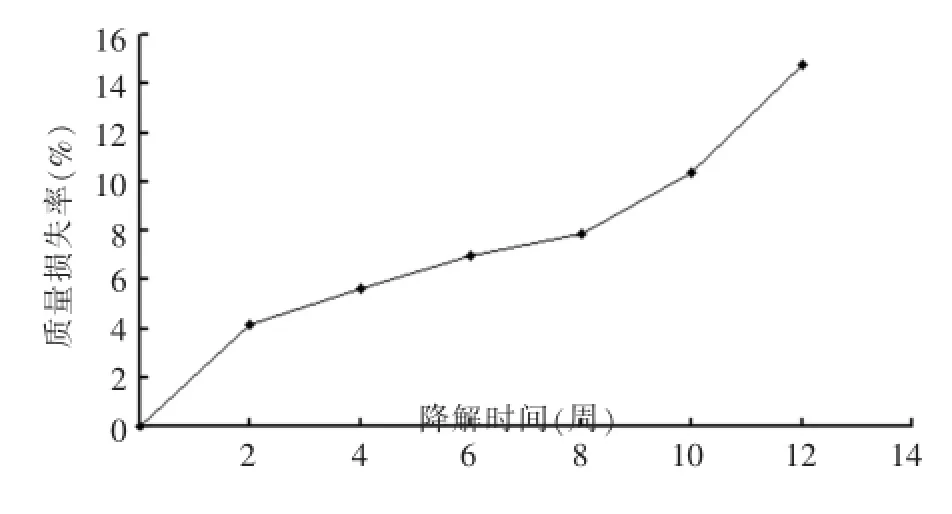
图1 PLGA膜体外降解12周质量损失曲线Fig.1Degrated curve of weight loss of PLGA membrane in 12 weeks in vitro

图2 PLGA膜体外降解实验扫描电镜观察(1 500×)Fig.2SEM observation of degradation of PLGA membrane(1 500×)
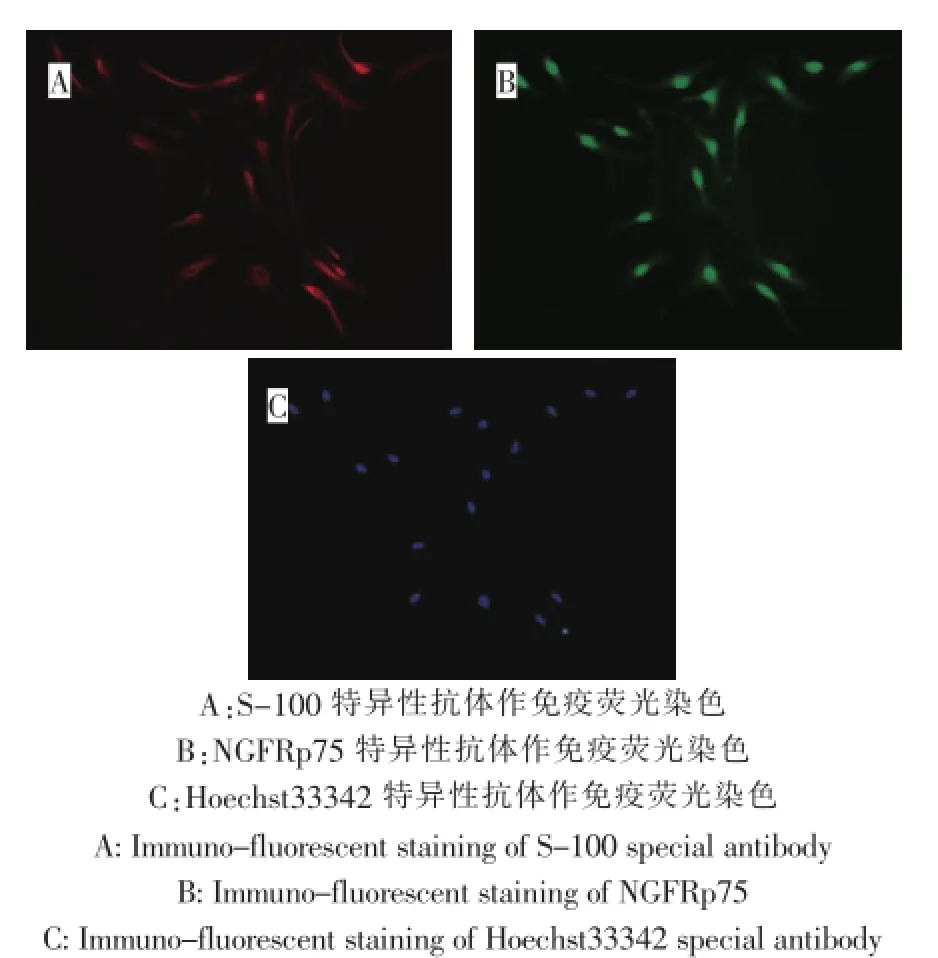
图3 培养7 d的OECs(200×)Fig.3OECs 7 days after culture(200×)

图4 扫描电镜观察(1 500×):PLGA组培养1 d(A)、3 d(B)、5 d(C)、7 d(D);对照组培养1 d(E)、3 d(F)、5 d(G)、7 d(H)Fig.4SEM observation(1 500×):PLGA group 1 d(A),3 d (B),5 d(C),7 d(D)after culture;control group 1 d(E),3 d (F),5 d(G),7 d(H)after culture
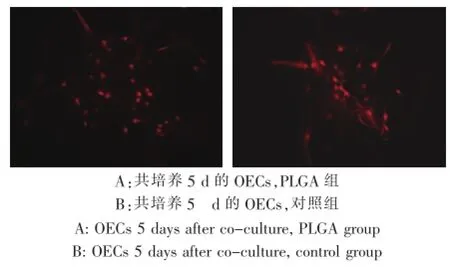
图5 免疫荧光染色检查(200×)Fig.5Immuno-fluorescent staining observation(200×)
2.5 免疫荧光检测
S-100阳性细胞的数量、胞体面积和细胞(包括突起)周长与对照组相比无显著性差异(P>0.05)(表2、图5)。
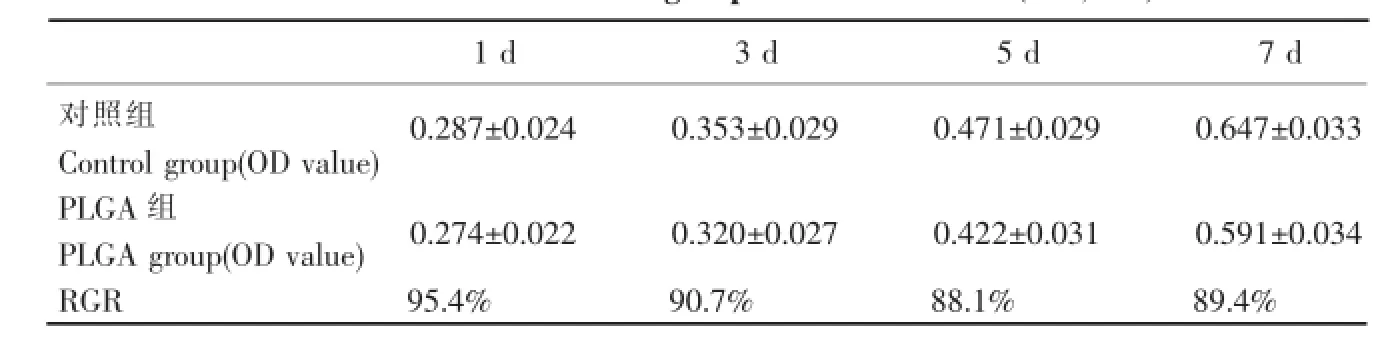
表1 两组不同时间点的OD值(x±s,n=6)Table 1OD values of two groups in different time(x±s,n=6)

表2 两组的S-100阳性细胞数、胞体面积和细胞周长比较(x±s,n=12)Table 2S-100 positive cell count,cell bodies area and cell circumference of two groups(x±s,n=12)
3 讨论
脊髓损伤后神经功能的恢复至今仍是困扰医学界的难题,组织工程研究的发展为脊髓损伤的修复带来了新的希望。OECs移植治疗脊髓损伤已显示出良好的应用前景,Raisman在其报道中较系统地提出OECs将是修复脊髓损伤最有应用前景的移植细胞。但单纯移植细胞往往会造成移植细胞流失,以及移植区仍留有组织缺损而不利于神经修复等不足,因此构建合适的细胞支架做为移植细胞的载体是保证移植成功的关键[5-6]。理想的脊髓组织支架材料应该具有良好的生物相容性、可靠的机械强度、生物可降解性、高孔隙率和三维立体结构,以及可塑性和表面生物活性等特点,其中首要的是具备良好的生物相容性[7-8]。
PLGA由不同比例的乳酸(LA)与乙醇酸(GA)聚合而成,在体内通过酯键水解而使分子链断裂,逐渐生成LA和GA单体,其机械性能、强度、亲疏水性和降解速率等,均可以通过调节两者的不同比例进行调整[9-10]。Moore等[11]将LA∶GA=85∶15的PLGA多通道支架复合雪旺细胞移植入脊髓横断的大鼠体内,1个月后有丰富的再生轴突通过了支架全长。Teng等[6]将两种比例的PLGA制作的支架与神经干细胞复合移植入大鼠半切脊髓中,亦发现移植后神经功能得到明显恢复。这些研究表明,PLGA可以作为多种种子细胞的载体。
由于GA单体比LA单体的降解速率快,所以PLGA膜的降解速率随着GA比例的增大而增加。在各种比例的PLGA材料中,75∶25的降解速率较适中,因此我们选用此种比例的PLGA膜作为实验对象。体外降解实验显示,75∶25的PLGA膜在开始2周快速降解,之后进入平台期,第8周的降解速率缓慢,之后明显加快,这与Wu等[12]的研究结果相似,但整体降解速率较其缓慢,可能是由于使用材料的物理形态不同所致。因为,Wu等使用的多孔隙的支架比本实验使用的PLGA膜具有更大的接触面积,与溶液的接触面积越大,降解速率越快;另外,在体外实验中,多孔支架降解后所产生的酸性物质易聚集在支架孔隙内,不能快速扩散入周围溶液中,支架局部pH值的下降可以加速其降解。
支架材料的降解速率与脊髓组织修复的时间应能匹配。初始修复损伤脊髓时,移植的支架材料应具有足够的力学强度以维持损伤区域的稳定性,防止周围组织塌陷,从而支持神经轴突的延伸和局部组织的再生。随着轴突生长,支架材料应快速的降解,从而为再生组织让出空间,使其逐渐填充损伤区域,避免造成再生神经和组织的压迫。75∶25的PLGA材料在8周后快速降解的特性,符合大鼠脊髓损伤修复的时间规律,适合于大鼠脊髓损伤修复的研究。
多聚赖氨酸(PLL)可以通过改善培养皿的电荷状况及吸附培养液成分促进细胞贴壁[13],是目前公认的细胞培养的良好载体,因此我们选择PLL与OECs共同培养作为对照组。本实验中,PLGA膜与OECs共培养,通过倒置相差显微镜、扫描电镜、免疫荧光等观察显示,PLGA组与对照组OECs的形态、数量和分布没有显著区别,S-100特异性抗体免疫荧光染色阳性细胞的数量、胞体面积和细胞周长与对照组无明显统计学差异,表示OECs可以很好地在PLGA膜上黏附、生长和迁移。MTT检测细胞增殖率的结果显示在各时间点OECs在PLGA膜上的相对增殖率均在75%~99%之间,细胞毒性等级为Ⅰ级,表明PLGA对OECs无毒副作用。
体外复合细胞培养法研究生物材料的相容性可以直接观察细胞与生物材料复合生长的情况,较为敏感、客观。本实验观察到OECs能够在75∶25的PLGA膜中存活、成熟和增殖,说明OECs与PLGA膜具有良好的生物相容性,从而表明OECs-PLGA膜复合物将有可能用于治疗神经系统损伤或病变。
[1]Di Toro R,Betti V,Spampinato S.Biocompatibility and integrinmediated adhesion of human osteoblasts to poly(DL-lactide-coglycolide)copolymers[J].Eur J Pharm Sci,2004,21(2-3):161-169.
[2]Willerth SM,Sakiyama-Elbert SE.Cell therapy for spinal cord regeneration[J].Adv Drug Deliver Rev,2008,60(2):263-276.
[3]Franssen EH,de Bree FM,Verhaagen J.Olfactory ensheathing glia: their contribution to primary olfactory nervous system regeneration and their regenerative potential following transplantation into the injured spinal cord[J].Brain Res Rev,2007,56(1):236-258.
[4]Guest JD,Herrera L,Margitich I,et al.Xenografts of expanded primate olfactory ensheathing glia support transient behavioral recovery that is independent of serotonergic or corticospinal axonal regeneration in nude rats following spinal cord transection[J].Exp Neurol,2008,212(2):261-274.
[5]Potter W,Kalil RE,Kao WJ.Biomimetic material systems for neural progenitor cell-based therapy[J].Front Biosci,2008,13:806-821.
[6]Teng YD,Lavik EB,Qu X,et al.Functional recovery following traumatic spinal cord injury mediated by a unique polymer scaffold seeded with neural stem cells[J].Proc Natl Acad Sci USA,2002, 99(5):3024-3029.
[7]Novikova LN,Kellerth JO,Novikov LN.Biopolymers and biodegradable smart implants for tissue regeneration after spinal cord injury[J]. Curr Opin Neurol,2003,16(6):711-715.
[8]Krych AJ,Rooney GE,Chen B,et al.Relationship between scaffold channel diameter and number of regenerating axons in the transected rat spinal cord[J].Acta Biomaterialia,2009,5(7):2551-2559.
[9]Takezawa T.A strategy for the development of tissue engineering scaffolds that regulate cell behavior[J].Biomaterials,2003,24(13): 2267-2275.
[10]Qiu LY,Zhu KJ.Novel biodegradable blends of poly[bis(glycineethyl ester)phosphazene]and polyesters or polyanhydrides:compatibility and biodegradable characteristics[J].Polym Int,2000,49(11):1283-1289.
[11]Moore MJ,Friedman JA,Lewellyn EB,et al.Multiple-channel scaffolds to promote spinal cord axon regeneration[J].Biomaterials, 2006,27(3):419-429.
[12]Wu L,Ding JD.In vitro degradation of three-dimensional porous poly(D,L-lactide-co-glycolide)scaffolds for tissue engineering[J]. Biomaterials,2004,25(27):5821-5830.
[13]Kim J,Williams JC.Rapid prototyping of patterned poly-L-lysine microstructures[J].Conf Proc IEEE Eng Med Biol Soc,2006,1: 2110-2113.
Biocompatibility of PLGA with Olfactory Ensheathing Cells in Rat
CUI Ying,CUI Zhiming,XU Guanhua,WANG Lingling,SUN Yuyu,CHU Jingzhe.Department of Spine Surgery,Second Affiliated Hospital of Nantong University,Nantong 226001,China.Corresponding author:CUI Zhiming(E-mail:czmspine@163.com).
ObjectiveTo explore the biocompatibility of Poly(DL-lactic-co-glycolic acid)(PLGA)(LA∶GA=75∶25)with olfactory ensheathing cells(OECs)in rat.MethodsThe purified OECs were seeded on the PLGA membrane(PLGA group) and on the columns coated Poly-L-Lysine(control group).The adhesion and viability of OECs were observed by inverted microscope and scanning electron microscopy.MTT method and the computer image statistical software were used to determinate the survival and proliferation of OECs.ResultsOECs grew well on PLGA membrane.There were no significant differences in the activity of OECs.The number of S-100 positive cel1s,the area of the cell bodies and the perimeter of the cell between two groups(P>0.05).ConclusionThe PLGA biomaterial has good biocompatibility with rat OECs.It could be an ideal tissue engineered scaffold material in the repair of spinal cord injury.
Olfactory ensheathing cells;Poly(DL-lactic-co-glycolic acid);Biocompatibility;Spinal cord injury
Q813.1+1,R318.08
A
1673-0364(2011)02-0080-05
2011年1月19日;
2011年2月28日)
10.3969/j.issn.1673-0364.2011.02.005
江苏省“医学重点人才”资助项目(RC2007027),南通市社会发展科技计划项目(S2009014)。
226001江苏省南通市南通大学第二附属医院脊柱外科。
崔志明(E-mail:czmspine@163.com)。

