辐照对透明质酸理化特性的影响
邹朝晖,王 强,王志东,邓钢桥,李淑荣,*,高美须,陈永浩,范 蓓,李庆鹏,赵宏伟
辐照对透明质酸理化特性的影响
邹朝晖1,2,王 强1,王志东1,邓钢桥2,李淑荣1,*,高美须1,陈永浩1,范 蓓1,李庆鹏1,赵宏伟1
(1.中国农业科学院农产品加工研究所,农业部农产品加工与质量控制重点开放实验室,北京 100193;2.湖南农业科学院原子能农业应用研究所,湖南 长沙 410125)
采用60Co-γ射线对0.5g/100mL透明质酸氯化钠溶液进行辐照处理,通过溶液的pH值、黏度值、色度和红外光谱及紫外光谱等变化研究辐照对透明质酸理化特性的影响。结果表明:辐照降低透明质酸的分子质量、pH值、特性黏度,溶液的颜色比未辐照的更黄。通过紫外和红外扫描观察,透明质酸在辐照前后的吸收特征峰没有太大的变化,吸收强度发生变化。辐照后透明质酸对DPPH自由基的清除作用随着辐照剂量的增大逐渐增强。
透明质酸;辐照;降解;理化特性
透明质酸(hyaluronic acid,HA),又名玻璃酸,是一种由D-葡萄糖醛酸和N-乙酰氨基葡萄糖以β-1,3和β-1,4糖苷键反复交替连接而成的链状高分子黏多糖,是一种线性大分子黏多糖[1-3]。HA是构成细胞间基质和胞外基质的主要成分,以关节腔、血管、心脏和皮肤等组织中的含量较高[4],这种高分子的透明质酸,在许多生物过程中起着非常重要的作用,具有重要的生理功能。它是自由基的“清道夫”,可调节胶原的合成,促进细胞的增生和移动,还参与一些基本的生物过程,如体内由于HA的减少会导致关节炎、动脉硬化、皮肤老化等不良的症状,HA的补充能有效调节机体的功能和延缓皮肤老化的作用,HA是理想的功能食品和美容化妆品。目前,人们对HA的结构、性质和生理功能都进行了较为充分的研究,其在临床上的应用也日益广泛[5-8]。研究发现,HA的部分生物活性与其分子的大小有密切关系,高分子HA与低分子HA(low molecular weight hyaluronic acid,LMWHA)具有不同的生物活性,甚至是相反的生物活性。透明质酸虽具有很好的生理活性,但因其分子高度聚合,分子大,具有水不溶性或溶解度较低、溶胶稳定性差、流动性不好等缺点,使其应用受到限制。因此,LMWHA逐渐成为国内外研究的热点。
近年来,有关透明质酸的分子修饰已大有进展,目前多糖的降解方法主要有酶法、化学法和物理法等,然而几类方法各有优缺点:酶降解法无副反应、降解条件温和、对环境污染小,但是酶容易失活、降解时间长;化学法降解高聚物反应时间较短,但水解后的低聚糖容易受到酸和热的影响而进一步分解,操作难控制,导致产品均一性差,同时也有副产物生成,影响产品质量,废水处理量也大,不利于环境友好。物理法具有速度快、无副产物、无环境污染,是一种较理想的修饰方法。
目前,研究发现辐照能有效的降解纤维素、淀粉、壳聚糖、果胶等,而这些高分子链断裂主要原因是在辐照过程中产生了自由基,自由基作用于高分子链,与它形成螯合物进一步反应,从而打断了分子链,因此多糖的主要结构及化学组成随着分子链的断裂而发生不同程度的变化[9-11]。另外,许多的研究表明,辐照对松露、牛肉、药草、香料、绿茶提取物、羽扇豆种子产品和大豆的抗氧化性影响比较大[12-14],但是,辐照对透明质酸的影响还没有进行系统的研究。
本实验通过不同剂量辐照水溶液的透明质酸,研究它对透明质酸的理化性质的影响,为进一步开发利用透明质酸提供技术参考。
1 材料与方法
1.1 材料与试剂
透明质酸 江阴市润禾生物工程公司;二苯代苦酰基自由基(DPPH自由基) 美国Sigma公司;抗坏血酸(VC) 天津市博进化有限公司;铁氰化钾、氯化铁、三羟甲基氨基甲烷(Tris)、三氯乙酸、焦性没食子酸(邻苯三酚)、水杨酸等(分析纯) 上海昊化化工有限公司。
1.2 仪器与设备
乌氏黏度计(内径57mm) 巩义予华仪器有限责任公司;P211 HANNA酸度计 北京哈纳科技有限公司;R-550型可见分光光度计 日本分光株式会社;ENSOR37红外光谱仪 布鲁克光谱仪器公司。
1.3 方法
1.3.1 样品的制备
用0.2mol/L NaCl溶液配制0.5g/100mL的透明质酸溶液,分装到8个250mL的灭菌的试剂瓶,每个试剂瓶装200mL,待用。
1.3.2 辐照处理
在中国农业科学院农产品加工研究所进行,采用60Co-γ辐照装置进行辐照,辐照剂量分别为0、1、3、5、8、10、20kGy和40kGy,处理后的样品置于4℃冰箱保存。
1.3.3 透明质酸黏均相对分子质量及特性黏数的测定
采用乌氏黏度计,透明质酸溶液的稀释度以流出时间为准,应控制在120~180s范围内,一般用生理盐水作20倍稀释。采用一点法测量,按下(1)计算特性黏数:

式中:ηr为t/t0(t为两次待测液体流出时间的平均值,t0为两次溶剂流出的时间的平均值);c为供试液的质量浓度/(kg/L)。然后按照式(2)计算相对分子质量。

式中:M为黏均相对分子质量;[η]为特性黏数/ (cm3/g)。
透明质酸pH值的测定:采用pH计测定。透明质酸颜色L*、a*、b*值的测定:采用色度计测定。
1.3.4 透明质酸对DPPH自由基清除作用
参照高春燕等[15]的方法,取2mL待测试样的溶液加入2mL 0.16mmol/L DPPH 95%乙醇溶液于25℃反应15min后,在517nm波长处测定吸光度Ai,以相同体积的0.2mol/L NaCl溶液代替试样作为空白,以相同体积等浓度的VC溶液代替试样作为阳性对照,每个试样作5个平行样,取其平均值。按照式(3)计算清除DPPH自由基活性(P)。

式中:Ai为试样的吸光度;Aj为VC的吸光度;Ac为空白样的吸光度。
1.3.5 透明质酸基团结构测定
采用UV进行全波长光谱扫描和特征吸收峰的测定,采用FTIR进行测定基团变化情况:液体样品冷冻干燥后,与KBr粉末混合研磨、压片,纯KBr片作参比,1cm-1分辨率,多次扫描累积。
2 结果与分析
2.1 辐照对透明质酸理化性质的影响
2.1.1 辐照对透明质酸黏均相对分子质量的影响
从图1可以看出,随着辐照剂量的增大,透明质酸平均相对分子质量却越来越来小,0~1kGy辐照处理,透明质酸的相对分子质量迅速降低,从1.03×106降低到6.54×104,随着剂量升高,相对分子质量降低的速度减慢。相对分子质量降低的原因除γ射线的直接作用外,另一个重要的原因是在γ射线作用下,透明质酸溶液中产生大量的自由基,自由基的形成加速了透明质酸分子长链的断裂(β-1,3和β-1,4糖苷键)。

图1 辐照对透明质酸黏均相对分子质量的影响Fig.1 Effect of irradiation on average molecular weight of HA
2.1.2 辐照对透明质酸特性黏数的影响
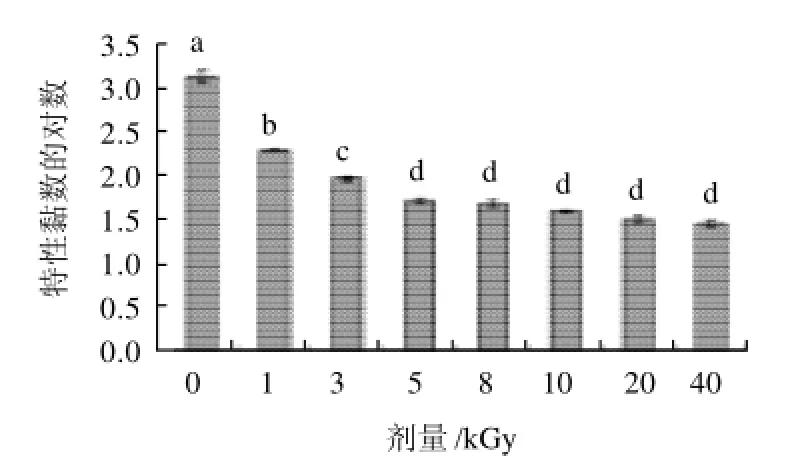
图2 辐照对透明质酸特性黏数的影响Fig.2 Effect of irradiation on the viscosity coefficient of HA
图2可以看出,随着辐照剂量的升高,透明质酸的特性黏数也随着降低。辐照剂量0~1kGy时,特性黏数降低的速度最快,从1652.51cm3/g降低到208.26cm3/g,而后,随辐照剂量的增高,特性黏数降低的速度越慢。主要原因在于在γ射线的直接和间接作用下,透明质酸的长链变成短链,支链也被变短,辐照剂量越高,对分子链的作用越强,分子链变得越短,透明质酸的相对分子质量越小,因此,透明质酸的特性黏数随着剂量的升高就会降低,Lurie等[16]的研究结果与此相同。
2.1.3 辐照对透明质酸pH值的影响
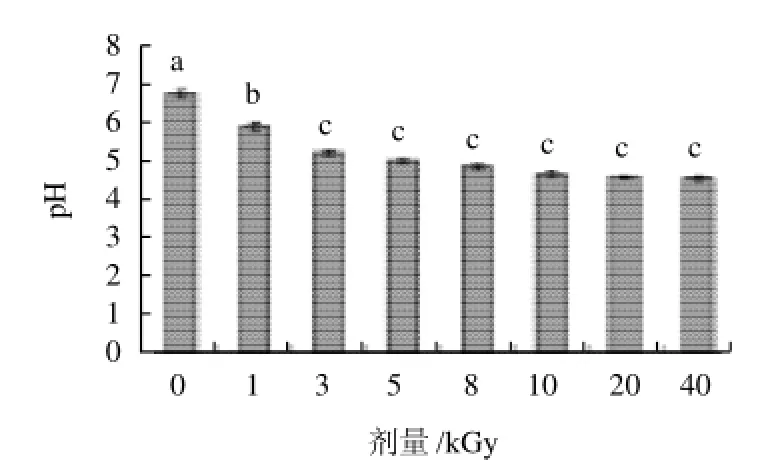
图3 辐照对透明质酸pH值的影响Fig.3 Effect of irradiation on pH of HA
由图3可知,透明质酸的pH值随着辐照剂量的增大,p H值逐渐降低,酸性越来越强,辐照过后的透明质酸的酸度增加,主要归于透明质酸分子链打断,可能形成了羧基的原因,Sokhey等[17]在1993报道过类似的结果:在自由基的作用下,糖苷键被打断可以增加淀粉的酸度。
2.1.4 辐照对透明质酸颜色的影响

表1 辐照对透明质酸颜色的影响Table 1 Effect of irradiation on the color of HA
由表1可以看出,辐照引起透明质酸色度的变化,辐照处理使透明质酸的L*值明显高于未辐照,使透明质酸溶液的亮度略有增强;随着辐照剂量的增加,+b*逐渐增加(更黄),-a*逐渐降低(更绿),这表明辐照使透明质酸溶液的颜色略有黄化。Choi等[18]研究表明,壳聚糖溶液的颜色随着辐照剂量的增加,褐色变的更浓。Nagasawa等[19]研究结果表明,辐照使海藻酸钠的颜色由浅褐色变成褐色,海藻酸钠在辐照过程中形成的褐色是由于分子链的断裂,产生了一些双键。
2.1.5 透明质酸对DPPH自由基的清除作用

图4 透明质酸对DPPH自由基的清除作用Fig.4 Effect of irradiation on scavenging rate of DPPH free radicals
由图4可以看出,随着辐照剂量的增加,透明质酸对DPPH自由基的清除率增大,当辐照剂量高于20kGy时,对DPPH自由基清除率增加的缓慢。Alkrad等[20]研究表明,人体皮肤被紫外线照射过程中,就会产生大量的自由基。人体中的透明质酸通过透明质酸酶酶解后,透明质酸中的吡喃羧酸环上就形成了一个双键。吡喃羧酸环上双键是清除人体内自由基ROO·、·OH的毒性作用中是必不可少的。透明质酸在辐照过程中,分子发生裂解,在吡喃羧酸环可能形成了双键,因此,辐照处理后透明质酸增强了对DPPH自由基的清除作用。
2.2 辐照处理后对透明质酸结构的影响
2.2.1 透明质酸的紫外光谱分析

图5 透明质酸辐照前后紫外扫描Fig.5 UV spectra of irradiated hyaluronic acid
由图5可见,透明质酸经紫外扫描,共出现2个峰,其中一个峰出现在波长210nm附近,这是透明质酸的吸收峰,另一个在波长265nm处出现,这可能是透明质酸的主链打断后形成双键而产生的,Kim等[21]报道过这种情况。经过不同剂量辐照后,透明质酸出峰的波长及峰数没有变化。说明辐照没有产生新的吸收峰,但随辐照剂量的增加,吸收峰的高度增高,Nagasawa等[19]报道峰的强度增大的原因可能是在γ射线作用下,主链断裂形成一些双键。
2.2.2 透明质酸的红外光谱分析

图6 透明质酸辐照前后红外光谱扫描Fig.6 FT-IR spectra of irradiated hyaluronic acid
图6显示了辐照剂量在0、1、3、5、8、1 0、20kGy和40kGy辐照下的透明质酸在4000~500cm-1区段红外光谱的特征吸收峰,在3434cm-1出现了C=O官能团的特征吸收峰,在2360cm-1附近出现了C—O的特征吸收峰,1636cm-1处出现了C—O—C的特征吸收峰,1385cm-1附近出现了C—O和C—C官能团特征吸收峰,1067cm-1处出现了—CHO的特征吸收峰,从整体上来看,虽然辐照降低了透明质酸的相对分子质量,但是红外吸收光谱没有发生太大的变化,只是随着辐照剂量的增高,相应的吸收峰的强度增大了。
3 结 论
3.1 透明质酸经过0、1、3、5、8、10、20、40kGy剂量辐照后,其相对分子质量、特性黏数、p H值随辐照剂量的增加而降低,透明质酸溶液随辐照剂量的增加颜色变黄,其对DPPH自由基的清除作用提高。这说明辐照不仅能降解透明质酸,还能改变其一些理化特性,这为透明质酸的应用提供更多的选择。
3.2 通过紫外光谱及红外光谱的分析,辐照后的透明质酸的一级结构并没有发生改变,只是β-1,3和β-1,4糖苷键的断裂,因此,辐照后的透明质酸的物理特性发生改变。
[1]SURENDRAKUMAR K, MARTYN G P, HODGERS E C, et al. Sustained release of insulin from sodium hyaluronate based dry powder formulations after pulmonary delivery to beagle dogs[J]. J Control Release, 2003, 91(4): 85-94.
[2]MEYER K, PALMER J W. The polysaccharide of the vitreous houmor [J]. J Biolchem, 1934, 107(5): 629-633.
[3]LAURENT T C, LAURENT U B, FRASER J R. The structure and function of hyaluronan: an overview[J]. Immunol Cell Biol, 1996, 74(8): 1-5.
[4]WEIGEL P H, FROST S J, MEGARY C T, et al. The role of hyaluromic acid in inflammation and wound healing[J]. Int J Tissue React, 1988, 10 (6): 355-365.
[5]ARSHINOFF S A. Dispersive and cohesive viscoelastic materials in phacoemulsification[J]. Ophthalmic Practice, 1995, 13(1): 98-104.
[6]GOA K L, BENFIELD P. Hyaluronic acid: A review of its pharmacology and use as a surgical aid in ophthalmology, and its therapeutic potential in joint decease and wound-healing[J]. Drugs, 1994, 47(4): 536-566.
[7]LAURENT T C. The chemistry, biology and medical applications of hyaluronan and its derivatives[M]. London: Portl and Press, 1998: 251-256.
[8]MORRA M. Engineering of biomaterials surfaces by hyaluronan[J]. Biomacromolecules, 2005, 6(3): 1205-1223
[9]CHARLESBY A. Crosslinking and degradation of polymers[J]. Radiation Physics and Chemistry, 1982, 18(6): 59-61.
[10]BYUN M W, SON J H, YOOK H S, et al. Effect of gamma irradiation on the physiological activity of Korean soybean fermented foods, Chungkookjang and Doenjang[J]. Radiation Physics and Chemistry, 2002, 64(5): 245-248.
[11]ZEGOTA H. The effect of γ-irradiation on citrus pectin in N2O and N2O/O2 saturated aqueous solutions[J]. Food Hydrocolloids, 1999, 13(1): 51-58.
[12]ADAMO M, CAPITANI D, MANNINA L, et al. Truffles decontamination treatment by ionizing radiation[J]. Radiation Physics and Chemistry, 2004, 71(1/2): 165-168.
[13]AHN D U, NAM K C. Effects of ascorbic acid and antioxidants on color, lipid oxidation and volatiles of irradiated ground beef[J]. Radiation Physics and Chemistry, 2004, 89(7): 579-589.
[14]VARIYAR P S, LIMAYE A, SHARMA A. Radiation-induced enhancement of antioxidant contents of soybean(Glycine max Mer-rill)[J]. Journal of Agricultural and Food Chemistry, 2004, 52(9): 3385-3388.
[15]高春燕, 田呈瑞, 周默. 枸杞多糖体清除自由基活性研究[J]. 三峡大学学报, 2005, 27(5): 23-26.
[16]LURIE Z, OFFER T, RUSSO A, et al. Do stable nitroxide radicals catalyze or inhibit the degradation of hyaluronic acid[J]. Free Radicals Biology and Medicine, 2003, 53(1): 169-178.
[17]SOKHEY A S, CHINNASWAMY R. Chemical and molecular propeities of irradiated starch extrudates[J]. Cereal Chemistry, 1993, 70(7): 260-268.
[18]CHOI W S, AHN K J, LEE D W, et al. Preparation of chitosan oligorners by irradition[J]. Polymer Degradation and Stability, 2002, 78(5): 533-538.
[19]NAGASAWA N, MITOMO M, YOSHII F, et al. Radiation induced degradation of sodium alginate[J]. Polymer Degradation and Stability, 2000, 69(3): 279-285.
[20]ALKRAD J A, MRESTANI Y, STROEHL D, et al. Characterization of enzymatically digested hyaluronic acid using NMR, Raman, IR, and UV-Vis spectroscopies[J]. Journal of Pharmaceutical and Biom edical Analysis, 2003, 31(4): 545-550.
[21]KIM J K, SRINIVASAN P, KIM J H. Structuraland antioxidant properties of gamma irradiated hyaluronic acid[J]. Food Chemistry, 2008, 109 (4): 763-770.
Effect of Irradiation on Physico-chemical Properties of Hyaluronic Acid
ZOU Zhao-hui1,2,WANG Qiang1,WANG Zhi-dong1,DENG Gang-qiao2,LI Shu-rong1,*,GAO Mei-xu1,CHEN Yong-hao1,FAN Bei1,LI Qing-peng1,ZHAO Hong-wei1
(1. Key Laboratory of Agricultural Products Processing and Quality Control, Ministry of Agriculture, Institute of Agro-Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China;2. Institute of Atomic Energy Application in Agriculture, Hunan Academy of Agricultural Sciences, Changsha 410125,China)
The60Co-γ irradiation treatment on 0.5 g/100mL hyaluronic acid (HA) with sodium chloride solution was used to explore the effect on its physico-chemical properties such as solution pH, viscosity, color and infrared spectroscopy and UV spectra. The results demonstrated that the irradiation treatment could decrease molecular weight, viscosity and pH of hyaluronic acid, and result in enhanced yellow color. In addition, no obvious change in absorption characteristic peaks of UV and FT-IR for the irradiated hyaluronic acid solution was observed; however, its absorption intensity was changed due to the irradiation treatment. Moreover, the irradiated hyaluronic acid exhibited a gradual increase trend of scavenging capability on DPPH free radicals in a dose-dependent manner.
hyaluronic acid;irradiation;depolymerization;physico-chemical property
TS201.2
A
1002-6630(2011)03-0117-04
2010-06-07
邹朝晖(1976—),男,助理研究员,硕士,研究方向为辐照食品加工。
E-mail:zouzhaohui1976@yahoo.com.cn
*通信作者:李淑荣(1968—),女,研究员,博士,研究方向为食品生物技术。E-mail:shurongl@hotmail.com

