长根菇菌丝培养、鉴定及氨基酸成分分析
邹立扣,潘 欣,岳爱玲,罗 燕,李 蓓,张 悦,姚 琼,吴 琦
长根菇菌丝培养、鉴定及氨基酸成分分析
邹立扣1,潘 欣2,3,岳爱玲1,罗 燕1,李 蓓1,张 悦1,姚 琼1,吴 琦4,*
(1. 四川农业大学都江堰校区微生物学实验室,四川 都江堰 611830;2. 四川农业大学林学院,四川 雅安 625014;3. 成都理工大学旅游与城乡规划学院,四川 成都 610059;4. 四川农业大学生命科学与理学院,四川 雅安 625014)
采用组织分离法,选择不同培养条件(温度、pH值),获得长根菇的纯培养物。扫描电镜观测其菌丝体特征,结合ITS区序列鉴定菌丝体,用全自动氨基酸分析仪分别测定长根菇子实体、菌丝体氨基酸组成。结果表明:长根菇菌丝最佳生长温度为26℃,最佳生长pH值为5.0;菌丝体ITS区序列与子实体完全一致(850bp),ITS区基因片段的分子鉴定简便、准确,可以作为长根菇菌丝体鉴定的有效手段。长根菇菌丝体、子实体总氨基酸含量分别为18.25%、13.98%,必需氨基酸含量分别为6.97%、5.28%,非必需氨基酸含量分别为11.28%、8.70%,可见长根菇氨基酸种类丰富,营养价值高,长根菇菌丝体可开发成为功能性运动食品。
长根菇;培养;菌丝;鉴定;I T S区;氨基酸;
长根菇(Xerula radicata)又名长根小奥德蘑(Oudemansiella radicata (Relhan: Fr.) Singer)、长根金钱菌、露水鸡枞菌、长寿菇,隶属于真菌门、层菌纲、伞菌目、白蘑科、奥德蘑属,是一种珍稀的食药用真菌[1-3]。长根菇富含蛋白质、氨基酸、脂肪和碳水化合物,味道鲜美,经常食用长根菇,可增强机体免疫力。长根菇中含有多种活性成分,如长根菇多糖、抑菌活性物质等[4-5],对其研究主要侧重在培养特性、栽培技术[6-7],但对长根菇子实体及菌丝体的分子鉴定、氨基酸组成分析等尚不清楚。鉴于此,本实验对长根菇的培养特性、菌丝体特征进行研究,结合分子生物学方法对菌丝体进行鉴定,并利用X射线光电子能谱仪、全自动氨基酸分析仪分析其子实体及菌丝体部分元素含量和氨基酸组成。
1 材料与方法
1.1 材料、培养基与试剂
长根菇子实体采集自四川省阿坝州;大肠杆菌JM109由四川农业大学都江堰校区微生物学实验室保存。
PDA固体、PDA液体培养基:用0.1mol/L HCl或0.1mol/L NaOH将培养基pH值分别调节为4.0、4.5、5.0、5.5、6.0、6.5、7.0,经高压灭菌后备用。
DNA分子质量标准DL2000、pMD19-T载体、Taq DNA 聚合酶及DNA连接试剂盒 宝生物工程(大连)有限公司;小量胶回收试剂盒 天根生化科技(北京)有限公司。
1.2 仪器与设备
JSM-5900LV型扫描电子显微镜 日本电子株式会社;HITACHI L-8800全自动氨基酸分析仪 日本Hitachi公司;XSAM800X射线光电子能谱仪 英国Kratos公司;Leica显微镜 德国Leica公司;Bio-Rad凝胶成像系统 PCR仪、电泳仪 美国Bio-Rad公司;Eppendorf 5804R高速冷冻离心机 德国Eppendorf公司;MaxQ6000气浴摇振培养箱 美国Thermo公司;小型涡旋振荡器德国IKA公司;水浴锅 上海佑柯仪器设备有限公司;恒温培养箱 哈尔滨东联电子技术开发有限公司。
1.3 方法
1.3.1 长根菇的分离与培养
取长根菇子实体,去掉表面杂质,用无菌水和75%乙醇清洗消毒,各冲洗两次后分别取菌盖、菌柄及菌褶培养。用无菌手术剪剪成约0.5cm×0.5cm 的小菌块,用质量浓度0.1mg/100mL的氯化汞溶液消毒3min,75%乙醇溶液中浸泡1min,用无菌水冲洗2~3次,干净后用接种针移入PDA固体培养基,分别置于20、22、24、26、28℃不同温度下恒温培养,每一温度设置4.0、4.5、5.0、5.5、6.0、6.5、7.0不同pH值梯度,保证45%湿度,每天观察菌丝生长情况。
1.3.2 菌落及菌丝形态特征
获得纯化菌种后,转接至PDA固体培养基,每日测定其菌落大小,观察并记录其菌落特征。扫描电子显微镜观察其菌丝形态,样品制备及观察按孔祥林等[8]报道的方法,取培养菌丝置于盖玻片上,加4%戊二醛2滴固定5~10min,用滤纸吸掉多余水分,自然干燥。用 Hitachi离子溅射仪喷金提高样品导电性,条件:真空10Pa,电流15mA,时间80s。用 JSM-5900LV型扫描电镜,加速电压20kV。
1.3.3 长根菇菌丝液体培养
将分离纯化后的菌丝接种于PDA液体培养基,26℃、160r/min振荡培养5~7d,8000×g离心5min,收集菌丝体,用吸水纸尽量吸干水分,用无菌水洗涤菌丝体,离心去除上清液,重复3次后4℃保存备用。
1.3.4 长根菇菌丝的ITS区鉴定
采用改良二次沉淀法[9-10],分别提取子实体及菌丝体DNA,用超纯水将DNA溶解后经0.8%琼脂糖凝胶电泳检测,-20℃保存备用。采用真菌通用引物ITS4 (5'-TCCTCCGCTTATTGATATGC-3') 和ITS5(5'-GGAA GTAAAA GTCGTAACAAG-3')。PCR扩增体系50μL:超纯水41μL,10×Buffer (含1.5mmol/L Mg2+)5.0μL,10mmol/L dNTP 1.0μL,引物各1.0μL,模板DNA 0.5μL,TaqDNA聚合酶0.5μL。反应参数为:94℃预变性5min;94℃变性1min,50℃退火1min,72℃延伸1min,循环30次;72℃延伸10min。扩增产物经胶回收,连接pMD19-T载体,转化大肠杆菌JM109感受态细胞,进行蓝白斑筛选和菌落PCR鉴定。将阳性转化子穿刺培养后送上海生工生物工程技术服务有限公司测序,利用Clustalx软件对测序结果进行比对分析。
1.3.5 元素分析
将长根菇子实体及1.3.3节获得的菌丝体于50℃烘干至质量恒定,研制成粉末,用电子天平称质量,待用。使用X射线光电子能谱仪分析元素含量。Al靶(1253.6eV),X光枪工作在12kV×15mA功率下,分析室本底真空2×10-7Pa,采用FAT方式,谱仪用Cu2P3/2(932.67eV),Ag3d5/(368.30eV),Au4f7/2(84.00eV)标样校正,数据采用污染碳C1s(284.8eV)校正。
1.3.6 氨基酸成分分析
将烘干的长根菇子实体、菌丝体粉碎,50℃烘干至质量恒定,研制成粉末,用电子天平称质量,待用。取适量试样,加10mL 6mol/L HCl,排除空气后110℃条件下水解22~24h。取一定量定容过滤后的水解液,真空除去HCl后以0.02mol/L盐酸溶解定容后上机检测。仪器色谱条件:日立2622SC阳离子树脂色谱柱:4.6mm× 6 0 m m;检测波长:5 7 0、4 4 0 n m;洗脱液流量:0.4mL/min;反应液流量:0.35mL/min;柱温:57℃;反应温度:1 35℃。
2 结果与分析
2.1 长根菇培养及菌丝特征

图1 长根菇菌落形态Fig.1 Colony morphology of X. radicata
在PDA培养基上接种3d后开始生长,形成圆形的菌落,颜色呈白色,15d后满皿,在pH5.0、26℃条件下菌丝生长最好(图1),与刘姣英[4]报道基本一致。从图1可知,菌丝白色、蓬松,气生菌丝旺盛。扫描电子显微镜观测其菌丝形态,结果显示长根菇菌丝生长茂密,菌丝无隔,未观测到孢子产生(图2)。

图2 电镜下长根菇菌丝形态Fig.2 SEM image of X. radicata mycelium
2.2 ITS区序列比较
采用NCBI(http://www.ncbi.nlm.nih.gov/)Blast工具对测序结果进行比对分析,结果表明,本实验长根菇菌丝体与子实体的ITS区序列同源率为100%。该序列长度为850bp(图3),G+C含量为45.53%,其与基因库(GenBank)中登录的已知序列AF321481(X. furfuracea QXW2430)、AY026919 (X. furfuracea RAG490)、FJ596855 (X. furfuracea TENN61671)、DQ494703 (X. furfuraceae AFTOL-ID 538)和AY534119 (O. radicata MKACC 50093) 的同源率在93%~97%之间,进一步证明本实验成功培养出长根菇菌丝体。
传统的真菌种类鉴定主要是依据子实体的特征,部分种类可通过出菇实验或孢子形态进行种类鉴定,但时间较长,且很多种类不能用人工培养方法培育子实体或不产生孢子,很少能直接用于种类鉴定[11-12],而利用rDNA基因的ITS区段进行PCR扩增及序列分析,已成为目前广泛用于真菌分类鉴定的方法[13-14],本实验表明长根菇菌丝体与子实体的ITS区序列同源率为100%,与GenBank中序列亦具有较高同源性,可见利用子实体与菌丝体ITS区序列的序列测定,并比对分析,可用于长根菇菌种的鉴定。

图3 长根菇子实体及菌丝体ITS区序列Fig.3 ITS sequence of mycelium and fruiting body of X. radicata cultivated
2.3 元素含量
经X射线光电子能谱仪测定,子实体中N、O、C、P元素的质量分数分别为4.04%、25.74%、67.94%、0.87%,菌丝体中N、O、C、P元素的质量分数分别为3.90%、25.82%、68.17%、0.70% (图 4)。

图4 X射线光电子能谱图Fig.4 Element analysis using X-ray photo-electron spectrometer xps
2.4 氨基酸组成
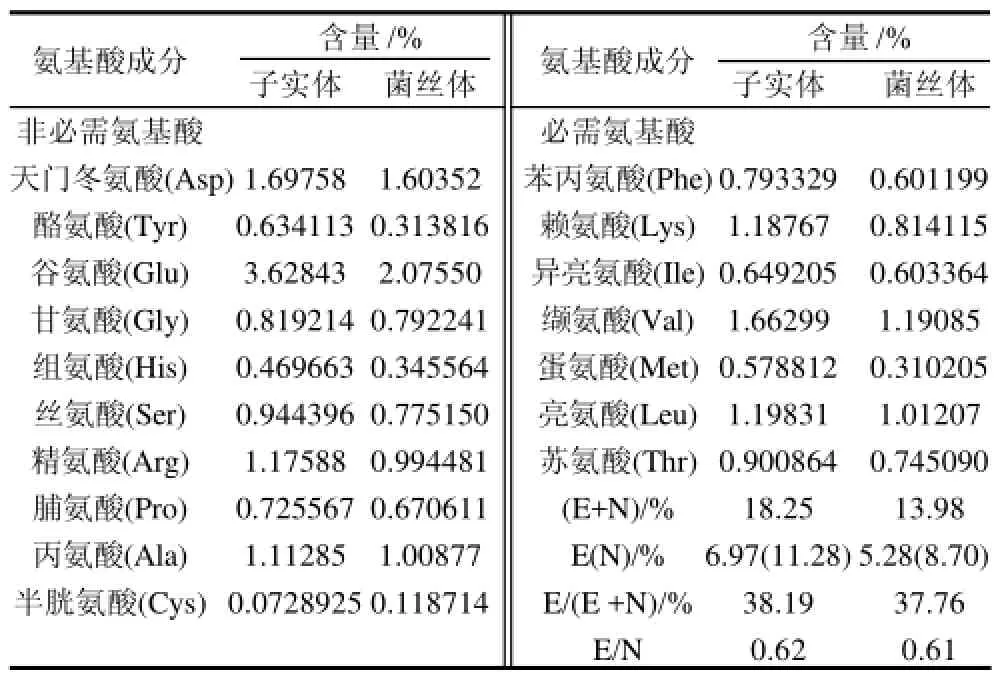
表1 长根菇子实体、菌丝体氨基酸组成与含量Table 1 Amino acids composition in fruiting body and mycelium of X. radicata
由表1可见,本实验中长根菇子实体及菌丝体中氨基酸种类丰富,含量较高。菌丝体和子实体总氨基酸含量分别为18.25%、13.98%,必需氨基酸含量分别为6.97%、5.28%,非必需氨基酸含量为11.28%、8.70%,各类氨基酸含量均比平菇[15]、白灵菇[16]等要高,必需氨基酸含量占氨基酸总量E/(E+N)的38.19%、37.76%,必需氨基酸与非必需氨基酸含量比值E/N 为0.62、0.61。
子实体及菌丝体中高含量的谷氨酸和天门冬氨酸等鲜味氨基酸赋予了长根菇鲜美的口味,谷氨酸具有促进红细胞生成、改善脑细胞营养及记忆力减退的生理作用,同时是中枢神经系统内含量最多的非特异性兴奋性氨基酸,它参与多种物质的代谢调节[15,17]。天冬氨酸是微甜味或鲜味氨基酸,使其水溶液呈微甜味[18]。缬氨酸和亮氨酸可促进正常生长,修复组织,调节血糖,并给身体提供能量。赖氨酸和精氨酸能促进儿童生长和发育。因此,从氨基酸的组成和含量看,长根菇是高氨基酸含量的食用菌佳品,长根菇菌丝体具有与子实体相近的氨基酸含量和种类分布,可为菌丝体的深加工利用提供科学依据。
3 结 论
通过对长根菇菌丝体培养、ITS区序列鉴定及氨基酸组成分析研究表明:长根菇菌丝最佳生长温度为26℃,最佳生长pH值为5.0,菌丝生长茂密,无隔,无孢子产生,ITS区基因片段的PCR扩增及测序简便、快捷,可以作为长根菇菌丝体及菌种鉴定的有效手段,其ITS区长度约为850bp。长根菇子实体及菌丝体中N、O、C、P的含量相当,子实体及菌丝体氨基酸种类齐全,含量较高,菌丝体、子实体总氨基酸含量分别为18.25%、13.98%,必需氨基酸含量分别为6.97%、5.28%,非必需氨基酸含量为11.28%、8.70%。以上研究结果不仅丰富了长根菇营养成分基础数据,而且对其营养机理研究和保健产品开发具有重要意义,研制功能性运动食品和饮料将是长根菇应用研究发展方向之一。
[1]CVETOMIR M D, BORIS A. Checklist of the larger basidiomycetes in Bulgaria[J]. Mycotaxon, 2010, 111: 279-282.
[2]PETERSEN H R, NAGASAWA E. The genus Xerula in temperate east Asia[J]. Rep Tottori Mycol Inst, 2005, 43: 1-49.
[3]王岚, 杨祝良, 张丽芳, 等. 狭义干蘑属 (蘑菇目) 概要及新的系统学处理[J]. 云南植物研究, 2008, 30(6): 631-644.
[4]刘姣英. 长根菇的液体发酵工艺及生物活性研究[D]. 武汉: 华中农业大学, 2007.
[5]田龙, 王小立, 庞振凌. 超声波辅助法浸提长根菇多糖工艺的优化[J]. 食用菌, 2006(增刊1): 77-78.
[6]彭卫红, 肖在勤, 郑林用, 等. 长根菇与鸡枞菌属间不对称融合后代特性研究[J]. 食用菌学报, 2002, 9(1): 1-5.
[7]金群力, 蔡为明, 冯伟林, 等. 有待开发的珍稀菇种长根菇的特性及其熟料袋栽技术[J]. 浙江食用菌, 2009, 17(4): 40-42.
[8]孔祥林, 骆荣, 刘鲜林, 等. 贵阳腐霉(Pythium guiyangense Su)菌丝体及无性繁殖阶段的扫描电镜形态学观察[J]. 电子显微学报, 2008, 27 (4): 332-335.
[9]邹立扣, 潘欣. 鸡枞菌形态学及其分子鉴定[J]. 食用菌, 2009, 31(2): 17-18.
[10]邹立扣, 潘欣. 粗柄鸡枞菌总DNA提取及ITS区克隆测序研究[J].北方园艺, 2009(6): 217-219.
[11]林晓民. 大型真菌的生态多样性及分子鉴定[D]. 杨凌: 西北农林科技大学, 2004.
[12]KRUGER D, KREISEL H. Proposing Morganella subg. Apioperdon subg. nov. for the puffball Lycoperdon pyriform[J]. Mycotaxon, 2003, 86: 169-177.
[13]李自慧, 冯宪敏, 卢思奇, 等.以ITS1-5.8S rDNA-ITS2 序列为标记的肺孢子菌分子系统发育研究[J]. 中国科学C辑: 生命科学, 2008, 38(4): 377-385.
[14]KAN Xianzhao, WANG Shanshan, DING Xin, et al. Structural evolution of nrDNA ITS in Pinaceae and its phylogenetic implications[J]. Molecular Phylogenetics and Evolution, 2007, 44(2): 765-777.
[15]王新风, 杨芳, 刘圣师, 等. 富硒平菇蛋白测定与氨基酸成分分析[J].食品科学, 2008, 29(12): 610-613.
[16]杨梅, 陈凌华, 石磊, 等. 白灵菇的深层培养及菌丝体氨基酸组分分析[J]. 福建师范大学学报: 自然科学版, 2006, 22(1): 77-81.
[17]承欧梅, 胡常林, 董为伟. 兴奋性氨基酸及其受体与中枢神经系统疾病[J]. 临床神经病学杂志, 1999, 12(2): 123-125.
[18]段小华, 邓泽元, 朱笃. 杜仲种子脂肪酸及氨基酸分析[J]. 食品科学, 2010, 31(4): 214-217.
Cultivation, Identification and Amino Acid Composition of Xerula radicata
ZOU Li-kou1,PAN Xin2,3,YUE Ai-ling1,LUO Yan1,LI Bei1,ZHANG Yue1,YAO Qiong1,WU Qi4,*
(1. Laboratory of Microbiology, Dujiangyan Campus of Sichuan Agricultural University, Dujiangyan 611830, China;2. College of Forestry, Sichuan Agricultural University, Ya’an 625014, China;3. College of Tourism and Town and Country Planning, Chengdu University of Technology, Chengdu 610059, China;4. College of Life Science, Sichuan Agricultural University, Ya’an 625014, China)
The mycelium of Xerula radicata was cultivated on PDA plates at different temperatures and pH values. Both morphological and molecular approaches were used to identify the fungi cultivated. The internal transcribed spacer (ITS) region in rRNA gene was cloned and sequenced, and compared with others species in the Genbank. Besides, the amino acids in the fungi cultivated was analyzed using amino acid auto analyzer. The results showed that the optimal cultivation temperature and pH was 26 ℃ and 5.0. The ITS sequence was the same between mycelium and fruiting body. The molecular marker of ITS sequence was necessary and useful. The total amino acids, essential amino acids and nonessential amino acids accounted for 18.25%, 6.97% and 11.28% in the fruiting body, and 13.98%, 5.28% and 8.70% in the mycelium, respectively. Therefore, X. radicata especially its mycelium is nutritious and can be developed into a functional food product.
Xerula radicata;cultivation;mycelium;identification;ITS region;amino acid
Q93.331;Q939.5
A
1002-6630(2011)03-0144-04
2010-04-14
邹立扣(1979—),男,副教授,博士,主要从事微生物及分子生物学研究。E-mail:zoulk124@163.com
*通信作者:吴琦(1973—),男,副教授,博士,主要从事生物化学及分子生物学研究。E-mail:wuqiwq@163.com

