花盖红菇菌丝体提取物的体外功效及组分分析
袁云辉,张树斌,姚钢乾,赵俊霞,王立安,*
花盖红菇菌丝体提取物的体外功效及组分分析
袁云辉1,张树斌1,姚钢乾2,赵俊霞3,王立安1,*
(1.河北师范大学生命科学学院,河北 石家庄 050016;2.河北旅游职业学院生物工程系,河北 承德 067000;3.河北医科大学基础医学院,河北 石家庄 050017)
采用摇瓶发酵获得花盖红菇菌丝体,用石油醚、乙酸乙酯、乙醇和水提取菌丝体活性物质,得到不同的提取物。采用清除DPPH自由基实验和抑制小鼠肝细胞脂质过氧化活性实验检测各提取物的抗氧化活性。结果显示:乙酸乙酯提取物和乙醇提取物均具有较高的抗氧化活性,其中以乙醇提取物活性最高。MTT法检测各提取物对H446肺癌细胞增殖的抑制作用,结果表明:石油醚提取物、乙酸乙酯提取物及乙醇提取物均有较高的抗肿瘤活性。采用色谱技术对乙醇提取物进行分离纯化,得到3个单一组分,分别命名为组分Ⅰ、Ⅱ、Ⅲ;经结构鉴定组分Ⅰ为1-氮杂[4,2,0]双环-4-烯-8-酮。
花盖红菇;菌丝体;乙醇提取物;抗氧化;抗肿瘤
花盖红菇(Russula cyanoxantha)又称蓝黄红菇、花盖菇。隶属于伞菌目红菇科红菇属。民间常用其子实体治疗消化不良、脾虚泄泻、涨满腹痛等症,其子实体提取物对小白鼠肉瘤180和艾氏腹水癌的抑制率分别为70%和60%[1]。高锦明等[2]曾对野生花盖红菇子实体的化学成分进行了研究,分离鉴定出6种化合物,4种麦角甾醇、D-阿洛醇及硬脂酸,并根据化合物结构特点分析了其抗肿瘤等功能。
目前,从高等真菌中寻找抗氧化、抗肿瘤等功能性物质的研究已成为国内外研究的热点。但许多高等真菌不能进行人工栽培,而自然界子实体资源又有限,采用发酵技术获取大量菌丝体已成为开发利用这些宝贵资源的重要途径。本实验利用野生花盖红菇菌丝体为材料,采用液体摇瓶发酵培养技术,对培养获得的菌丝体提取物的抗氧化、抗肿瘤活性进行测定,对活性较高的提取物的化学组分进行分离纯化及结构分析。
1 材料与方法
1.1 材料、培养基与试剂
花盖红菇(Russula cyanoxantha)采自河北省平山县驼梁山,菌丝体现保存在河北师范大学真菌生化与分子生物学实验室;H446肺癌细胞株、昆明小鼠购自河北医科大学动物中心。将小鼠脱臼处死后,立即取出肝脏称质量,以0~4℃预冷的生理盐水制成10%的肝匀浆悬液,4℃冰箱保存备用,在24h以内用完。
斜面及平板活化培养基为常规PDA培养基;液体种子培养基为不含琼脂的PDA培养基;发酵基础培养基为:葡萄糖40g/L、蛋白胨5g/L、KH2PO40.5g/L,pH值自然。
1,1-二苯代苦味肼基(DPPH) 美国Sigma公司;石油醚、乙酸乙酯、乙醇、甲醇(均为分析纯) 天津永大化学试剂有限公司;GIBCOTMRPMI(Roswell park memorial institute)1640培养基 美国Invitrogen公司;硅胶(100~200目,300~400目) 青岛海洋化工厂。
1.2 仪器与设备
真空干燥箱 上海精宏试验设备有限公司;旋转蒸发器 上海亚荣生化仪器厂;756分光光度计 上海菁华科技仪器有限公司;MK3酶标仪 热电(上海)仪器有限公司;HPLC系统 美国 Waters 公司;AutoSpec-Ultima Tof质谱 英国 Micromass公司;500MHz核磁共振波谱仪 德国Bruker公司。
1.3 方法
1.3.1 菌种活化及液体培养
从保存的试管斜面中挑取菌块,接种到平板活化培养基的中央,25℃避光培养。待平板长满后,用打孔器(d=0.5cm)在平板边缘菌丝生长旺盛的部分打孔,挑取菌块接种到装有250mL液体种子培养基的500mL三角瓶中,每瓶3块,于25℃、150r/min摇床培养4d后即得种子液。再将其转接到发酵基础培养基中,同条件下摇瓶培养4d得到培养物。
1.3.2 菌丝体提取物的制备
用4层纱布过滤摇瓶发酵培养物,收集得到菌丝体后,于真空干燥箱中50℃干燥,共得27.4g干菌丝体,粉碎后备用。
菌丝体干粉于索氏提取器中先用石油醚连续回流提取12h,再用乙酸乙酯连续回流提取12h,最后用无水乙醇连续回流提取12h。完成3次萃取的菌丝体用80℃热水浸提4h后,加两倍体积的90%乙醇过夜沉淀,离心得菌丝体多糖。各提取物经旋转蒸发去掉有机溶剂后,于50℃真空干燥,得浸膏样提取物或多糖干粉。将浸膏样提取物或多糖干粉采用分析天平称质量,计算提取物的得率。

式中:m为提取物质量;m0为菌丝体干粉质量。
1.3.3 提取物清除DPPH自由基实验
采用DPPH法,参考文献[3-4]方法进行测定。
将各提取物用无水甲醇配成质量浓度为10mg/mL的母液,然后用无水甲醇稀释为质量浓度1、0.1mg/mL的溶液,获得3种质量浓度测试样品,放于4℃冰箱备用。
分别取2mL不同质量浓度的样品于3支试管中,向各管中加入2mL浓度为2×10-4mol/L的DPPH乙醇溶液,混合均匀,30min后于波长517nm处测定其吸光度(Ai)。同时测2mL样品液+2mL无水乙醇的吸光度(Aj);2mL DPPH的乙醇溶液+2mL无水甲醇的吸光度(A0)。实验重复3次,计算各样品对DPPH自由基的清除率。

1.3.4 提取物抑制小鼠肝细胞脂质过氧化活性测定
采用硫代巴比妥酸法,参考文献[5]方法进行测定。
取每种待测溶液3mL,于波长532nm 处测其吸光度(A),实验重复3次。计算各提取物对小鼠肝细胞脂质过氧化抑制率。

式中:A0为只加肝组织匀浆的吸光度;A为加样品和肝组织匀浆的吸光度;Ab为样品的吸光度。
1.3.5 提取物抗肿瘤活性的测定
细胞培养及四甲基偶氮唑盐微量酶反应比色法(MTT)检测,参考文献[3,6]进行测定。
取对数生长期的H446肺癌细胞株(细胞浓度1×105个/mL)接种于96孔培养板中,每孔加入100μL。各提取物用二甲基亚砜(DMSO)配成终质量浓度为10mg/mL的母液。细胞培养24h后,每孔分别加入100μL各提取物(用无血清的RPMI 1640培养基稀释),终质量浓度为200、400、800μg/mL。对照组加等量的无血清RPMI 1640培养基,每个处理4次重复。于37℃、CO2培养箱培养48h后,弃去上清液,每孔加入MTT 20μL,继续培养4h,弃去上清液,每孔加DMSO 150mL,振荡混匀10min,用酶标仪测波长490nm处的吸光度(A)。计算菌丝体提取物对癌细胞增殖的抑制率。
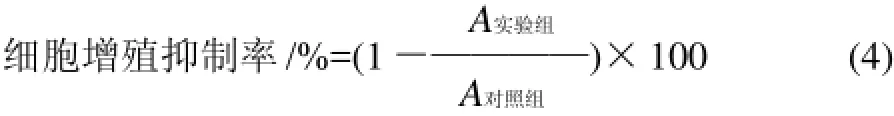
1.3.6 菌丝体乙醇提取物的分离纯化及结构鉴定
将乙醇提取物3g,用100~200目的硅胶拌样,用硅胶柱(硅胶为300~400目,柱长75cm)分离。以乙酸乙酯-甲醇系统洗脱,流速为15mL/min,收集乙酸乙酯、甲醇体积比分别为20:1、15:1、10:1时的洗脱液。将收集后的洗脱液采用旋转蒸发器于37℃去除洗脱液,对得到的组分进行定量分析。
将得到的组分采用HPLC系统检测其纯度。对单一组分通过高分辨质谱确定其相对分子质量,通过核磁共振谱确定其碳原子、氢原子的个数及每一个原子的化学位移。综合以上信息对单一组分的化学结构进行分析。
1.3.7 数据分析
实验中得到的各数据由Statistica 6.0进行单因素方差分析处理。
2 结果与分析
2.1 花盖红菇菌丝体提取物的得率

表1 花盖红菇菌丝体提取物的得率Table 1 Yield of bioactive components from mycelia of Russula cyanoxantha
由表1可知,菌丝体乙醇提取物的得率最高,为19.42%;其次为菌丝体多糖,为14.89%;石油醚和乙酸乙酯提取物的得率较少且相近,分别为5.18%和5.14%。表明在花盖红菇菌丝体液体培养条件下,可以获得大量的菌丝体乙醇提取物和多糖。
2.2 菌丝体提取物对DPPH自由基的清除率
表2 花盖红菇菌丝体提取物对DPPH自由基的清除率,n=3)Table 2 Scavenging capabilities of the extracts from mycelia of Russula cyanoxantha on DPPH free radicalsn=3)%

表2 花盖红菇菌丝体提取物对DPPH自由基的清除率,n=3)Table 2 Scavenging capabilities of the extracts from mycelia of Russula cyanoxantha on DPPH free radicalsn=3)%
注:同列字母a~e不同表示差异显著(P<0.05);同行字母x~z不同表示差异显著(P<0.05)。
提取物质量浓度/(mg/mL)1010.1石油醚提取物22.27±4.37bx6.33±0.92cy2.51±0.68cz乙酸乙酯提取物63.23±2.80cdx8.54±1.15dey1.85±1.02cz乙醇提取物87.72±0.35ax53.31±2.52ay7.69±2.06az多糖8.84±2.99ex0.61±0.35cy0.96±0.71cy
由表2可知,不同质量浓度的各提取物均有不同程度的清除 DPPH自由基的作用。其中,乙醇提取物的抗氧化活性在相同质量浓度下显著高于其他提取物。除0.1mg/mL多糖外,各提取物随着质量浓度的减小,对DPPH自由基清除率均显著降低(P<0.05)。说明提取物中的抗氧化物质含量与抗氧化活性正相关。
在质量浓度10mg/mL时,4种提取物对DPPH自由基清除能力存在明显差异。其中乙醇提取物对DPPH自由基清除能力最强,其次为乙酸乙酯提取物,再次为石油醚提取物,菌丝体多糖对自由基清除能力表现最差。在质量浓度为1mg/mL时,乙醇提取物对DPPH自由基清除能力仍表现最强;除乙醇提取物对DPPH自由基清除率下降较小外,其他各提取物对DPPH自由基清除能力均显著下降。随着质量浓度降低到0.1mg/mL,石油醚、乙酸乙酯、乙醇提取物清除DPPH自由基的能力又都显著下降。
多糖对DPPH自由基清除能力在3个测定质量浓度中均表现较低。在质量浓度为1mg/mL和0.1mg/mL时,清除率均小于1,且两者差异不显著。
2.3 菌丝体提取物抑制小鼠肝细胞脂质过氧化活性
表3 花盖红菇菌丝体提取物对小鼠肝细胞脂质过氧化的抑制率(n=3)Table 3 Inhibitory rates of the extracts from mycelia of Russula cyanoxantha on lipid peroxidation (x± s,n=3)%

表3 花盖红菇菌丝体提取物对小鼠肝细胞脂质过氧化的抑制率(n=3)Table 3 Inhibitory rates of the extracts from mycelia of Russula cyanoxantha on lipid peroxidation (x± s,n=3)%
注:同列字母a~f不同表示差异显著(P<0.05);同行字母x~z不同表示差异显著(P<0.05)。
提取物质量浓度/(mg/mL)1010.1石油醚提取物43.69±3.01cx41.53±3.71cx20.33±1.87cy乙酸乙酯提取物86.24±0.708ax74.86±1.84aey22.16±0.30cz乙醇提取物91.86±0.99ax74.56±0.38ay66.21±5.30az多糖38.59±3.43cx13.30±3.97fy8.80±4.48dy
由表3可知,不同质量浓度下花盖红菇菌丝体各提取物均表现出不同程度的抑制小鼠肝细胞脂质过氧化的作用,并且,随着质量浓度的降低,抑制脂质过氧化能力均不同程度下降,存在一定的量效关系。
在质量浓度为10mg/mL时,乙醇提取物和乙酸乙酯提取物抑制小鼠肝细胞的脂质过氧化能力较强,两者不存在显著差异;其次为石油醚提取物和多糖,两者之间的差异也不显著。在质量浓度为1mg/mL时,乙醇提取物和乙酸乙酯提取物仍表现出较强的抑制小鼠肝细胞的脂质过氧化能力,且两者不存在显著差异;其次为石油醚提取物;多糖表现最低。在质量浓度为0.1mg/mL时,乙醇提取物表现出最高的脂质过氧化抑制率,其次依次为乙酸乙酯提取物、石油醚提取物和多糖。
综合表2、3的测定结果可知,乙醇提取物的抗氧化活性最强,其次为乙酸乙酯提取物,再次为石油醚提取物。多糖具一定的抗氧化能力,但相对上述三者最弱。
2.4 菌丝体提取物的抗肿瘤活性
由表4可知,菌丝体各提取物对H446肺癌细胞的增殖均有不同程度的抑制作用,并且随着质量浓度的升高抑制作用逐渐增强。表明各提取物在抑制H446肺癌细胞的增殖方面存在一定的量效关系。
表4 花盖红菇菌丝体提取物对H446肺癌细胞增殖的抑制率,n=3)Table 4 Inhibitory rates of the extracts from mycelia of Russula cyanoxantha on the proliferation of H446 cancer cell linen=3)

表4 花盖红菇菌丝体提取物对H446肺癌细胞增殖的抑制率,n=3)Table 4 Inhibitory rates of the extracts from mycelia of Russula cyanoxantha on the proliferation of H446 cancer cell linen=3)
注:同列字母a~d不同表示差异显著(P<0.05);同行字母x~z不同表示差异显著(P<0.05)。
提取物质量浓度/(μg/mL)200400800石油醚提取物53.76±0.74ax55.70±1.58ay56.51±0.54ay乙酸乙酯提取物38.24±0.86bx43.45±2.62cy49.87±1.39bz乙醇提取物44.79±0.61bx53.20±0.52by54.86±1.05ay多糖27.15±0.58cx30.46±0.77dy35.43±1.01cz
在终质量浓度为200μg/mL时,石油醚提取物对H446肺癌细胞增殖的抑制作用最强,其次为乙醇和乙酸乙酯提取物,两者差异不显著。多糖的抑制作用最弱。在终质量浓度为400μg/mL时,石油醚提取物仍表现出最强的抑制活性,其次依次为乙醇提取物、乙酸乙酯提取物、多糖。在终质量浓度为800μg/mL时,石油醚提取物和乙醇提取物对肺癌细胞增殖的抑制作用表现最强,且两者差异不显著;其次为乙酸乙酯提取物;多糖的抑制活性仍表现最弱。
综合上述结果可以看出,花盖红菇菌丝体各提取物对H446肺癌细胞的增殖抑制能力强弱的顺序依次为:石油醚提取物>乙醇提取物>乙酸乙酯提取物>多糖。
2.5 菌丝体乙醇提取物的分离纯化及结构鉴定
以乙酸乙酯-甲醇体系洗脱,在V(乙酸乙酯):V(甲醇)=20:1时得到组分Ⅰ(10mg);在V(乙酸乙酯):V(甲醇)= 15:1时得到组分Ⅱ(3mg);在V(乙酸乙酯): V(甲醇)=10:1时得到组分Ⅲ (3mg)。经HPLC系统检测均为单一组分(图1~3)。

图1 组分Ⅰ的高效液相检测图谱Fig.1 HPLC chromatograph of Fraction I
组分Ⅰ为黄色浸膏(甲醇),其质谱、核磁共振谱分析数据为:F A B-M S m/z:1 2 3%[M]+,分子式(C7H9NO);1H-NMR(DMSO,500MHz):δ3.8(H3)、2.1(H4)、5.7(H5)、5.9(H6)、2.1(H7)、3.7(H8);13CNMR(DMSO,500MHz):δ164.8(C1)、47.9(C3)、47.1(C4)、131.3(C5)、125.6(C6)、28.5(C7)、40.2(C8)。

图2 组分Ⅱ的高效液相检测图谱Fig.2 HPLC chromatograph of Fraction II

图3 组分Ⅲ的高效液相检测图谱Fig.3 HPLC chromatograph of Fraction III
根据上述数据确定组分Ⅰ的相对分子质量为123,为1-氮杂[4,2,0]双环-4-烯-8-酮;化学结构式如图4所示。
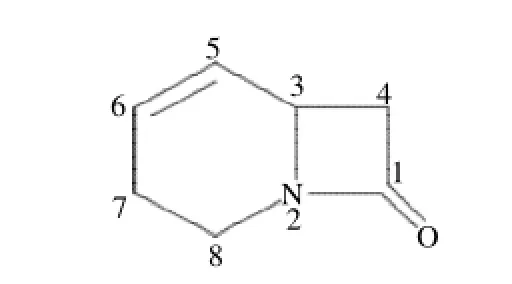
图4 乙醇提取物中分离到的组分Ⅰ的结构式Fig.4 Structural formula of Fraction I from ethanol-soluble portion (1-aza-bicyclo [4.2.0] oct-4-en-8-one)
3 讨 论
目前,已开发利用的天然抗氧化剂多来自植物材料,主要有香辛料提取物、茶多酚类、天然黄酮类、维生素类、蛋白质和酶类、类胡萝卜素、植酸等几类物质[7]。近年,对高等真菌中天然抗氧化剂的研究与开发已成为该领域的新热点。本实验证实,花盖红菇菌丝体各提取物中乙醇提取物的抗氧化活性最强。此外,Tsai等[8]在对猪肚菇(Clitocybe maxima)、阿魏蘑(Pleurotus ferulae)、糙皮侧耳(P. ostreatus)3种食用菌子实体提取物的研究中也发现乙醇提取物清除DPPH自由基能力最强,并且报道主要抗氧化成分为酚类物质。本实验中花盖红菇菌丝体乙醇提取物的得率也最高,为19.42%,为进一步将高等真菌乙醇提取物开发为天然抗氧化剂提供了科学依据。
本实验结果表明花盖红菇菌丝体3种具不同极性有机溶剂的提取物均具不同程度的抗氧化活性,表明高等真菌中抗氧化物质的复杂性。Ju等[9]报道了桦褐孔菌(Inonotus obliquus) 子实体中含有香草酸、儿茶酸、紫丁香酸等抗氧化活性物质,进一步证明高等真菌中含有多种不同类型的抗氧化物质。
在本实验中,花盖红菇菌丝体多糖的抗氧化活性表现较差,与其他报道略有不同。如Meng等[10]报道羊肚菌(Morchella esculenta)菌丝体胞外多糖具有较强的清除超氧阴离子自由基和羟自由基能力,并且具有还原能力,说明不同来源真菌多糖其抗氧化活性可能不同。另外,多糖抗氧化活性强弱可能还与糖苷键的连接方式有关, Sun等[11]对绿红菇(Russula virescens)抗氧化活性多糖研究发现,高活性多糖中,1→6糖苷键占 68.3%,1→3糖苷键占31.7%;低活性多糖中,1→6糖苷键占7.9%,1→2糖苷键占9.6%,1→4糖苷键占35.7%,1→3糖苷键占46.8%。多糖的抗氧化活性可能还与纯度有关。陶明煊等[12]报道,金顶侧耳(P. citrinopileauts)、姬菇(P. cornucopiae)和毛头鬼伞(Coprinus comatus)精多糖与粗多糖相比,对超氧阴离子自由基清除率分别提高62.5%、58.3%和51.5%;对羟自由基清除率分别提高33.1%、42.3%和33.2%;对DPPH自由基清除率分别提高56.0%、63.5%和60.3%,粗多糖经精制后,自由基清除能力明显提高。
肿瘤目前仍是人类健康的首要威胁,从大型真菌中寻找抗肿瘤药物已成为一个重要研究方向。其中大型真菌多糖具有提高免疫力、抗肿瘤的作用已得到科学研究的普遍证实[13-14],但最新研究发现,真菌多糖在诱导癌细胞凋亡、抑制致肿瘤物激活酶、激活解毒酶等方面也具重要作用[15-16]。目前,市场上以食药用菌多糖为原料的保健产品很多,其中,灵芝多糖、香菇多糖、茯苓多糖和裂褶菌多糖等注射液作为癌症患者治疗的辅助药物,已在临床上得到正式应用。但从本研究的结果看,花盖红菇多糖抗H446肺癌细胞的活性并不强,可能与多糖抗肿瘤主要是通过提高机体免疫力而不是直接杀伤肿瘤细胞有关。而石油醚、乙酸乙酯、乙醇提取物均表现较强的抗肿瘤活性,暗示着这些提取物中存在着直接杀伤或诱导癌细胞凋亡的物质,对这些成分进一步分离纯化,有助于寻找具有新型结构的抗癌化合物。
本实验在对抗氧化、抗肿瘤活性较高的乙醇提取物进行分离纯化过程中,获得了3种组分。获得的组分Ⅰ是一个类似于头孢类母核的β-内酰胺类成分,据其结构推测可能具有广谱的抗菌作用,并且未见文献报道。另外两种组分Ⅱ和Ⅲ,由于量较少,不适合采用NMR进行结构分析,未获得理想结果。这方面的研究笔者仍在继续。
高等真菌“创造系数”很高,含多种多样的生物活性物质,如萜类、黄酮类、酚类物质,凝集素、甾类化合物等。这些天然生物活性物质化学结构多样而且新颖,这种化学结构的多样性对于现代保健品、药物的开发和农药先导物质的发现至关重要[17]。以液体培养技术为基础,以活性跟踪为导向,系统研究高等真菌活性物质的化学成分和药理作用,不仅可以拓宽其活性物质研究空间,形成一个新的研究领域,而且也可积极推进真菌化学与药学等多学科的相互渗透、相互交叉,为人类健康造福。
[1]黄年来. 中国大型真菌原色图鉴[M]. 北京: 中国农业出版社, 1998: 224-225.
[2]高锦明, 董泽军, 刘吉开. 蓝黄红菇的化学成分[J]. 云南植物研究, 2000, 22(1): 85-89.
[3]赵俊霞, 袁广峰, 徐瑞雅, 等. 草菇培养物中粗三萜和黄酮含量及抗氧化抗肿瘤活性研究[J]. 菌物学报, 2007, 26(3): 426-432.
[4]丰永红, 于淑娟, 李国基. DPPH 法测甘蔗提取物抗氧化活性研究[J]. 甘蔗糖业, 2003(1): 31-33.
[5]ASKAWA T, MATSUSLUTA S. Thiobarbituric acid test for detecting lipid peroxides[J]. Lipid, 1980, 14: 401-406.
[6]郑琳, 黄荫成, 高清祥. 白阿魏蘑粗提物抗氧化和抗肿瘤活性的研究[J]. 菌物学报, 2005, 24(1): 71-78.
[7]眭红卫. 天然抗氧化剂的开发研究与应用前景[J]. 武汉商业服务学院学报, 2006, 20(3): 82-84.
[8]TSAI S Y, HUANG S J, LO S H, et al. Flavour components and antioxidant properties of several cultivated mushrooms[J]. Food Chemistry, 2009, 113: 578-584.
[9]JU H K, CHUNG H W, HONG S S. Effect of steam treatment on soluble phenolic content and antioxidant activity of the Chaga mushroom (Inonotus obliquus)[J]. Food Chemistry, 2010, 119: 619-625.
[10]MENG Fanyun, LIU Xiaonan, JIA Le, et al. Optimization for the production of exopolysaccharides from Morchella esculenta SO-02 in submerged culture and its antioxidant activities in vitro[J]. Carbohydrate Polymers, 2010, 79(3): 700-704.
[11]SUN Zhongwei, ZHANG Lixiang, ZHANG Bin, et al. Structural characterisation and antioxidant properties of polysaccharides from the fruiting bodies of Russula virescens[J]. Food Chemistry, 2010, 118(3): 675-680.
[12]陶明煊, 王峰, 刘俊, 等. 3种食用菌多糖自由基清除作用研究[J]. 食品科学, 2009, 30(23): 135-137.
[13]耿建芳, 肖月升. 食用菌多糖抗肿瘤的免疫调节作用探讨[J]. 时珍国医国药, 2006, 17(5): 855-856.
[14]陈艳. 中药多糖抗肿瘤机制研究进展[J]. 药学与临床研究, 2010, 18 (2): 123-126.
[15]李松, 吴青华, 陈畅, 等. 多糖抗肿瘤活性的最新研究进展[J]. 中国生化药物杂志, 2007, 28(3): 213-215.
[16]陈义勇, 顾小红, 汤坚. 桦褐孔菌多糖IOP3a的分离纯化及其体外抗肿瘤活性研究[J]. 食品科学, 2010, 31(15): 91-94.
[17]刘吉开. 高等真菌化学[M]. 北京: 中国科学技术出版社, 2004: 1-7.
Bioactivity and Chemical Components of Mycelial Extracts of Russula cyanoxantha
YUAN Yun-hui1,ZHANG Shu-bin1,YAO Gang-qian2,ZHAO Jun-xia3,WANG Li-an1,*
(1. College of Life Science, Hebei Normal University, Shijiazhuang 050016, China;2. Department of Biology Engineering, Hebei Tourism Vocational College, Chengde 067000, China;3. College of Basic Medical, Hebei Medical University, Shijiazhuang 050017, China)
Russula cyanoxantha was cultured using liquid fermentation medium. Mycelia of Russula cyanoxantha were subjected to extraction by petroleum ether (PE), ethyl acetate (EA) and ethanol, respectively. Antioxidant activities of different extraction fractions were evaluated by scavenging capacity on DPPH free radicals and inhibitory rate of lipid peroxidation. Results indicated that EA-soluble extract and ethanol-soluble extract had better antioxidant activities and the ethanol-soluble extract revealed the highest antioxidant capability. MTT assay indicated that PE, EA and ethanol extracts had obvious inhibition effects on the proliferation of H446 cancer cells, suggesting the anti-tumor activities of these extracts. The compositions of ethanol extract from mycelia of Russula cyanoxantha were analyzed. Three fractions were achieved by chromatographic separation as Fraction I, II and III, respectively. Fraction I was identified as 1-aza-bicyclo [4.2.0] oct-4-en-8-one by IR, FAB-MS,1H NMR,13C NMR, HSQC and HMBC methods.
Russula cyanoxantha;mycelia;ethanol extract;antioxidant activity;anti-tumor activity
Q939.5
A
1002-6630(2011)03-0223-05
2010-04-19
河北省自然科学基金项目(C2008000155);河北省教育厅重点研究计划项目(ZH2007107)
袁云辉(1982—),男,硕士研究生,主要从事真菌生物化学研究。E-mail:yuanyunhui82827@163.com
*通信作者:王立安(1965— ),男,教授,博士,主要从事真菌天然产物研究。E-mail:wlian1965@126.com

