不同释放速度瘤胃调控剂对瘤胃亚急性酸中毒体外发酵参数的影响
董利锋 王之盛 杜 宇
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,雅安 625014)
不同释放速度瘤胃调控剂对瘤胃亚急性酸中毒体外发酵参数的影响
董利锋 王之盛*杜 宇
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,雅安 625014)
本试验通过在体外构建瘤胃亚急性酸中毒(SARA)模型,来研究不同释放速度的瘤胃调控剂对SARA体外发酵特性及牛链球菌数量的影响。选取3头育肥期并安装永久性瘤胃瘘管的宣汉黄牛,于晨饲2 h后采集瘤胃内容物,滤液作为体外发酵液的接种物,通过添加玉米与白酒糟(1∶1)的方式诱导体外发生SARA。借助于构建成功的SARA体外模型,设置4个试验处理:对照组、6 h完全释放组、8 h完全释放组和10 h完全释放组。在诱导SARA之后的0、2、4、6、8、10、12 h取样测定瘤胃各发酵指标及牛链球菌的相对数量。结果表明,与对照顾组相比,各试验组瘤胃液pH均极显著升高(P<0.01),乙酸、丙酸、丁酸、乳酸和总挥发性脂肪酸(total volatile fatty acids,TVFA)浓度也显著降低(P<0.05)。结果显示,8 h完全释放组不仅有效提高了瘤胃液pH,缓解了SARA状态,还对稳定瘤胃液环境和促进微生物的生长有显著效果。
瘤胃调控剂;释放速度;瘤胃亚急性酸中毒;发酵参数
瘤胃亚急性酸中毒(subacute rumen acidosis,SARA)是肉牛快速育肥阶段和高产奶牛生产中普遍存在的亚健康疾病。研究表明,SARA不仅能够降低饲粮干物质采食量及产奶量,严重时还可造成肝脏脓肿和瘤胃炎,严重时甚至导致死亡[1]。同时,研究还发现SARA使得瘤胃内pH持续偏低(pH<5.5),造成瘤胃内内毒素含量增加且内毒素透过瘤胃壁膜进入到血液循环系统,严重时引发蹄叶炎等一系列疾病[2-3]。目前,防治瘤胃亚急性酸中毒的传统措施除了调控饲粮中精粗料的比例之外,添加碱性缓冲物质也是一种常用的治疗方法。为了缓解SARA对生产的影响,生产上普遍采用直接添加小苏打、氧化镁等碱类物质,它们虽能够通过缓冲瘤胃内挥发性脂肪酸及乳酸对瘤胃的影响,调节渗透压及增加瘤胃液外流速度来防治SARA,但酸碱中和反应剧烈,容易对瘤胃壁膜及微生物菌群造成伤害[4]。20世纪80年代国外报道了制备反刍动物瘤胃缓释制剂的研究,但其缓释制剂多用于提高反刍动物抗胃肠道寄生虫能力或作为营养补充剂。采用缓释技术处理碱性物质来减慢其与瘤胃内酸类物质的中和反应时间、缓解瘤胃SARA的研究尚未见报道。因此,本试验旨在通过采用包被材料处理的碱性缓冲物质及瘤胃微生物生长所需的微量元素,减慢其在瘤胃内释放速度,从而降低瘤胃内过量的酸类物质[如挥发性脂肪酸(VFA)、乳酸等],稳定pH,从而达到缓解SARA的目的,为缓释瘤胃调控剂在防治SARA上的深入研究和生产实践提供理论参考。
1 材料与方法
1.1 瘤胃液的采集
本试验选用3头育肥期并安装有永久性瘤胃瘘管的宣汉黄牛。试验饲粮参照NRC(1981)肉牛饲养标准,每日于07:00和18:00分2次饲喂,自由饮水。于晨饲后2 h采瘤胃内容物,经4层消毒纱布过滤并混匀持续充入CO2气体5 m in,保温,滤液作为体外发酵液的接种物。
1.2 体外发酵液和底物的制备
厌氧人工瘤胃缓冲液按Menke等[5]的方法配制。发酵底物采用风干玉米和鲜白酒糟,分别粉碎后过40目筛,备用。
1.3 瘤胃调控剂的制备
本试验选取碳酸氢钠、氧化镁等物质,与适量羟丙基甲基纤维素(HPMC)、无水乙醇等混匀制备,方法参照赵新慧等[6]。缓释片剂体外释放度根据中国药典二部附录XD释放度测定第一法“转篮法”测定。最终制得6、8、10 h完全释放速度瘤胃调控剂。
1.4 试验设计
本试验采用单因素试验设计,3个试验组分别为6 h完全释放组、8 h完全释放组和10 h完全释放组,对照组为不添加HPMC的完全释放组。每组4个重复,每个重复1个发酵瓶,在成功建立体外SARA模型之后将瘤胃调控剂分别加入各组发酵瓶内,以此点记为起始点,并在随后的 2、4、6、8、10、12 h取样,保存待分析。
1.5 体外发酵
本试验采用Menke等[5]的人工产气法进行体外培养。准确称取底物(玉米、鲜白酒糟各4 g)于240 m L发酵瓶中混合后迅速密封,速置于39℃人工瘤胃培养箱中90 r/m in震荡进行连续培养。通过测定瘤胃液pH及持续的时间,确定成功建立体外 SARA 模型之后分别于 0、2、4、6、8、10、12 h 取瘤胃液样,保存备用。
1.6 测定指标与方法
pH采用PHS-3C型高精度酸度计测定,瘤胃液VFA采用胡伟莲等[7]的气象色谱法条件测定。乳酸测定方法参照文献[8]。采用16S rRNA寡核苷酸探针杂交定量分析法测定牛链球菌的相对含量。牛链球菌16S rRNA序列数据来自于核糖体核酸数据库(RDP),通过比对排列,选择特异性的寡核苷酸序列为探针[9](表 1)。

表1 牛链球菌寡核苷酸探针序列Table 1 Sequence of S.bovis oligonucleotide probe used for hybridization analysis
1.7 数据处理
数据经Excel2003整理后,采用SPSS 18.0统计软件中One-way ANOVA过程进行方差分析,并采用Duncan氏法进行多重比较,结果以平均值±标准误来表示。
2 结果
2.1 体外SARA模型的建立
图1显示了以玉米与鲜酒糟(1∶1)为发酵底物的体外发酵过程中瘤胃液pH在18 h内的动态变化。由图1可知,体外发酵瘤胃液中的pH随着时间的进行不断下降,约在7 h时达到了5.5,且持续时间超出了8 h。表明SARA模型建立成功。

图1 瘤胃液pH随时间变化曲线图Fig.1 Curve of rumen fluid pH changed with time
2.2 不同释放速度瘤胃调控剂对瘤胃液pH及VFA含量的影响
从表2中可知,在12 h内各试验组的瘤胃液pH都得到了提高。其中对照组为不添加缓释材料完全释放的瘤胃调控剂,在2 h时瘤胃液pH达到了6.64,极显著高于其他各组(P<0.01)。各处理提高瘤胃液pH的程度由于其释放速度的不同,对瘤胃液pH的升高不一致。6 h完全释放组瘤胃pH上升速度最快,在4 h时达到了6.11,极显著高于8 h完全释放组(P<0.01)和10 h完全释放组(P<0.01),但是极显著低于对照组(P<0.01)。8 h完全释放组在10和12 h分别达到了6.26和6.27,与10 h 完全释放组差异不显著(P>0.05)。

表2 不同释放速度瘤胃调控剂对体外SARA模型瘤胃液pH的影响Table 2 The effect of different releasing rates of rumen modulators on pH in vitro induced by SARA
由表3可以看出,在SARA过程中,瘤胃液内VFA总量及各组分含量均随着时间的推移呈现出降低的趋势,而6 h完全释放组乙酸/丙酸比随着发酵的进行而不断下降。在0 h时,各组分含量之间差异不显著(P>0.05),对照组自2 h起,VFA及各组分含量显著低于各试验组(P<0.01),而乙酸/丙酸自4 h起显著高于其他各组(P<0.01)。
2.3 不同释放速度瘤胃调控剂对瘤胃液内乳酸及牛链球菌含量的影响
由表4中可以看出,在2 h时对照组乳酸含量急剧下降,极显著地低于各试验组(P<0.01)。但在6 h之后随着瘤胃内pH的稳定,乳酸含量逐渐增加,在12 h时达到0.08 mmol/L。10 h完全释放组由于调控剂释放速度较慢,所以在前8 h内乳酸含量逐渐降低,在12 h时降到了0.06 mmol/L。8 h完全释放组乳酸含量先降后升,在6 h达到0.15 mmol/L之后逐渐下降,在12 h时达到最大值0.16 mmol/L,极显著高于其他各组(P<0.01)。
牛链球菌占全部细菌的相对含量与乳酸的变化相似。对照组在10 h时下降至最低值0.16%,极显著低于其他各试验组(P<0.01)。8 h完全释放组在前4 h逐渐下降,在随后的6 h逐渐增加,在12 h时达到最大值1.06%,显著高于其他各组(P<0.01)。
3 讨论
3.1 体外SARA模型建立的评价
瘤胃pH是判定是否发生SARA的一个重要指标,常以5.5来作为衡量 SARA发生的临界pH[10]。目前关于判定SARA发生的临界pH研究很多[11-12],但一般来说当瘤胃 pH 低于 5.5 时,纤维分解菌的活性显著降低,VFA质子化程度增加(pKa≈4.9),更容易造成瘤胃内一系列的剧烈波动[13]。同时,有研究认为瘤胃 pH低于5.5持续8 h以上方可判定为SARA状态[14]。以玉米和鲜酒糟为体外发酵底物能够显著降低瘤胃液pH。当玉米∶鲜酒糟=50∶50时,瘤胃液pH在6 h下降至5.6,并持续到 18 h时的5.3,持续时间大于10 h以上。因此采用玉米∶鲜酒糟=50∶50为体外发酵底物能够成功构建SARA体外模型。
3.2 不同释放速度瘤胃调控剂对瘤胃液pH及VFA含量的影响
碳酸氢钠和氧化镁能够有效缓解酸类物质形成的低pH,还可以增加反刍动物唾液的分泌。在生产中通常采用一次性灌注或添加大剂量的碱性物质来缓解SARA,但剧烈的中和反应不仅会对反刍动物瘤胃壁膜产生损害,还会严重破坏瘤胃内微生物菌群生长环境。有研究发现,通过使反刍动物舔舐碳酸氢钠和氧化镁与糖蜜的混合物可以减缓碱类物质的摄入,从而避免对瘤胃的损伤[15]。但也有研究指出处于SARA状态的反刍动物不会主动地采食碳酸氢钠来缓冲瘤胃内酸性环境[16]。

表3 不同释放速度瘤胃调控剂对体外SARA模型VFA含量的影响Table 3 The effect of different releasing rates of rumen modulators on VFA content in vitro induced by SARA
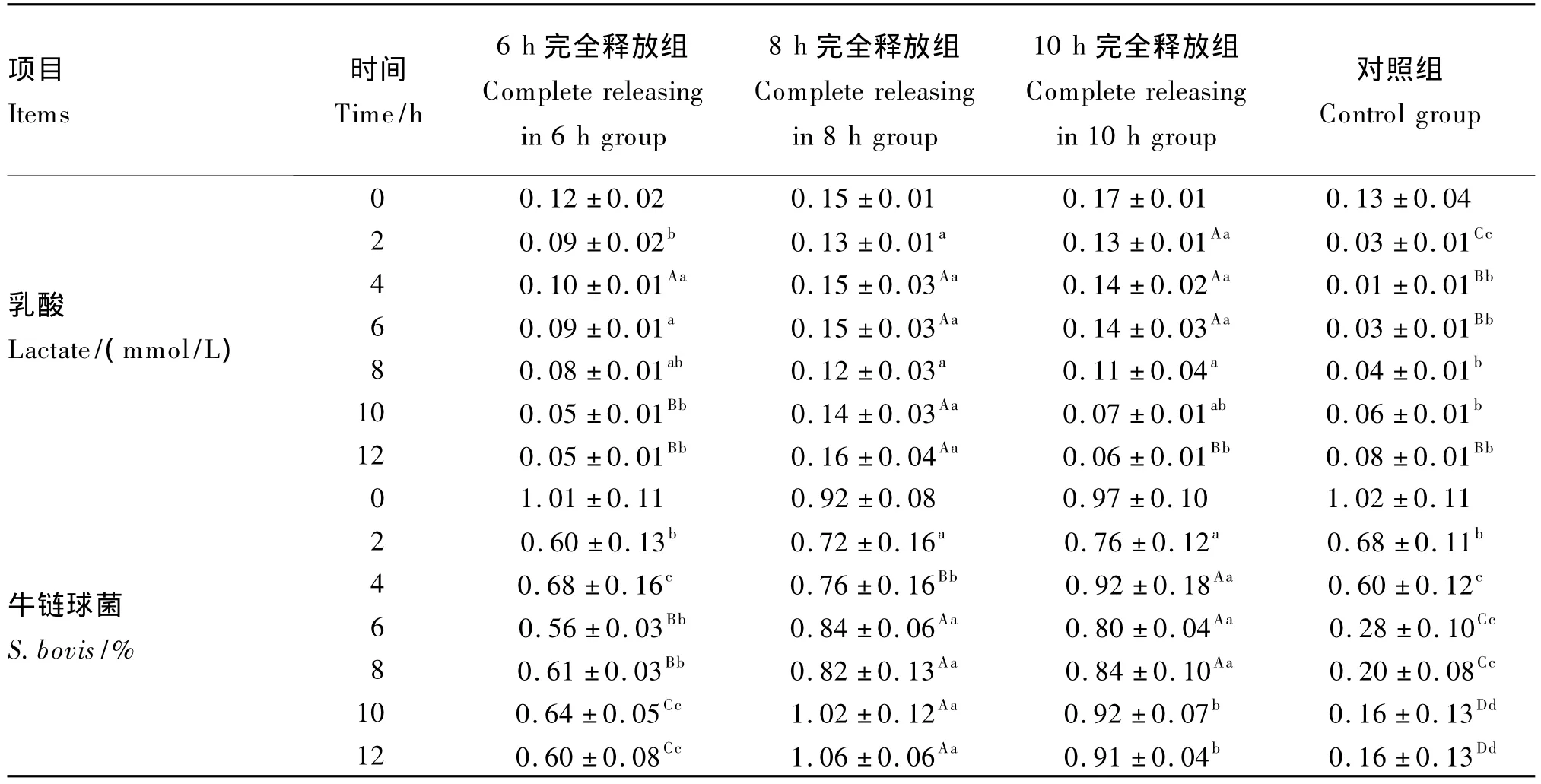
表4 不同释放速度瘤胃调控剂对体外SARA模型乳酸及牛链球菌相对含量的影响Table 4 The effect of different releasing rates of rumen modulators on lactate concentration and S.bovis population in vitro induced by SARA
本试验各处理显著提高了瘤胃液pH,实现了稳定瘤胃内环境的目的,其中以对照组pH的上升变化最为显著。这表明对照组内的碱性物质快速释放,与瘤胃内有机酸发生了剧烈的中和反应,从而使得pH下降幅度远远高于各试验组。而各试验组由于调控剂释放速度的不同,瘤胃内pH改变的幅度也呈现不同的变化。8 h完全释放组在6 h时瘤胃pH上升到了6.06,6 h完全释放组和10 h完全释放组在相同时间点分别达到了6.39和5.95。而8 h完全释放组在10 h之后pH逐渐上升,可能是调控剂在与酸类物质中和之后,瘤胃液内有机酸浓度降低,使得瘤胃液中pH有上升的趋势。
研究表明VFA是SARA产生的主要原因。可发酵碳水化合物在瘤胃内迅速发酵之后产生的VFA超出瘤胃壁膜的吸收能力之后,在瘤胃内积累造成瘤胃内pH持续下降。当瘤胃pH低于5.5时,VFA质子化程度加深[15],更容易与碱类物质发生中和反应。8 h完全释放组在缓和瘤胃液pH方面与其他处理没有显著差异,但从瘤胃液内各种VFA的含量上可以看出,8 h完全释放组在10 h之后,乙酸、丙酸和丁酸含量呈现增加的趋势,其中12 h时TVFA含量明显高于10 h含量。6 h完全释放组丙酸和丁酸含量在10 h时虽有增加的趋势,但上升幅度显著低于8 h完全释放组。原因可能因为8 h完全释放组的调控剂在经过与瘤胃液中VFA中和之后,瘤胃液内产VFA细菌数量也显著高于其他各组。原因可能是8 h完全释放组在10 h之后瘤胃内低pH环境得到缓解,瘤胃微生物菌群尤其是纤维分解菌的生长得到恢复,从而VFA的生成量增加。与各试验组相比,对照组过快的释放速度使得瘤胃液内乙酸、丙酸、丁酸和TVFA含量迅速下降并且持续保持在最低的水平。原因可能是对照组调控剂完全快速释放,与瘤胃内有机酸迅速结合,使得瘤胃液内发酵环境发生了剧烈的变化,影响甚至抑制了瘤胃微生物菌群正常的生理功能。因此可以推断8 h完全释放组调控剂的释放速度可能更符合瘤胃内酸类物质的产生速度,保持较为稳定的瘤胃内环境。
有研究认为适量的丁酸对瘤胃细胞生长具有双向调节作用。丁酸浓度的提高对瘤胃乳头生长具有促进作用。8 h完全释放组丁酸含量在12 h时虽然低于正常状态下瘤胃内丁酸含量13.46 mmol/L,但极显著地高于其他各组(P<0.01)。同时,调控剂内含有的硫酸钴、硫酸锌、烟酸是增加瘤胃内微生物菌群活性所必需的微量元素。在SARA状态下瘤胃微生物菌群受到持续低pH的影响,其活性及生理功能受到抑制,严重阻碍瘤胃发酵的正常进行。有研究认为虽然瘤胃能合成烟酸来满足反刍动物的营养需要,但高于通常营养水平的烟酸可刺激瘤胃微生物的恢复和生长。8 h完全释放组在10 h之后瘤胃内VFA的量逐渐增加,原因一方面可能是调控剂中碱性物质中和了有机酸,缓解了低pH对微生物菌群的刺激作用,另一方面也可能是钴、锌、烟酸等微量元素的添加促进了瘤胃内微生物菌群的恢复和生长,从而使得发酵产生的VFA量增加。
3.3 不同释放速度瘤胃调控剂对瘤胃液内乳酸及牛链球菌含量的影响
乳酸是瘤胃微生物底物发酵产生的另一种酸性物质。它的酸性(pKa=3.9)约是VFA(pKa=4.9)的10倍,有研究认为在SARA状态下,乳酸含量较低不是引发SARA的直接原因,但有大量研究表明乳酸会加剧SARA状态。本试验在0 h SARA时各组乳酸含量在0.15 mmol/L左右,与肖训军等[17]的研究结果相近。8 h完全释放组在2 h时乳酸含量下降,原因是加入调控剂之后,碱类物质迅速与瘤胃液内各种酸类物质进行缓冲,使得乳酸含量降低,在8 h时乳酸含量达到了最低值。但同时由于瘤胃内耐酸性微生物的存在和瘤胃内pH的逐渐稳定,使瘤胃内微生物继续发酵产酸,结果导致乳酸含量不断增加。这表明,8 h完全释放组调控剂的释放速度一方面减缓了瘤胃内pH,另一方面对瘤胃内微生物菌群的生长并没有产生剧烈的破坏作用,因而使瘤胃内产酸微生物能够得以继续生长,这与表2中8 h完全释放组TVFA含量在10 h后含量增加相一致。
牛链球菌是瘤胃内重要的淀粉分解菌,大量研究证实,随着饲粮精料水平的提高,瘤胃淀粉分解菌的比例逐渐提高。但SARA状态下瘤胃内持续的低pH会抑制牛链球菌的生长[18]。有研究表明,当精料水平为35%时,奶牛瘤胃内淀粉分解菌占总细菌数的14%,当精料水平提高至75%时,牛链球菌的比例降到6%。本试验中8 h完全释放组在8 h之前牛链球菌的数量不断下降,一方面可能是由于调控剂虽然对瘤胃内酸类物质进行了缓冲,但并没有完全解除较低pH对牛链球菌生长的抑制作用,另一方面也可能是碱性物质的释放改变了瘤胃内牛链球菌的生长环境,抑制了其生长。但在10 h后牛链球菌的数量逐渐增加,在12 h时显著高于其他各组。表明当调控剂与酸性环境达到一个稳定时期之后,瘤胃内微生物开始继续生长,进行正常的发酵。
4 结论
①不同释放速度的瘤胃调控剂能够显著提高瘤胃液pH,降低酸类物质在瘤胃内的积聚。
②8 h完全释放组不仅可以对瘤胃内酸类物质进行缓冲,还可以有效地稳定瘤胃内微生物菌群生长的环境,促进SARA状态下牛链球菌生理功能的恢复和生长,保障瘤胃发酵功能的持续进行。由此可知,8 h完全释放组瘤胃调控剂对缓解体外SARA效果显著。
[1]BEVANS D W,BEAUCHEM IN K A,SCHWARTZKOPF-GENSWEIN K S,et al.Effect of rapid or gradual grain adaptation on subacute acidosis and feed intake by feedlot cattle[J].Journal of Animal Science,2005,83:1116-1132.
[2]EMMANUEL D G V,DUNN SM,AMETAJB N.Feeding high proportions of barley grain stimulates an inflammatory response in dairy cow s[J].Journal of Dairy Science,2008,91:606-614.
[3]KHAFIPOUR E,KRAUSE D O,PLAIZIER JC.A grain-based subacute rum inal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation[J].Journal of Dairy Science,2009,92:1060-1070.
[4]PATON L,BEAUCHEM IN K,VIERA D,et al.Use of sodium bicarbonate,offered free choice or blended into the ration,to reduce the risk of rum inal acidosis in cattle[J].Canadian Journal of Animal Science,2006,86:429-437.
[5]MENKE K H,STEINGASSH.Estimation of the energetic feed value obtained from chem ical analysis andin vitrogas production using rumen fluid[J].Animal Research and Development,1988,28:7 -55.
[6]赵新慧,刘陶世,段金廒.羟丙基甲基纤维素对左金胃漂浮缓释片的漂浮性能和药物释放特征的影响[J].中成药,2009,29(7):988 -992.
[7]胡伟莲,王佳堃,吕建敏,等.瘤胃体外发酵产物中甲烷和有机酸含量的快速测定[J].浙江大学学报:农业与生命科学版,2006,3(2):217 -221.
[8]张元庆,孟庆翔.毛茛科植物提取物添加量对瘤胃微生物体外动态发酵的影响[J].中国畜牧杂志,2007,43(5):27 -31.
[9]EHSAN K,LISC,JAN C P,etal.Rumenm icrobiome composition determ ined using two nutritional models of subacute rum inal acidosis[J].Applied EnvironmentMicrobiology,2009,75(22):7115 -7124.
[10]COOPER R,KLOPFENSTEIN T,STOCK R,et al.Effect of rumensin and feed intake variation on rum inal pH[R].Universrty of Nebraska:Nebraska Beef Cattle Reports,1997.
[11]PLAIZIER J C.Replacing chopped alfalfa hay with alfalfa silage in barley grain and alfalfa-based total m ixed rations for lactating dairy cows[J].Journal of Dairy Science,2004,87:2495-2505.
[12]BEAUCHEM IN K A,YANG W Z,RODE L M.Effects of particle size of alfalfa-based dairy cow diets on chew ing activity,rum inal fermentation,and m ilk production[J].Journal of Dairy Science,2003,86:630-643.
[13]BERGMAN E N.Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J].Physiology Review,1990,70:1580 -1588.
[14]DARREN W B.Effect of the number of step-up diets fed during grain adaption on acidosis and feeding behavior of feedlot cattle[D].Master thesis.Saskatoon:the University of Saskatchewan,2005.
[15]KRAUSE K M,DHUYVETTER D V.Effect of a low-moisture buffer block on rum inal pH in lactating dairy cattle induced with subacute rum inal acidosis[J].Journal of Dairy Science,2009,92:352-364.
[16]KEUNEN JE,PLAIZIER JC,KYRIAZAKIS I,et al.Short communication:effects of subacute rum inal acidosis on free-choice intake of sodium bicarbonate in lactating cows[J].Journal of Dairy Science,2003,86:954-957.
[17]肖训军,孟庆翔.反刍动物瘤胃酸中毒及其调控[J].中国畜牧杂志,2001,37(5):6 -8.
[18]ASCHENBACH JR,GABEL G.Effect and absorption of histam ine in sheep rumen:significance of acidotic epithelial damage[J].Journal of Animal Science,2007,8:464-470.
*Corresponding author,professor,E-mail:wangzs007@yahoo.com.cn
(编辑 赵天章)
Effect of Different Release Rate of Rum en Modulators on Ferm entation Characteristicsin vitroInduced by SARA
DONG Lifeng WANG Zhisheng*DU Yu
(Institute of Animal Nutrition,Sichuan Agricultural University,Key Laboratory for Animal Disease-resistance Nutrition of China Ministry of Education,Ya’an625014,China)
The aim of this study was to evaluate the effect of different release rate of rumenmodulators on fermentation characteristics andS.bovisnumberin vitroby the means of induced by subacute rumen acidosis(SARA)model.ThreeXuanhansteers fitted with permanent rum inal cannulas were used and SARA was induced by adding corn and fresh distilled grain(1∶1).Then this experimentwas divided into 4 groups:6 h release group,8 h release group,10 h release group and the control group.The sampleswere taken at0,2,4,6,8,10 and 12 h after the SARA modelwas induced and the rumen fermentation parameterswere determ ined andS.bovisnumberwas quantitated using 16S rRNA oligocecleotoide probe hybridization.The results showed that pH in all trial groupswere significantly increased compared with that in the control group(P<0.01),and ruminal acetate,propionate,butyrate and TVFA concentrations were significantly decreased(P<0.05),while rum inal lactate content decreased significantly(P<0.05).The results indicate 8 h release group can effectively reduce pH,promote the growth ofm icroorganisms and improve the rumen fermentation.[Chinese Journal of Animal Nutrition,2011,23(9):1608-1614]
rumen modulator;release rate;SARA;fermentation characteristics
S816.7
A
1006-267X(2011)09-1608-07
10.3969/j.issn.1006-267x.2011.09.021
2011-03-14
资金项目:现代农业(肉牛)产业技术体系专项经费资助(CARS-38)
董利锋(1985—),男,河南巩义人,硕士研究生,从事反刍动物营养与饲料资源开发的研究。E-mail:dunlifeng@gmail.com
*通讯作者:王之盛,教授,博士生导师,E-mail:wangzs007@yahoo.com.cn

