抗草丁膦转基因玉米不同DNA提取方法及PCR检测
杨慧珍,车 丽,任志强,肖建红
(1.山西省农业科学院作物科学研究所,山西太原030032;2.山西省农业科学院现代农业研究中心,山西太原030031)
杂草为害是造成玉米(Zeamays L.)减产的重要因素之一。植物基因工程技术的诞生和发展,为玉米抗除草剂育种提供了一条有效的途径[1]。
李敬娜等[2]以pCambia3301载体为基础,以玉米Ubiquitin(Ubi)启动子、拟南芥叶绿素转运肽(Chloroplast transit peptide,Ctp)基因、抗草甘膦Epsps基因为元件,构建了玉米高效双元表达载体,通过冻融法将重组质粒导入根癌农杆菌LBA4404,并通过农杆菌介导法转化玉米幼胚,获得了抗草甘膦无抗生素标记的转基因玉米植株。马云霞等[3]采用根瘤农杆菌(Agrobacterium tumefaciens)介导法将抗草甘膦基因(sxglr-11)导入优良玉米再生系HiII,获得抗除草剂转基因植株。关于抗草丁膦转基因玉米的研究,Sawahel[4]用电击法将bar基因导入了玉米幼胚中,获得了抗除草剂玉米材料。李国圣等[5]利用基因枪法将als基因导入了玉米愈伤组织中,获得了转基因玉米。朱常香等[6]利用基因枪法将bar基因导入了玉米自交系的幼胚中,获得了抗除草剂转基因玉米自交系。bar基因转化水稻等[7]也获得了抗除草剂转基因植株。bar基因(bialaphos resistance gene)编码膦丝菌素乙酰转移酶(phosphinothricin acetyltransferase,PAT),而PAT蛋白能使除草剂草丁膦(glufosinate)脱毒,从而使转bar基因的作物具有抗除草剂的性状[8]。
用PCR方法检测转基因玉米已有不少报道,包括常规PCR检测[9]、定性PCR检测[10]、多重PCR检测[11]和实时定量PCR检测[12]等。
本研究通过不同植物总DNA的提取方法,对转基因材料PCR分析时设置内源标准基因,探讨和分析其PCR扩增产物的大小及序列准确性,建立一个快速、有效的转基因玉米及其产品的检测方法,旨在为有关研究提供一定的理论及技术依据。
1 材料和方法
1.1 材料
植物材料为花粉介导法导入bar基因(启动子为CaMV35S启动子)到玉米自交系黑玉2号所获得的转基因种子,它来自山西省农业科学院生物技术研究中心;非转基因对照玉米自交系黑玉2号种子由山西省农业科学院品种资源研究所提供。
1.2 引物的设计与合成
CaMV35S启动子引物序列、玉米内标准基因Zein引物序列和外源基因bar基因引物序列如表1所示。所用引物均由上海生工生物工程公司合成,用TE稀释为100mmol/L。

表1 引物序列及扩增片断长度
1.3 总DNA提取
将玉米种子研磨成细粉,装入2mL离心管中,用改良 PEX法、CTAB法[13]和 SDS法[14]分别提取总DNA。
改良PEX提取方法为:每管分别加入PEX提取液 (PEX 12.5mmol/L;Tris-Cl 100mmol/L;NaCl700mmol/L;EDTA 10mmol/L(pH 值 8.0);PVP 6%)500μL,于65℃水浴中保温20min;然后分别加入400μL Tris饱和酚,400μL氯仿/异戊醇(24∶1,V/V),轻轻颠倒混匀,冰浴放置5min,11 000 r/min离心10min;取上清液至另一2mL离心管中,加入等体积的氯仿/异戊醇,轻轻颠倒混匀,冰浴放置5min,11 000 r/min离心10min;再取上清液至新的2mL离心管中,加入1/10体积的5mol/L乙酸钠,混匀数分钟后,加入9/10体积的冷异丙醇,轻轻颠倒混匀,-20℃放置30min,然后13 000 r/min离心12min;弃上清,加入200μL 70%乙醇,颠倒数次漂洗沉淀,13 000 r/min离心1min。同样方法再用70%乙醇漂洗1次;待乙醇蒸发完后,加入40μL TE缓冲液,溶解DNA。
于0.8%琼脂糖凝胶电泳观察提取DNA的效果,用核酸蛋白检测仪测定DNA浓度,并用1×TE将总DNA稀释至100 ng/μL备用。
阳性对照DNA按照分子克隆实验指南[15]进行。
1.4 PCR扩增
建立PCR扩增体系:体积20μL,10×缓冲液(含 Mg2+)2.0 μL,dNTPs(2.5mmol/L)1.6 μL,模板DNA 2.0μL,引物各0.8μL,Taq酶(5U/μL)0.4μL,用无菌去离子水定容至20μL。反应在PT-100型PCR仪上进行。试验设阴性对照和空白对照。
扩增反应程序为:94℃预变性5min,94℃变性1min,退火1min,72℃延伸1min,进行35个循环,循环结束后72℃延伸10min,4℃保存。不同引物的退火温度分别为:CaMV35S启动子55℃,Zein基因55℃,bar基因55℃。反应结束后取PCR扩增产物8μL,经1.0%琼脂糖凝胶电泳检测(含溴化乙锭),用DL 2 000 DNA Marker为参照判断扩增产物的大小,用SYN凝胶成像系统照相。当PCR扩增产物大小与预期结果一致时,用生工公司生产的回收试剂盒回收DNA,并送生工公司测序。
2 结果与分析
2.1 提取DNA的纯度和浓度
首先用SDS,CTAB和改良PEX 3种方法分别提取3份DNA样品,所提取的DNA经0.8%琼脂糖凝胶电泳分离,SYN成像系统观察(图1),发现这3种方法所提取DNA在凝胶上形成一条整齐的条带,除CTAB法提取的DNA在前方有少量RNA污染物出现外,其他2种方法提取的DNA质量都较高。

经核酸蛋白检测仪测定,这3份DNA的质量浓度达到 600~800μg/mL,OD260/OD280值在2.0左右,OD260/OD230值在1.6~1.8之间,均达到对DNA进行分析的要求(表2)。但综合这3种植物DNA提取方法,按一个流程计,PEX方法比SDS方法节省0.45 h,比CTAB方法节省2.0 h。

表2 提取DNA在核酸蛋白检测仪上的测定结果
本着检测方法快速、准确的特点,本研究选用PEX法提取其余植物材料DNA,并做进一步的PCR分析。
2.2 抗草丁膦转基因玉米PCR检测方法建立
用CaMV35S和bar引物进行PCR扩增的结果如图2所示。不含模板DNA的空白对照无扩增产物出现,说明PCR操作过程无污染。用Zein引物从转基因和非转基因黑玉2号均扩增出151 bp的产物,这与玉米中Zein片段的大小一致,说明从非转基因对照玉米和转基因玉米中所提取的DNA能有效地进行PCR扩增。用CaMV35S和bar引物扩增时,产物与预期大小(195,552 bp)相似,说明用这2对引物能从转基因玉米中扩增出目标片段。
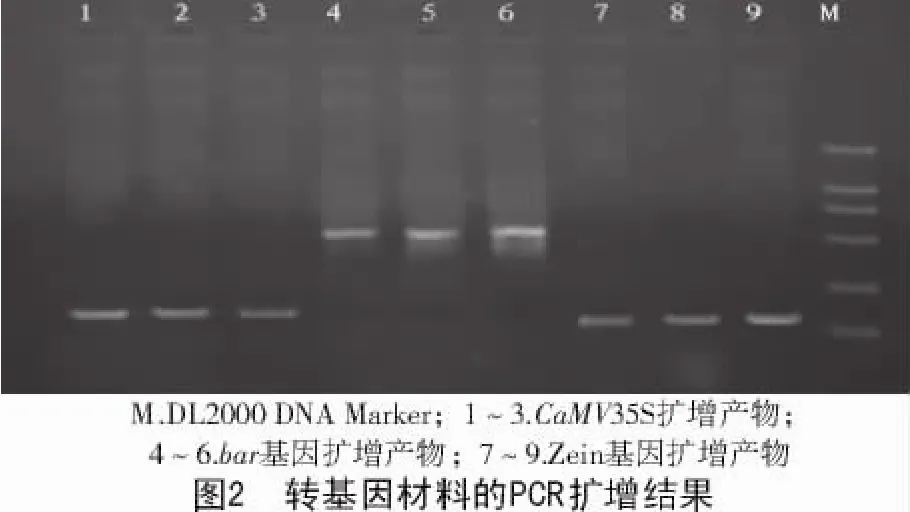
为了验证扩增片段是否为目的基因,将用CaMV35S启动子和bar基因引物从转基因植物中扩增的片段分别回收测序,将测序结果用Blast进行同源性分析。从扩增片段与全长bar基因极高的相似性可以看出,扩增片段为CaMV35S启动子和bar基因,用这2对引物从转基因植物中扩增出了目标基因,因此,可以用这2对引物鉴定抗草丁膦转基因玉米。
3 讨论
关于植物基因工程,转化方法主要有农杆菌介导法、基因枪法、非组培法[16]等,所获得转基因植物及其产品的快速检测也有不少报道,主要是建立适合PCR分析的植物总DNA的快速提取方法[17]。
本研究采用3种方法分别提取植物总DNA,其中,改良PEX法每个流程比SDS法节省0.45 h,比CTAB法节省2.0 h,而且提取的DNA的浓度、纯度测定结果显示均可满足PCR检测分析及其他分子检测的要求,且PCR检测结果也符合预期目的。改良PEX提取DNA结合PCR检测,无疑是一种快速、有效的转基因玉米及其产品的检测方法。
[1]宋小玲,强胜,刘琳莉,等.抗除草剂转基因作物基因流及其安全性评估方法的探讨 [J].农村生态环境,2005,21(3):74-77.
[2]李敬娜,刘亚,李翔,等.抗草甘膦基因表达载体的构建及对玉米的遗传转化[J].华北农学报,2010,25(4):44-48.
[3]马云霞,王秀红,白建荣,等.农杆菌介导的抗草甘膦基因(sxglr-11)的玉米遗传转化[J].山西农业科学,2009,37(6):13-16.
[4]SawahelW A.Production ofherbicide-resistant transgenicmaize plants using electroporation of seed-derived embryos[J].Plant Molecular Biology Reporter,2002,20(3):303-304.
[5]李国圣,杨爱芳,张举仁,等.玉米愈伤组织的遗传转化及抗除草剂植株再生[J].科学通报,2000,45(20):2181-2184.
[6]朱常香,宋云枝,张杰道,等.抗除草剂转基因玉米的获得及遗传研究[J].山东农业大学学报:自然科学版,2002,33(2):120-125.
[7]孙海波,李艳萍,邹美智,等.提高转bar基因杂交粳稻大田纯度的试验[J].天津农业科学,2004,10(2):13-16.
[8]刘洪艳,弭晓菊,崔继哲.bar基因、PAT蛋白和草丁膦的特性与安全性[J].生态学杂志,2007,26(6):938-942.
[9]陈颖,陈哲,徐宝梁,等.玉米加工食品中转基因成分的PCR检测[J].粮食与饲料工业,2003(2):44-46.
[10]袁磊,赵蕾,孙红炜,等.转基因玉米的定性PCR检测[J].山东农业科学,2010(11):8-10.
[11]邵碧英,陈文炳.玉米及其制品中转基因成分的单一PCR及多重 PCR 检测[J].食品科学,2005,26(9):380-384.
[12]曹际娟,覃文,朱水芳,等.用实时荧光PCR方法鉴定转基因玉米 T14/T25[J].遗传,2004,26(5):689-694.
[13]王关林,方宏筠.植物基因工程[M].2版.北京:科学出版社,2002:743-744.
[14]王景雪,孙毅,高武军.一种简便实用的植物总DNA提取方法[J].山西大学学报:自然科学版,2000,23(3):271-272.
[15]Sambrook J,Fritsch E F,Maniatis T.分子克隆实验指南[M].2版.北京:科学出版社,1992:19-24.
[16]任海红,任小俊,王英,等.非组培遗传转化法在农作物上的应用[J].山西农业科学,2010,38(11):85-88.
[17]孟祥栋,马红,盖树鹏.快速提取用于PCR分析的几种蔬菜 DNA的方法 [J].应用与环境生物学报,1998,4(3):251-254.

