2例致死性家族性失眠症的临床特点、脑影像和朊蛋白基因分析
周珏倩 王倩 李洵桦 高玉娟△陈定邦 方子妍郭汝宁黎艾陈操 周伟 董小平 曾进胜
致死性家族性失眠症(Fatal Familial Insomnia,FFI)是一种罕见的常染色体显性遗传性疾病,是遗传性朊蛋白病(Prion)的一种类型。自从1986年Lugaresi等[1]首次报道以来,迄今全球仅报道了 80 余例[2],我国只有寥寥数例报道[3-5]。我院于2010年4~5月间连续收治了2例FFI患者,积累了本病的相关资料,进一步提高对此病的认识,有助于早期诊断、判断预后,减少漏诊和误诊,现将我们收治的2例患者的临床和生物学特征及随访结果总结如下。
1 资料和方法
1.1 研究对象 来自2010年4~5月在中山大学附属第一医院神经科的2例致死性家族性失眠症住院患者。病例1为女性,48岁,广东省汉族人,入院前病程约2年。病例2为男性,31岁,广东省汉族人,入院前病程半年。FFI的诊断标准见参考文献[6]。
1.2 方法
1.2.1 血液及脑脊液检查 入院后2例患者均进行常规的血液及脑脊液检查,包括血常规、肝肾功能、风湿组合、抗中性粒细胞胞浆抗体组合、结核抗体、血沉、肿瘤标志物、梅毒、人类免疫缺陷病毒抗体的检测。内分泌方面除了空腹血糖、甲状腺和甲状旁腺功能外,还检测了甲状腺抗体、性激素、皮质醇;脑脊液检查包括常规、生化、14-3-3蛋白。
1.2.2 电生理及影像学等检查 对病例1进行了动态心电图、动态血压、多导睡眠图、脑电图、头颅MRI及PET CT检查。由于病例2病情重,入院后病情急转直下,入院第三天即进入昏迷状态,故仅做了头颅MRI及PET CT检查,未及进行动态心电图、动态血压、多导睡眠图、脑电图检查。
1.2.3 朊蛋白(Prion Protein,PrP)基因测序 ①DNA提取:抽取患者外周静脉血5 mL,EDTA抗凝,4℃保存。应用试剂盒提取基因组DNA,于-20℃冰箱内保存备用;②PCR扩增:引物由上海英骏生物技术有限公司合成,上游引物:5-GGC AAA CCT TGG ATG CTGG-3,下游引物:5-CCC ACT ATC AGG AAG ATG AGG-3。PCR反应体系:总体积50 μL,包括:10×PCR buffer 5 μL,2.5 mmoLdNTPs 4 μL,引物各1 μL(10 pmoL),Taq酶 0.5 μL,模板 DNA3μL,ddH2O 35.5 μL(补足 50 μL)。反应条件:94 ℃ 5 min ,94℃ 40 s、55 ℃ 40 s、72℃ 40 s共30个循环,72℃延伸10 min。PCR产物为759 bp;③PrP基因测序:利用QIAGEN试剂盒对PCR产物进行纯化,再送中国疾病预防控制中心做进一步的检测和测序。测序结果与标准人PrP基因序列进行比对。
2 结果
2.1 临床特点 2例FFI患者均有阳性家族史,在成年起病。早期均突出表现为睡眠障碍且苯二氮艹卓类药物治疗无效,此后出现精神行为异常、认知功能损害、构音障碍及自主神经功能障碍。
但2例患者在主要临床表现、疗效与转归方面也存在差异。病例1入院时以意识模糊、共济运动障碍为主,而病例2以皮质醇、血糖、尿素氮等内脏和内分泌功能紊乱为主,意识状态、运动系统则大致正常。同样使用曲唑酮(商品名:美抒玉)等改善睡眠以及加强营养支持等治疗,病例1病情趋稳定而出院,死亡时总病程3年余;病例2病情进展迅速,于入院4天后死亡,总病程6个月。
2.2 血液及脑脊液检查结果病例2的皮质醇、血糖、肝肾功能均有异常,脑脊液14-3-3蛋白阳性,但病例1均正常。余所查血液及脑脊液检查结果均基本正常。详见表1。
2.3 电生理及影像学检查结果例1患者的觉醒期间脑电图主要为散在的低幅慢活动,少数散在低幅的α波和α活动,及δ活动。患者没有明显睡眠周期,似睡非睡时期的δ活动、睡眠梭形波、K复合体均明显减少。提示患者脑功能弥漫受损。多导睡眠图显示睡眠结构显著紊乱,非快速眼动期睡眠中I期明显增多,约占整个睡眠期97.3%,II、III期及快速眼动期睡眠则显著减少。
两例患者的头颅MRI均显示大脑和小脑轻度萎缩,以额叶明显。MRA示脑动脉远端分支较纤细、普遍减少,走行略僵硬。见图1和图2A。PET-CT检查结果均显示,2例患者呈现双侧顶叶、双侧额叶、双侧丘脑葡萄糖代谢对称性轻度减低,同时伴轻度脑萎缩。见图2B。
2.4 PrP基因测序 2例患者均发现PrP基因532位碱基G突变为A,导致178位氨基酸由天冬氨酸变为天冬酰胺(D178N),129位氨基酸多态性为M/M型。见图3A和3B。在病例2还发现173位碱基为T-C的变异。经过与人类基因库进行比对,发现它是多态性变化。

表1 2例患者的实验室检查结果
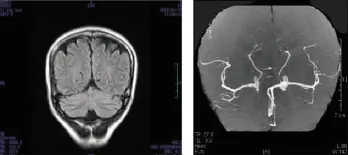
图1 病例1头颅MRI T2加权成像显示顶叶较显著的脑萎缩。MRA示脑动脉远端分支较纤细、普遍减少,走行略僵硬
2.5 典型病例 病例1,女性,48岁,汉族人。因“入睡困难2年余,行走不稳、行为异常2月”于2010年4月15日入院。患者2年余前无明显诱因出现入睡困难,伴焦虑,曾诊断“神经衰弱”,予对症治疗后略有好转。入院前2月左右患者入睡困难加重,睡觉时出现双手摸索、拽拉、双下肢踩踏、蹬腿或互相摩擦的动作,伴口中喃喃自语或咀嚼、吞吐口水等动作。随病程进展上述动作幅度逐渐增大,白天也常有自言自语,逐渐无法接触。不能独立行走,在旁人扶持下行走时躯干后倾、足跟着地、步态摇晃不稳。记忆力明显下降。伴有视幻觉、惊恐,汗液分泌显著增加。上述症状逐渐加剧,曾多次于外院予“帕罗西汀、阿普唑仑”等治疗,症状无明显好转。病后食欲可,但体重减轻。
患者姐姐有类似病史,具体不详,发病半年后死亡,生前无明确诊断。
入院查体:生命体征平稳;但神智模糊无法正常交流。时间、地点、人物定向力异常,近、远事记忆力下降,计算力明显下降;存在视幻觉;行走时脚后跟着地、躯干后倾;除构音不清外,余颅神经检查正常;四肢肌张力、肌力正常,未见不自主运动;双侧指鼻试验、误指试验、跟膝胫试验欠准确,快速轮替试验笨拙,Romberg's睁闭眼均阳性;全身深浅感觉检查未见异常;双侧肢体腱反射对称存在,病理征(-);颈无抵抗,双侧克氏征、布氏征阴性。
入院后给予曲唑酮改善睡眠,同时予以对症支持治疗,住院20余天后带药出院。跟踪随访至死亡时总病程3年2个月。
病例2,男性,31岁,汉族人。因“睡眠障碍、精神、行为异常6月余”于2010年5月25日入院。患者于2009年12月在医院照顾因类似症状而入院的父亲时渐感疲劳、睡眠不足。其父亲去世后患者开始出现睡眠障碍,先表现为易醒,逐渐出现入睡困难,伴睡眠中有不自主蹬腿、抓拿等动作,后期出现睡眠中突然起床从事拖地、刷牙、反复穿衣/脱衣等协调的活动。白天常常自言自语,同时感到胃部不适,纳差,食欲进行性下降。有幻听,听到耳边有声音在议论他,但见不到说话的人。称有人想害他。讲话声小欠清。记忆力下降。于当地医院诊断“抑郁症”,治疗无好转,上述症状逐渐加重,全身乏力。近1月来出汗增多。病后精神、食欲、睡眠差,体重下降30~40斤。
患者父亲2009年7月患类似病于病后9个月死亡,诊断不详。
入院查体:生命体征平稳,神志清楚,主动性差,时间、地点、人物定向力异常,近、远事记忆力及计算力明显减退;除构音欠清、饮水呛咳和吞咽困难外,其余颅神经检查均无异常;步态正常,四肢肌张力、肌力正常,未见不自主运动;全身深浅感觉检查未见异常;共济运动正常,双侧腱反射对称减弱,病理征(-),双侧掌颏反射阳性;颈无抵抗,双侧克氏征、布氏征阴性。
入院后给予美抒玉改善睡眠,加强肠内、外营养等支持治疗,病情仍迅速恶化,住院第4天后死亡。总病程6个月。
3 讨论
FFI为一种常染色体显性遗传病[1],本病的诊断[6-8]主要依据临床特征以及阳性家族史、脑电图、多导睡眠图、PrP基因检测等综合做出诊断。该病的临床特征为顽固性失眠,伴有交感神经功能亢进及自主神经和内分泌功能紊乱,如:多汗、不明原因的高热、心动过速、高血压、呼吸不规则等。患者表现为运动功能失常,肌阵挛、震颤、共济失调、反射亢进、肌强直等。痴呆症状不明显,但可有轻度记忆力衰退及注意力不集中。常有幻觉并以“梦境”状态出现。内分泌紊乱有褪黑素、泌乳素、生长激素等的日夜周期性分泌节律失调,促肾上腺皮质激素分泌减少,皮质素分泌增加[2-3]。平均发病年龄为50岁,典型病程在7~36个月之间,平均病程大约18个月[9]。本文2例患者发病时均已成年,符合FFI的起病年龄特点。病程为6个月、36个月,也与FFI的典型病程相符。两者均以进行性的失眠为主要症状,伴随精神紊乱、认知功能障碍以及自主神经功能障碍,临床表现也与FFI特点一致。但2例患者的病情特点有所不同,病程差异也较大,病例1的突出临床特点为意识障碍、共济运动障碍,内分泌功能却大致正常。而病例2的突出临床症状是内分泌功能紊乱,表现为皮质醇显著升高、血糖降低,意识、运动系统等其他神经系统表现却大致正常。尽管2例患者最终结果都是死亡,但是两者的病程明显存在差异,例2病情进展迅速。上述2例患者不同的临床特征提示FFI的临床表型确实具有异质性。
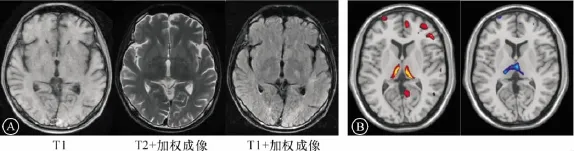
图2 A:病例2的MRI显示患者脑萎缩,以额、颞叶明显;B:病例2的PET-CT显示双侧顶叶、双侧额叶、双侧丘脑对称性葡萄糖代谢轻度减低
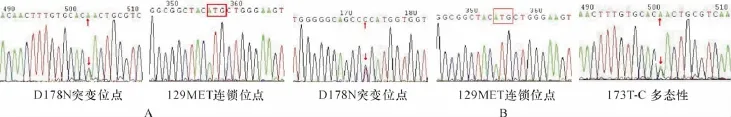
图3 A:病例1的PRNP基因检测结果;B:病例2的PRNP基因检测结果
FFI的病理特征是选择性丘脑变性[10],以丘脑腹前核和背内侧核受累最严重,可见神经元明显丢失;丘脑和下橄榄核也可见星形胶质细胞增生;大脑皮质海绵状变性、小脑浦金野氏细胞减少等。而本研究的两例患者的电生理及影像学检查结果均提示全面脑功能衰退,以双侧顶叶、额叶、丘脑功能障碍为主,与文献报道基本一致[2-8,10]。
FFI存在临床表型的异质性一直受到关注,但至今其发生机制仍未阐明。大量研究表明疾病的个体差异绝大部分原因都是遗传因素所引起。鉴于FFI与PrP基因密码子178处的GAC-AAC的点突变、与第129位多态性密码子表达甲硫氨酸(MET)密切相关[7],学者们将研究重点集中在对PrP基因与临床表型的相关性分析。有研究认为FFI患者129位点上为MET纯合子,与更短的病程、更多的丘脑损害以及更轻的皮质改变相关,而129位点上杂合子MET/VAL则与长病程以及更广泛的皮质海绵状神经病理损害相关[11-12]。也有研究发现在起病年龄和病程方面,MET纯合子病程持续时间明显短于MET/VAL或VAL纯合子患者。意大利作者也提出在FFI表型的患者中129MM纯合子患者的病程持续时间最短[13]。但Padovani等[13]、Medori等[14]比较了密码子 129 纯合子和杂合子患者间的一些因素,如发病年龄、病程、组织病理所见和PrP-res沉着物,他们推测基因多态位点129并不能调节FFI的表型表达,遗传异质性和环境因素可能在FFI的表型异质性中起到重要作用。国内Shi等[3]报道一个FFI家系,有相同基因突变的患者,但发病年龄范围从21岁~48岁,也支持这种观点。
本研究的结果不支持 Montagna等[11]、Padovani等[13]、Monari等[12]的观点。本报道的 2 例患者均为129位点上MET纯合子,但临床表现和病程转归却差异很大。例1患者病程较长,具有明显的认知功能损害及运动损害症状,提示患者存在广泛的皮质损害;例2患者则病程极短,意识清醒,具有显著的内分泌障碍症状,提示其有更多的丘脑损害以及更轻的皮质改变。因此,本研究进一步证实了PrP基因多态位点129并不能调节 FFI的表型表达,与 Padovani等[13]、Medori等[14]、Shi等[3]的观点相一致。鉴于本研究中的 2 例患者PrP基因存在完全一致的典型的178密码子突变和129密码子MET纯合子连锁,例2与例1的重要区别在于同时还存在173位碱基多态性变化,推测可能是173位碱基变异与某些外界环境因素共同作用从而影响了疾病的表型,使得病程、病情、临床表现方面均存在差异。这有待今后的研究进一步证实。
鉴于2例患者的临床表现、各项检测结果虽然各有异同,但是都存在PrP基因178密码子突变和129密码子MET纯合子。因此,建议在临床工作中对于具有上述临床表现的患者,应重视对PrP基因检测。如果发现存在典型的178密码子突变、129密码子MET纯合子,可明确诊断为FFI。
另外,值得注意的是,本文报道的病程较长的例1患者,脑脊液14-3-3蛋白是阴性,而病程极短的例2患者的脑脊液14-3-3蛋白检测则为阳性。推测可能与例2的病变严重、病情凶险有关。提示脑脊液14-3-3蛋白检测或许可以成为判断患者病情的一项临床指标。由于本研究例数很少,尚无法得出肯定的结论。我们将继续对此观察、研究。
[1]Lugaresi E,Medori R,Montagna P,et al.Fatal familial insomnia and dysautonomia with selective degeneration of thalamic nuclei[J].N Engl J Med,1986,315(16):997 –1003.
[2]Gallassi R,Morreale A,Montagna P,et al.Fatal familial insomnia:behavioral and cognitive features[J].Neurology,1996,46(4):935-939.
[3]Shi XH,Han J,Zhang J,et al.Clinical,histopathological and genetic studies in a family with fatal familial insomnia[J].Infect Genet Evol,2010,10(2):292 -297.
[4]张敏,梅元武,魏桂荣,等.致死性家族性失眠症一例临床及基因特征[J].中华神经科杂志,2005,38(10):628 -631.
[5]骆翔,贾清,霍江涛,等.家族性致死性失眠症临床及相关特征[J].卒中与神经疾病,2007,14(6):353 -356.
[6]郭玉璞,王维治.神经病学[M].人民卫生出版社,2006,640-641
[7]Pasquale M,Pierluigi G,Pietro C,et al.Familial and sporadic fatal insomnia[J].Lancet Neurol,2003,2(3),167 -176
[8]Spacey SD,Pastore M,McGillivray B,et al.Fatal familial insomnia-the first account in a family of Chinese descent[J].Arch Neurol,2004,61(1):122 -125.
[9]Gambetti P,Parchi P,Petersen RB,et al.Fatal familial insomnia and familial Creutzfeldt-Jakob disease:clinical,pathological and molecular features[J].Brain Pathol,1995,5(1):43 - 51.
[10]Gambetti P,Parchi P,Chen SG.Hereditary Creutzfeldt-Jakob disease and fatal familial insomnia[J].Clin Lab Med,2003,23(1):43-64.
[11]Montagna P,Cortelli P,Avoni P,et al.Clinical features of fatal familial insomnia:phenotypic variability in relation to a polymorphism at codon 129 of the prion protein gene[J].Brain Pathol,1998,8(3):515 –520.
[12]Monari L,Chen SG,Brown P,et al.Fatal familial insomnia and familial Creutzfeldt-Jakob disease:Different prion proteins determined by a DNA polymorphism[J].Proc Natl Acad Sci USA,1994,91(7):2839 -2842.
[13]Padovani AD,Alessandro M,Parchi P,et al.Fatal familial insomnia in a new Italian kindred[J].Neurology,1998,51(5):1491–1494.
[14]Medori R,Tritschler HJ.Prion protein gene analysis in three kindreds with fatal familial insomnia(FFI):codon 178 mutation and codon 129 polymorphism[J].Am J Hum Genet,1993,53(4):822-827.

