凡纳滨对虾内质网膜转运通道蛋白基因Sec61γ的克隆及表达分析
熊建华,盛小伟、,高永华、,李文兰,杨彦豪,陈晓汉
(1.广西水产研究所遗传育种与健康养殖重点实验室,广西南宁530021;2.桂林理工大学化学与生物工程学院,广西桂林541000)
Sec61γ基因编码是内质网膜转运通道蛋白Sec61的一种亚基[1]。在真核生物中,Sec61是一种位于内质网上的跨膜复合体,是转运功能蛋白的运输通道[2],其主要功能是形成一个疏水通道。在新生肽链的共翻译转运过程中,由于新生肽链的N端带有正电荷,不能轻易易位进入疏水的内质网膜,要完成蛋白质的转运,必然要形成一个蛋白引导通道,让核糖体合成的新生多肽通过并穿过内质网的内腔[3-4]。通道的形成涉及Sec61复合体与核糖体、内质网膜蛋白三者的相互作用[5]。目前,关于Sec61通道主要基因的研究主要集中在微生物[6]、果蝇[7]和哺乳动物[8]。对于 Sec61γ 基因的认识仅限于其作为Sec61通道一个亚基,其单独的功能研究鲜见报道。本研究中,作者在构建的凡纳滨对虾Litopenaeus vannamei生长性状差减cDNA文库中筛选并克隆得到凡纳滨对虾Sec61γ基因氨基酸序列,研究了其在不同组织和不同生长期肌肉中的表达模式,旨在为进一步弄清该基因复合物的结构与功能的关系以及在凡纳滨对虾生长和发育中的作用提供参考资料。
1 材料与方法
1.1 材料
实验用凡纳滨对虾取自国家级广西水产研究所南美白对虾良种场。选择一个生长性状分离的对虾家系,在水族箱中暂养7 d,充气,使其适应实验室内养殖环境。实验用海水是用盐卤配制的,盐度为28,水温为28℃。
实验所用Taq DNA聚合酶购自北京百泰克生物技术有限公司;SYBR Green Master荧光定量PCR试剂盒、PCR-SelectTMcDNA Subtraction kit购自大连宝生物工程有限公司;扩增试剂盒购自Clontech公司;M-MLV反转录酶购自Promega公司;pMD18-T克隆载体、dNTP购自北京天根生化科技有限公司。
1.2 方法
1.2.1 差减文库的构建 两组凡纳滨对虾平均体质量分别为18.24 g和10.33 g,日龄为93 d。每组取10尾虾,每尾对虾取30 mg肌肉组织,组内混合后分别提取RNA。按照Invitrogen公司的Trizol使用说明书提取并纯化其总RNA。差减文库构建的具体操作依照clontech差减杂交试剂盒PCR-SelectTMcDNA Subtraction kit的方法进行。以较大一组对虾样品 (18.24 g)作为差减杂交的试验方(Tester),以较小一组的对虾样品 (10.33 g)作为驱动方 (Driver)。试验步骤简述如下:将RNA依次合成cDNA第1链与双链cDNA,纯化后经Rsa I酶切消化成平末端cDNA片段,将试验方连接接头后与驱动方进行两轮杂交,然后进行抑制性PCR,第二轮PCR采用的是套式PCR引物 (Nested primer 1 和Nested primer 2R)。SSH产物按qiagen pcr纯化试剂盒的方法纯化,产物经浓缩后溶于25 μL 10 mmol/L Tris·HCl中。采用T/A克隆方法,取纯化的PCR产物3 μL,按 Promega pGEM-T Easy Vector Systems的方法与载体pGEM-T连接,形成抑制差减杂交质粒文库。取1 μL连接物与40 μL感受态细胞DH10B混合,电转化后加入1 mL SOC培养液置于37℃培养箱中,慢速摇l h。取100 μL菌液涂于含50 μg/mL Amp的LB/X-gal/IPTG培养板上,37℃下培养14 h。统计培养板上的蓝白菌落数,计算滴度。挑取白斑克隆,点种于盛有LB液体培养基的384孔克隆板中,培养过夜,加入质量分数为25%甘油后于液氮中速冻,-80℃下保存。
1.2.2 斑点杂交与测序 从差减文库中挑选阳性克隆,经细菌培养和抽提质粒后,利用接头序列引物进行PCR扩增,将产物点膜,分别与标记的Tester和Driver cDNA作探针进行斑点杂交。42℃下先预杂交 1 h,然后杂交 18 h,洗膜,用CYCLONE扫描仪扫描图像,信号定量并分析试验结果。只与Tester cDNA有杂交信号而与 Driver cDNA无杂交的克隆,为含Tester组特异表达;与Tester cDNA杂交信号比与Driver cDNA杂交信号强的克隆,为上调表达的基因。挑选特异性表达和上调表达斑点克隆,经扩大培养,提取质粒进行DNA序列测定。测序工作由上海生工生物工程有限公司完成。
1.2.3 RNA的提取及cDNA的合成 分离6尾93日龄健康对虾的血液以及心脏、肝胰腺、肌肉、胃、肠、眼柄等器官或组织,混合相同组织提取总RNA,同时分别取10、45、80、125日龄健康对虾(各6尾)的肌肉组织,按Trizol(Invitrogen)试剂盒说明书的方法提取各器官或组织的总RNA。按照逆转录酶M-MLV的操作说明将RNA逆转录为cDNA,产物作为PCR扩增的模板。
1.2.4 Sec61γ基因的克隆及序列分析 在NCBI搜索Sec61基因同源序列,用CAP3程序进行序列拼接。根据拼接的序列设计引物F1、R1见表1。PCR扩增体系为:0.5 μmol/L引物各2 μL,模板cDNA 2 μL,PCRmix 10 μL,加水补足 20 μL。扩增参数为:95℃下变性30 s,53℃下退火30 s,72℃下延伸1 min,如此进行40个循环;最后在72℃下延伸10 min。PCR扩增产物经15 g/L琼脂糖凝胶检测、回收后,与pMD18-T载体连接,并转入大肠杆菌DH5α感受态细胞中。阳性克隆的PCR产物送生工生物工程 (上海)有限公司测序。
使用NCBI网站 (http:∥www.ncbi.nlm.nih.gov/blast)的Blastn和Blastx软件进行同源基因的搜索;使用Gene Runner 3.05软件进行开放阅读框的搜索和氨基酸序列的推断;使用Expasy工具包(http:∥www.expasy.ch/tools/pi_tool.html)进行PI和蛋白相对分子质量的预测;用 SignalP 3.0(http:∥www.cbs.dtu.dk/services/SignalP/)预测编码蛋白的信号肽,用Tmhmm软件 (http:∥www.cbs.dtu.dk/services/Tmhmm2.0)进行跨膜区预测。用Clustalx 2软件对氨基酸的多序列进行排列;使用Mega 4.1软件的邻接法构建NJ系统树(Neighbor-joining tree),设置1000 次bootstraps进行评估。
1.2.5 实时荧光定量PCR 实时荧光定量PCR是在ABI 7500 Fast Real-Time PCR仪上完成的。根据Sec61γ基因cDNA序列设计特异定量引物Sec1、Sec2,根据凡纳滨对虾内参序列设计Beta-actin特异引物Actin1、Actin2(表1)。20 μL的PCR反应体系中含有:2 μL cDNA,9 μL SYBR Green Master mix,5 μL RNAase-free H2O,上游和下游引物(0.5 μmol/L)各 2 μL。扩增参数为:95 ℃下预变性30 s;95℃下变性5 s,55℃下退火34 s,共进行40个循环。同一样品的内参和目的基因在同一板中进行,每个样品做3个重复。实时定量RTPCR反应及信息的收集都在ABI 7500 Fast Real-Time PCR 仪中进行。采用 2–ΔΔCt法计算 Sec61γ 基因mRNA的相对表达量,不同组织中的表达分析设定肌肉组织Sec61γ基因mRNA的表达量为1,不同时期表达分析设定10日龄Sec61γ基因mRNA的表达量为1。
2 结果与分析
2.1 cDNA文库的构建与质量检测
本试验中成功构建了生长性状差减文库,共获得1152个克隆。随机挑选24个单克隆,以载体特异的M13正向引物和M13反向引物进行PCR扩增,大小分布在300~1000 bp,平均插入片断大小为600 bp左右。
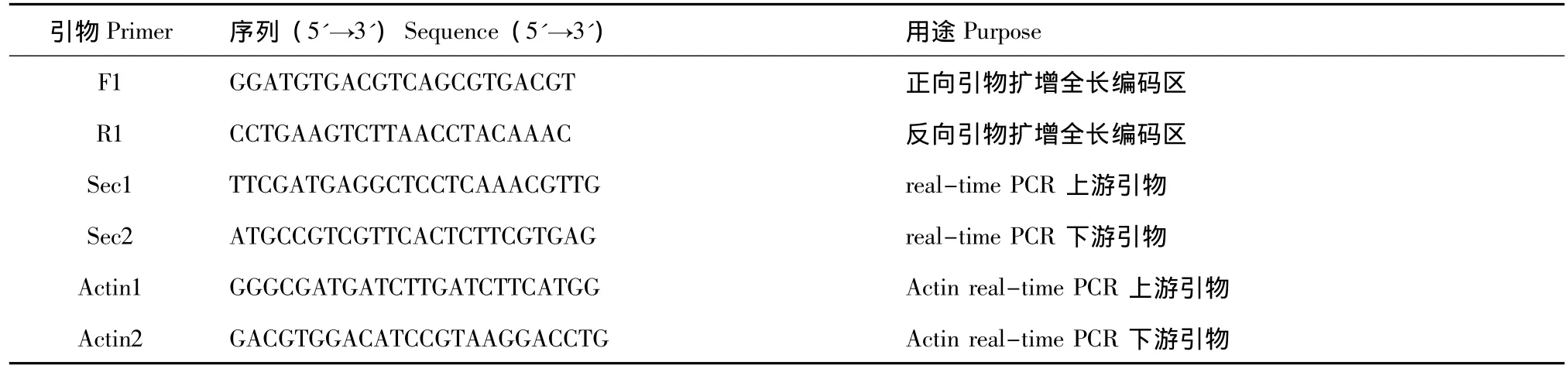
表1 本试验中所用引物的序列Tab.1 Primer sequences used in the study
2.2 斑点杂交
将抑制消减文库PCR中鉴定为单一条带的产物点于尼龙膜上,共获得768个基因片段的点阵膜,经变性、中和及固定后与标记的探针进行杂交。将杂交后的信号曝光在X-ray film上 (图1),挑选较大对虾和较小对虾杂交信号差异显著的克隆进行测序,从中选取一个420 bp的差异基因片段。

图1 cDNA点阵膜杂交的结果Fig.1 The results of cDNA bitmap membrane hybrid
2.3 目的基因cDNA序列的特征
经过同源序列搜索、序列拼接并设计引物,经克隆得到的Sec61γ基因cDNA序列长为500 bp,包含270 bp的开放阅读框 (ORF),含1个ATG启动子和1个TGA终止子。在编码89个氨基酸中,带正电的氨基酸 (Arg和Lys)有15个,带负电的氨基酸 (Asp和Glu)有6个。理论等电点I为10.58,预测的相对分子质量大小为10300。编码的氨基酸序列经Expasy推测在14~42氨基酸处存在1个Sec61γ标签。经Tmhmm预测Sec61γ在39~61氨基酸处有1个跨膜螺旋 (图2),用SignalP 3.0软件预测无信号肽。
2.4 氨基酸序列比对及系统进化分析
Blastp搜索结果表明,凡纳滨对虾Sec61γ基因的编码氨基酸序列与其它物种的同源性较高,但较稳定。与有爪蟾蜍Xenopus laevis和穴居狼蛛lycosa singoriensis的相似性为84%;与小家鼠Mus musculus、文昌鱼 Branchiostoma floridae、智人 Homo sapiens和玻璃海鞘Ciona intestinalis的相似性均为83%;与囊舌虫Saccoglossus kowalevskii的相似性为77%(图3)。所有分析物种与凡纳滨对虾Sec61γ基因跨膜螺旋区域 (39~61氨基酸)的序列一致。
运用Mega 4.1软件构建凡纳滨对虾Sec61γ基因和GenBank中12个物种Sec61基因氨基酸序列系统进化树 (图4),Sec61γ基因氨基酸序列严格按照种属关系聚成两大支,分别是植物组和动物组。另外,凡纳滨对虾所在的甲壳纲在进化上与蛛形纲和肠鳃纲较近,而与昆虫纲和脊椎动物亚门较远。
使用Mega 4.1软件的邻接法构建NJ系统树,并用bootstraps进行了1000次评估。系统树绘制所用基因的 GenBank登录号如下:ACG76276.1 Amblyommaamericanum(美洲钝眼蜱),XP_002415993.1 Ixodes scapu(肩硬蜱),ABX75489.1 Lycosa singoriensis(穴居狼蛛),XP_002592130.1 Branchiostoma floridae(文昌鱼),XP_002734928.1 Saccoglossus kowalevskii(囊舌虫),XP_002426966.1 Pediculus humanus corporis(体虱),NP_055117.1 Ho mosapiens(智人),XP_003084563.1Musmusculus(小家鼠),NP_001165129.1 Xenopus laevis(有爪蟾蜍),NP_001027676.1 Ciona intestinalis(玻璃海鞘),ADD20301.1 Glossina morsitans(刺舌蝇),ABK21891.1 Picea sitchensis(北 美 云 杉),ADB02901.1 Jatropha curcas(麻疯树),XP_002270423.1 Vitis vinifera(葡萄)。

图2 Sec61γ基因cDNA的核甘酸序列及其推导的氨基酸序列Fig.2 The cDNA nucleotide sequence and deduced amino acid sequence of Sec61γ gene

图3 凡纳滨对虾的Sec61γ基因和其它物种Sec61基因的氨基酸序列比对Fig.3 Comparison of Sec61γ gene amino acid sequences in the Pacific white leg shrimp with other species.
2.5 Sec61γ基因的组织表达分布及在不同生长期肌肉中的表达
用实时荧光定量PCR方法检测凡纳滨对虾Sec61γ基因在不同组织中的表达情况,结果如图5所示。从图5可见:Sec61γ基因在所检测的组织中都有表达,其中在肌肉中的表达量最高,其次是胃、肝胰腺、心脏、眼柄以及血,最低的是肠。Sec61γ基因在对虾不同生长时期肌肉中的相对表达量各不相同,在45日龄对虾肌肉中的表达量最低,在10日龄对虾肌肉中的表达量最高,为45日龄的27.6倍。
3 讨论
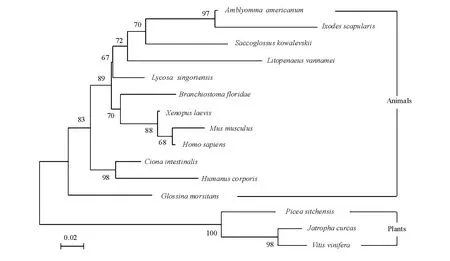
图4 构建的Sec61γ基因氨基酸序列的系统进化树Fig.4 Phylogenetic tree of Sec61γ gene amino acid sequences
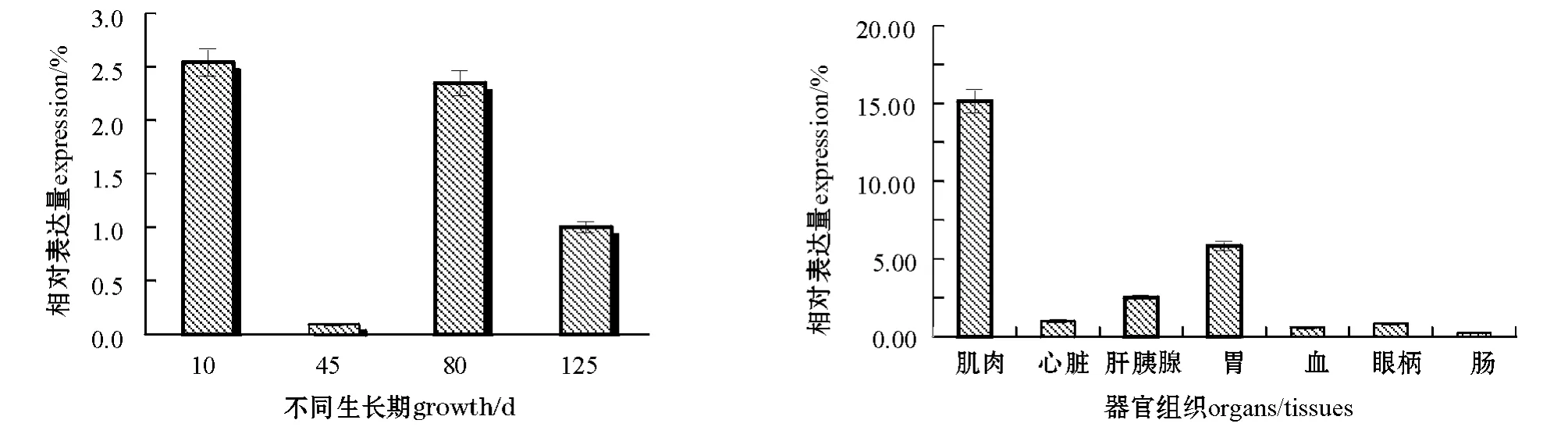
图5 Sec61γ基因在对虾不同生长期的肌肉中以及在不同组织中的相对表达量Fig.5 Expression of Sec61γ gene in the muscles of different organs/tissues during different growth periods
生物细胞中大多数蛋白 (包括许多细胞器蛋白)常常通过内质网 (ER)进行运输。内质网蛋白质转运通道Sec61复合体具有3种蛋白亚基——Sec61α、Sec61β和Sec6γ,其中Sec61α具有10个跨膜区,而 Sec61β和 Sec61γ仅有一个跨膜区[9-10]。本研究中涉及的 Sec61γ基因也是一个跨膜蛋白 (图2),跨膜螺旋区域位于39~61氨基酸处。与其它物种的氨基酸序列进行比对,结果表明:凡纳滨对虾Sec61γ基因与有爪蟾蜍和穴居狼蛛的相似性为84%,与小家鼠、文昌鱼、智人和玻璃海鞘的相似性均为83%,与囊舌虫的相似性为77%,与所比对的7种物种在凡纳滨对虾Sec61γ基因的跨膜螺旋区域处的氨基酸序列完全一致 (图3)。这表明该氨基酸的跨膜区域是高度保守的,推测Sec61γ的跨膜区域对于其功能的发挥具有重要的作用。由构建的NJ进化树体系可知(图4),其由两个主要分支组成,动物和植物分别聚为一簇,同属一纲的物种也相应聚成一个分枝,准确地体现了物种的进化关系。进化树还显示,凡纳滨对虾所属的甲壳纲在进化上同蛛形纲和肠鳃纲较近,而与昆虫纲和脊椎动物亚门较远,这为我们进一步研究节肢动物门中多个纲的进化关系及起源提供了参考资料。
本研究中涉及的Sec61γ基因通过实时荧光定量PCR方法检测到其在血液以及心脏、肝胰腺、肌肉、胃、肠、眼柄等器官或组织中都有表达,且在肌肉中表达量最高。凡纳滨对虾的出肉率高达53.03% ~53.81%[11],因此对虾的生长主要体现在肌肉的生长。生长快的对虾,其肌肉的生长也相应较快,同时需要大量蛋白质和必需氨基酸,而Sec61γ蛋白的大量表达则可能促进肌肉细胞蛋白质的合成以及增加物质运输。另外,Sec61通道是内质网膜上的一个双向转运蛋白的通道[12],在形成一个疏水通道让新生多肽通过的同时,也可能促进肌肉代谢中产生的蛋白质降解产物的快速运输,从而保证肌肉细胞代谢活动的正常运行。本研究结果表明,Sec61γ基因在对虾不同生长期肌肉中的表达量各不相同,其中在10日龄对虾肌肉中表达量最高,45日龄时表达量最低,80日龄时表达量又大幅上升,125日龄时表达量又回落,结果有待在不同家系的对虾中进一步验证。下一步将对Sec61复合体其它蛋白亚基——Sec61α、Sec61β的表达模式进行研究,这将有助于人们更深入地探讨Sec61基因的功能。
[1]Cannon K S,Or E,Clemons W M Jr,et al.Disulfide bridge formation between Sec61γ and a translocating polypeptide localizes the translocation pore to the center of Secγ[J].Cell Biol,2005,169(2):219-225.
[2]Beckmann R,Bubeck D,Grassucci R,et al.Alignment of conduits for the nascent polypeptide chain in the ribosome Sec61 complex[J].Science,1997,278(5346):2123-2126.
[3]Cheng Z,Jiang Y,Mandon E C,et al.Identification of cytoplasmic residues of Sec61pinvolved in ribosome binding and cotranslational translocation[J].Cell Biol,2005,168:67-77.
[4]Rapoport T A,Rolls M M,Jungnickel B.Approaching the mechanism of protein transport across the ER membrane[J].Curr Opin Cell Biol,1996,8(4):499-504.
[5]Heinrch S U,Mothes W,Brunner J,et al.The Sec61p complex mediates the integration of a membrane protein by allowing lipid partitioning of the transmembrane domain[J].Cell,2000,102:233 -244.
[6]Or E,Boyd D,Gon S,et al.The bacterial ATPase SecA functions as a monomer in protein translocation[J].Biol Chem,2005,280:9097-9105.
[7]Valcarcel R,Weber U,Jackson D B,et al.Sec61 beta,a subunit of the protein translocation channel,is required during Drosophila development[J].Cell Sci,1999,112:4389-4396.
[8]Meyer H A,Grau H,Kraft R,et al.Mammalian Sec61 is associated with Sec62 and Sec63[J].Biol Chem,2000,275:14550-14557.
[9]DIatchenko L,Lau Y F,Campbell A P,et al.Suppression subtractive hybridization:a method for generating differentially regulated of tissue-specific cDNA probes and libraries[J].Proc Natl Acad Sci USA,1996,93:6025-6030.
[10]Wickner W,Schekman R.Protein translocation across biological membranes[J].Science,2005,310:1452-1456.
[11]Becker T,Bhusshan S,Jarasch A,et al.Structure of monomeric yeast and mammalian Sec61 complexes interacting with the translating ribosome[J].Science,2009,326:1369-1373.
[12]陈晓汉,陈琴,谢达祥.南美白对虾含肉率及肌肉营养价值的评定[J].水产科技情报,2001(4):165-168.

