Slit2/Robo1信号对鸡胚早期神经管及体节发育的影响*
王 广, 王晓钰, 李 艳, 王丽京, 雷 健, 张笑坛, 耿建国, 杨雪松△
(1暨南大学香港大学脑功能与健康联合实验室,暨南大学医学院组织与胚胎学系,广东广州510632;2广东药学院血管生物学实验室,广东广州510224)
在胚胎发育的原肠胚后期,神经褶(neural fold)的两侧相互靠拢,形成一个管道,称之为神经管(neural tube),神经管逐渐发育为脊椎动物的中枢神经系统(CNS),因此神经管是神经系统正常形成的基础。体节是位于脊索和神经管两侧分节排列的中胚层组织团块组织,是一种发育过程中的暂时性结构,是骨骼、肌肉、皮肤和尿殖器官(泌尿、生殖器官)的发生来源。神经管上基因表达与体节发育是紧密相关的,例如神经管表达的Wnt1能够促进noggin基因的表达,noggin基因不仅对体节发育有重要作用,还是形成神经管背侧细胞的BMP(bone morphogenetic protein)基因的拮抗基因[1]。
Slit/Robo(roundabout)信号最早报道是在果蝇体内具有神经轴突导向作用[2]。Slit是一类富含亮氨酸重复序列(LRRs)及多个EGF样重复序列组成的分泌性蛋白,主要在神经系统中表达。Slit受体Robo蛋白家族在鸡胚早期神经管的表达已有报道,研究表明体节期Robo2能够表达在脊索、神经管、体节和血岛部位[3],而Robo4明确的表达在血管内皮,因此Slit家族及其受体Robo家族的表达还是有一定差异性的。在胚胎发育早期,神经管与体节之间有一群神经嵴细胞,随着胚胎的发育将会迁移至体节,已有文献报道Slit2和Robo1都能在神经嵴细胞中表达,对于神经嵴细胞腹侧的迁移途径有一定抑制作用[4]。由于神经管发育对神经嵴细胞迁移及体节发育都有重要影响,因此我们选取神经管尚未完全闭合和体节刚刚开始分化的HH10[5]鸡胚发育时期,采用在活体胚胎细胞电穿孔的方法转染基因在胚胎神经管的单侧,另一侧为正常对照侧,探讨Slit2/Robo1信号对神经管及体节发育的影响。
材料和方法
1 材料
胚蛋(华南农业大学新鲜正大肉鸡发展中心);Robo1-shRNA-GFP和pEGFP-N1(耿建国实验室提供);Slug(Kees Weijer实验室提供);anti-GFP(Novus);anti-rabbit Alexa Fluor 488(Invtrogen);anti- mouse Alexa Fluor IgM555(Invtrogen);anti-HNK-1(Sigma);DIG RNA labeling kit(Roche);anti-digoxigenin-AP Fab fragments(Roche);DH5α大肠杆菌感受态(TaKaRa);质粒快速提取试剂盒(北京天根生化科技有限公司);DNA回收纯化试剂盒(北京天根生化科技有限公司);明胶(北京奇华盛生物技术有限公司);Milli-Q Integral水纯化系统(Millipore);ECM309 Electroporation System(BTX);MVX10体视荧光倒置显微镜(Olympus);数显电热恒温培养箱(上海博迅实业有限公司医疗设备厂);CM1900型冷冻切片机(Leica)。
2 方法
2.1 蛋内转染 37℃温箱孵育36 h后,HH10胚蛋横放,70%乙醇擦拭蛋壳消毒,在气室对侧用注射器抽出4 mL蛋清,透明胶带封口。在胚蛋侧面剪刀剪开1个小窗,体式显微镜下将质粒注射入神经管腔内,此时神经管尚未完全闭合,见图1。转染完毕后洁净透明胶带封口,37℃温箱孵育10 h,取出鸡胚[6],4%多聚甲醛固定4℃过夜。实验重复3次。

Figure 1.The methods of in ovo electroporation at HH10 in chick embryo.A:an egg was windowed on the lateral at HH10.B:plasmid DNA was injected into the lumen of the neural tube from dorsal side of chick embryo using microinjection.The electrodes were laid aside parallel with embryonic craniocaudal axis.C,D:carmine staining,D is the section of neural tube at the dotted line-indicated site of the whole embryo.图1 鸡胚HH10期蛋内电穿孔转染方法
2.2 原位杂交 4%多聚甲醛固定的胚胎梯度浓度过甲醇/PTW后,100%甲醇洗2次,随后梯度洗入PTW。65℃预杂交1 h,80℃预热5 min的探针65℃孵育过夜,含有2%Boehringer和20%灭活羊血清的TBST封闭液室温封闭2 h,1∶1 000 anti-DIG 4℃摇床过夜,碱性磷酸酶显色。
2.3 免疫荧光 原位杂交后的胚胎PTW洗3次,含有10%灭活羊血清的PBT室温封闭2 h,Ⅰ抗(anti-GFP:1∶1 000;anti-HNK -1:1∶500)4 ℃摇床过夜,1∶1 000荧光Ⅱ抗显色(anti-rabbit Alexa Fluor 488,anti-mouse Alexa Fluor IgM555)。
2.4 冰冻切片 胚胎采用明胶 -蔗糖包埋[7],切片厚度20 μm。
结 果
1 Robo1-shRNA-GFP能够下调神经管Robo1的表达
Robo1在鸡胚早期神经管、体节、脊索等处都有表达。pEGFP-N1正常对照组神经管转染侧与对照侧Robo1的表达无差异,见图2A-C;Robo1-shRNA-GFP组转染侧的Robo1表达较对照侧有降低效果,见图2D-F,提示实验中使用在体转染Robo1-shRNA-GFP的方法能够使神经管Robo1的表达降低,干扰Slit2/Robo1信号通路。
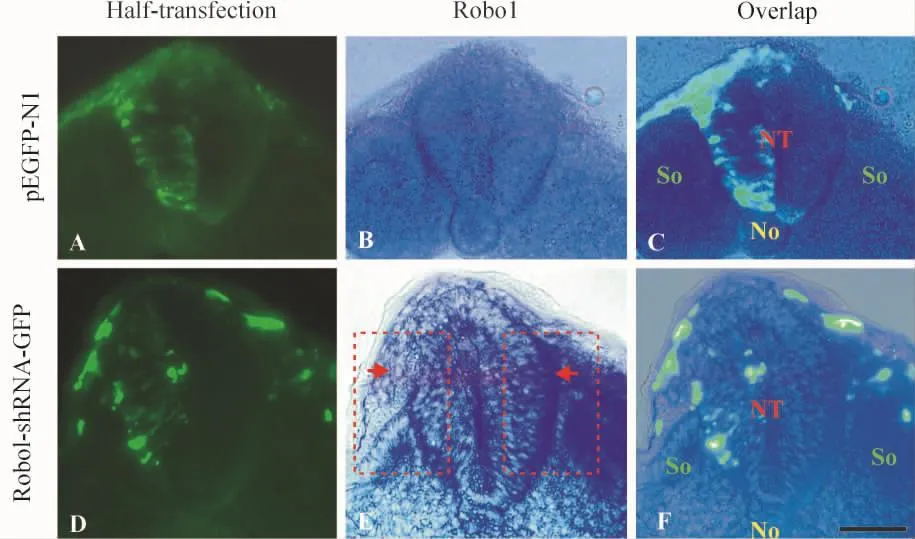
Figure 2.Down-regulation of Robo1 expression in neural tube of chick embryo using Robo1-shRNA -GFP.A,C and D,F:pEGFP-N1 and Robo1-shRNA -GFP were transfected in left side of neural tube,respectively.B,C,E,F:the expression of Robo1 in chick embryos were checked using RNA -RNA in situ hybridization.B,C:the expression of Robo1 between the electroporation side and control side of neural tube was similar in pEGFP-N1 control group.E,F:Robo1-shRNA-GFP down-regulated the expression of Robo1 in neural tube as indicated by red arrows.Scale bar=50 μm.NT:neural tube;So:somite;No:notochord.图2 Robo1-shRNA-GFP下调鸡胚早期神经管Robo1的表达
2 下调Robo1在神经管的表达导致神经管发育异常
在胚胎HH10时期,神经管尚未完全闭合(图1D)。转染pEGFP-N1后,神经管发育正常(图3A-C),而Robo1-shRNA-GFP组胚胎的神经管发育异常(图3D-F),以脊索至神经管闭合处为中线位置,转染侧神经管较正常侧短小(图3F)。

Figure 3.Blocking Slit2/Robo1 signaling via down-regulation of Robo1 resulted in abnormal fusion of neural tube and expression of Slug.A -C:transfection of GFP had no effect on the fusion of neural tube(labeled by dotted lines in C)and expression of Slug(indicated by red arrows in B).D-F:both fusion of neural tube(labeled by dotted lines in F)and expression of Slug pattern(indicated by a green arrow in E)were impeded by down - regulated Robo1 expression.Scale bar=20 μm.NT:neural tube;No:notochord.图3 鸡胚早期下调Robo1对神经管闭合与Slug表达的影响
已有文献报道,Slug的表达受到抑制,神经管的闭合也会受到抑制[8],于是我们进一步检测Sliy的表达。图3显示,pEGFP-N1组Slug表达正常,而Robo1-shRNA-GFP组转染侧神经管闭合处的Slug未像pEGFP-N1组一样对称表达,该时期转染侧神经管已经不表达Slug了。
3 下调Robo1后神经嵴细胞迁移异常导致体节提前分化
HNK-1能够用于标记正在迁移的神经嵴细胞,在大鼠的胚胎发育中还可以用来标记生骨节和生肌节来源的细胞亚群[9]。因为神经嵴细胞能够迁移至体节,神经嵴细胞的迁移路线与体节的发育也有着密切关系[10]。从图4看出正常对照组(pEGFPN1)神经嵴细胞迁移正常,在胚胎的近尾端体节处双侧的神经嵴细胞同时迁出较少(图4C);而Robo1-shRNA-GFP组神经管的闭合、Slug的表达以及神经嵴细胞迁移都受到了影响,Robo1下调侧的神经嵴细胞较对照侧迁出明显增多(图4G),进入体节的生皮肌节。由于神经嵴细胞的提前迁移,促进了体节的发育。

Figure 4.The migration of neural crest cells to somites was enhanced after down-regulation of Robo1 in neural tube.B:Slug expression was similar between transfection side and control side in pEGFP-N1 control group.C,D:the migration of neural crest cells to somites was similar between transfection side and control side in pEGFP-N1 control group(red arrows).F:both fusion of neural tube and expression of Slug pattern were impeded by down-regulated Robo1 expression.G,H:the neural crest cells on the transfection side migrated to somites earlier than those on the control side in Robo1-shRNA-GFP group(green arrows).Scale bar=20 μm.图4 下调Robo1表达增加神经嵴细胞迁移至体节
讨 论
Slit蛋白及其受体Robo蛋白在进化上都属于比较保守的家族,在哺乳动物中至少含有3个Slit基因(Slit1,Slit2,Slit3)和4个Robo基因(Robo1,Robo2,Robo3,Robo4),Slit2及其受体Robo1在神经管以及以后的整个中枢神经系统都有表达[11,12],在胚胎发育过程中由于神经管不闭合而导致的畸形我们称之为神经管缺陷(neural tube defects,NTDs),全球新生儿发病率高达 1/1 000-1/100[13],常见的 NTDs包括无脑畸形、脑膨出、露脑、颅脊柱裂、脂肪瘤型脊髓脊膜膨出、脑膜膨出、脊髓脊膜突出等[14]。本实验选取HH10期胚胎为实验模型,神经管尚未完全闭合,在实验中干扰了半侧神经管Robo1的表达后,下调Robo1侧的神经管较正常侧发育得短小,并且Slug的表达也受到了明显干扰,提示Slit2/Robo1能够影响Slug的表达,进而在胚胎发育早期影响神经管的闭合。
神经嵴细胞的正常产生和迁移对多种组织的发育具有重要意义。常见的神经嵴细胞迁移异常而导致的疾病包括Waardenburg综合症和DiGeorge综合症等[15,16]。由于迁移的神经嵴细胞将会分布到机体的各个部位,从最早发生的器官心脏到神经系统、腺体、骨骼、牙齿、眼睛等,有些学者甚至提出神经嵴细胞是第四胚层的建议[17]。在鸡胚发育过程中,神经嵴细胞的迁移大体有背侧和腹侧2条路线[18]。Slug作为转录因子能够通过促进上皮-间质转化过程产生神经嵴细胞[19]。本实验发现下调Robo1侧的神经嵴细胞提前迁向了体节的生皮肌节,而且Slug的表达也发生了异常,提示Slit2/Robo1对神经嵴细胞的产生或者迁移方向有影响作用,可能是通过Slug基因的表达来进行调节的。
体节是脊椎动物胚胎发育过程中一个暂时性结构,是脊椎动物发育分节结构的基础[20],随着胚胎的发育继续形成生骨节和生皮肌节。至少2种人类疾病-脊椎肋骨发育不全和Alagille综合症是与体节发育异常相关的[21]。Robo1在鸡胚发育至2.5 d时也会表达在体节生皮肌节[4];神经管、脊索、外胚层和神经嵴细胞都会影响体节生皮肌节的形成和分化[22]。本实验发现,神经嵴细胞的异常迁移导致了体节的提前分化,提示Slit2/Robo1在体节分化中有重要作用。尚不清楚的是这种作用是直接的还是间接的,机制如何,有待进一步探讨。
[1]Bellairs R,Osmond M.The atlas of chick development[M].2nd ed.London:Elsevier Academic Press,2005.30-34.
[2]Dickson BJ,Gilestro GF.Regulation of commissural axon pathfinding by Slit and its Robo receptors[J].Annu Rev Cell Dev Biol,2006,22:651 -675.
[3]林艳青,亓翠玲,吴 婷,等.用RNA-RNA原位杂交技术研究Robo2在早期鸡胚发育中的表达[J].中国病理生理杂志,2010,26(12):2368-2372.
[4]Jia L,Cheng L,Raper J.Slit/Robo signaling is necessary to confine early neural crest cells to the ventral migratory pathway in the trunk[J].Dev Biol,2005,282(2):411-421.
[5]Hamburger V,Hamilton HL.A series of normal stages in the development of the chick embryo[J].Dev Dyn,1992,195(4):231-272.
[6]Chapman SC,Collignon J,Schoenwolf GC,et al.Improved method for chick whole-embryo culture using a filter paper carrier[J].Dev Dyn,2001,220(3):284 -289.
[7]马征来,吴 婷,李 艳,等.冰冻切片制作方法的改良[J].解剖学研究,2009,31(5):385-387.
[8]Stegmann K,Ziegler A,Ngo ET,et al.Linkage disequilibrium of MTHFR genotypes 677C/T-1298A/C in the German population and association studies in probands with neural tube defects(NTD)[J].Am J Med Genet,1999,87(1):23-29.
[9]Bannerman PG,Oliver TM,Nichols WL Jr,et al.The spatial and temporal expression of HNK-1 by myogenic and skeletogenic cells in the embryonic rat[J].Cell Tissue Res,1998,294(2):289 -295.
[10]Gammill LS,Roffers-Agarwal J.Division of labor during trunk neural crest development[J].Dev Biol,2010,344(2):555-565.
[11]Ypsilanti AR,Zagar Y,Chedotal A.Moving away from the midline:new developments for Slit and Robo[J].Development,2010,137(12):1939 -1952.
[12]Kuriyama S,Mayor R.Molecular analysis of neural crest migration[J].Philos Trans R Soc Lond B Biol Sci,2008,363(1495):1349-1362.
[13]Au KS,Ashley-Koch A,Northrup H.Epidemiologic and genetic aspects of spina bifida and other neural tube defects[J].Dev Disabil Res Rev,2010,16(1):6 -15.
[14]Dhaulakhandi DB,Rohilla S,Rattan KN.Neural tube defects:review of experimental evidence on stem cell therapy and newer treatment options[J].Fetal Diagn T-her,2010,28(2):72 -78.
[15]Ghosh SK,Bandyopadhyay D,Ghosh A,et al.Waardenburg syndrome:a report of three cases[J].Indian J Dermatol Venereol Leprol,2010,76(5):550 -552.
[16]Kinoshita H,Kokudo T,Ide T,et al.A patient with Di-George syndrome with spina bifida and sacral myelomeningocele,who developed both hypocalcemia-induced seizure and epilepsy[J].Seizure,2010,19(5):303 - 305.
[17]Hall BK.The neural crest and neural crest cells:discovery and significance for theories of embryonic organization[J].J Biosci,2008,33(5):781 -793.
[18]Erickson CA,Reedy MV.Neural crest development:the interplay between morphogenesis and cell differentiation[J].Curr Top Dev Biol,1998,40:177 -209.
[19]del Barrio MG,Nieto MA.Overexpression of Snail family members highlights their ability to promote chick neural crest formation[J].Development,2002,129(7):1583-1593.
[20]Palmeirim I,Rodrigues S,Dale JK,et al.Development on time[J].Adv Exp Med Biol,2008,641:62 - 71.
[21]Shifley ET,Cole SE.The vertebrate segmentation clock and its role in skeletal birth defects[J].Birth Defects Res C Embryo Today,2007,81(2):121-133.
[22]Spence MS,Yip J,Erickson CA.The dorsal neural tube organizes the dermamyotome and induces axial myocytes in the avian embryo[J].Development,1996,122(1):231-241.

