溶剂热法制备纳米MnOOH
陈 琳,田 俐,李 帅,朱金良,吕数子
(1.湖南科技大学学生工作处,湖南湘潭 411201; 2.湖南科技大学材料科学与工程系,湖南湘潭 411201)
溶剂热法制备纳米MnOOH
陈 琳1,田 俐2*,李 帅2,朱金良2,吕数子2
(1.湖南科技大学学生工作处,湖南湘潭 411201; 2.湖南科技大学材料科学与工程系,湖南湘潭 411201)
MnOOH在常温常压下为黑色固体粉末,经氧化或还原可制成电子工业中生产锰锌铁氧体软磁材料的重要原料.以 KMnO4与MnSO4为原料,在水与正丙醇混合溶剂中反应制备了MnOOH纳米棒;采用 X射线粉末衍射仪(XRD)、差热-热重(DTA-TG)分析系统、红外光谱仪(IR),以及扫描电镜(SEM)、透射电镜(TEM)、X射线能谱仪(EDS)等分析了产物的物相、结构、形貌及组成;并研究了反应温度、水热时间及溶剂对纳米级MnOOH组成以及形貌和结构的影响.结果表明:采用溶剂热法,在140~220℃,6~12 h条件下可得到长达数微米、直径约为50 nm的MnOOH纳米棒;在MnOOH形成过程中,正丙醇起着至关重要的作用.
溶剂热法;纳米MnOOH;制备
Abstract:Black powder MnOOH can be oxidized or reduced to generate raw materials for producing zinc manganese iron oxide magnetic ferrite materials in electronics industry.KMnO4and MnSO4were used as raw materials to synthesize MnOOH nanorods in mixed solvent of water and propanol.The phase,structure,morphology and composition of the products were analyzed by means of X-ray diffraction,differential thermal analysis,infrared spectrometry,scanning electron microscopy,transmission electron microscopy,and energy dispersive spectrometry.The influence of experiment conditions,including reaction temperature,time and solvent,on the phase and shape of nanosized MnOOH were studied.Results show that as-prepared MnOOH nanorods with a length of several microns and diameter of 50 nm could be obtainedvia solvothermal route at a temperatures of 140-220℃and time of 6-12 h.Propanol played a significant role in the formation of nano-sized MnOOH.
Keywords:solvothermal method;nanosized MnOOH;preparation
碱式氧化锰(MnOOH)是一种非常重要的固体物质,它在软磁材料、电化学材料、电致变色材料、催化材料、离子交换材料等方面都有着非常广泛的应用,因而一直吸引着科研工作者的眼球[1-4].尤其是近来的研究表明一维材料在光、电、磁、催化等领域表现出来的独特性质和应用前景,使得一维碱式氧化锰的制备研究倍受广大研究者的关注[5-7].
目前,有关MnOOH一维材料的制备方法有溶胶-凝胶法、弱磁场下低温中和法、模板法、反相胶束法、水热-电化学法、臭氧氧化法等多种,而最主要的合成方法为水热法[8-18],如糜裕宏等以KMnO4为原料,以聚乙二醇为还原剂,制备了多枝状的γ-MnOOH[12];唐幸福等通过加入十六烷基三甲基溴化铵表面活性剂制备了四方柱γ-MnOOH纳米棒[13];乔涛等以 KMnO4为原料,以甲苯为还原剂,制备了γ-MnOOH纳米线[18];杨保俊等通过在水热体系中自牺牲MnO2模板制备了MnOOH纳米管[19]等.
本文作者选用 KMnO4与MnSO4为原料,以水与正丙醇为溶剂,在不加表面活性剂,且无模板参与的条件下,采用低温溶剂热法制备了MnOOH纳米棒,并对其反应温度、反应时间、溶剂等合成条件进行了初步探索.
1 实验部分
1.1 试剂与仪器
KMnO4(北京化学试剂公司)、MnSO4(北京化学试剂公司)和正丙醇(广州化学试剂公司)均为分析纯试剂,实验所用去离子水自制.
日本 RIGA KU D/Max 2200 VPC型粉末X射线衍射仪,Cu-Kα射线,γ=0.154 056 nm,管电流30 mA,管电压 40 kV,步进扫描 ,步长0.020 °,扫描速率 10 °·min-1,扫描范围10°~70°;荷兰菲利浦 FEI公司Quanta 400热场发射电镜扫描仪,加速电压40 kV;附有Link ISIS-300X牛津电子能谱分析系统的日本电子株式会社J EM-2010型高分辩透射电镜扫描仪,加速电压为200 kV;北京光学仪器厂生产的WCT-1D型差热-热重分析仪,空气氛围,测量范围为20~800℃,升温速率为10℃/min;美国PE公司生产的Spectrum one型傅立叶红外分析仪,KBr压片,波数范围为4 000~450 cm-1.
1.2 实验过程
分别称取0.5 g KMnO4(3.2 mmol)和0.2 g MnSO4(1.3 mmol)于小烧杯中,再加入10 mL体积比为1∶1的去离子水和正丙醇溶剂,混合后用恒温磁力搅拌器搅拌溶解.将所得混合液移入20 mL聚四氟乙烯内衬的不锈钢反应釜后置于烘箱中,在设定温度下水热反应一段时间.取出反应釜后,自然冷却,生成的浆液用去离子水和乙醇交替洗涤多次,抽滤,所得产品在80℃烘干备用.实验中固定 KMnO4和MnSO4的用量,以反应时间(6 h、12 h、24 h)、反应温度(140 ℃、180℃、220℃)为主要变化因素进行水热实验,探讨反应温度和水热时间等反应参数对纳米MnOOH合成的影响.以纯水为溶剂,进行上述实验探讨溶剂对产物的影响.
2 结果与讨论
2.1 反应参数对MnOOH合成的影响
反应温度和反应时间是晶体生长热力学与动力学上的两大重要影响因素.为确定产品的物相以及考察反应温度和水热时间对产物形貌的影响,对140℃,180℃,220℃温度下反应6~24 h所得样品进行物相分析和形貌观察,其XRD分析结果如图1所示.
由图1可知,在这三个温度下反应6 h所得产品的所有衍射峰均与单斜晶系的MnOOH的标准衍射峰相匹配(PDF#41-1379),其晶胞常数为 a=0.530 0 nm,b=0.527 8 nm 和 c=0.530 7 nm,β =114.36°,空间群为 P21/c(14).这说明在140℃,180℃,220℃温度下反应6 h均可以得到水锰矿型结构MnOOH;且随着反应温度的升高,产物的衍射峰由最初的毛糙(图1A)变得平滑和尖锐(图1C和图1E),峰的强度增大,产物具有更好的结晶度.将反应时间延长到24 h,在140℃和180℃温度下所得到的产物仍然为MnOOH(图1B和图1D),相对于同温度下的产品,其衍射峰有所增强,峰形变尖,这说明反应时间的延长有利于产物结晶度的提高.而在220℃的反应温度下,当反应时间延长到24 h,产物的衍射峰基本上与四方晶系Mn3O4的标准特征衍射峰(PDF#24-0734)相一致,其空间群为141/amd(141),晶胞参数为a=0.576 2 nm,c=0.947 0 nm,这意味着此时体系中生成的产物为纯相的Mn3O4,如图1F所示.
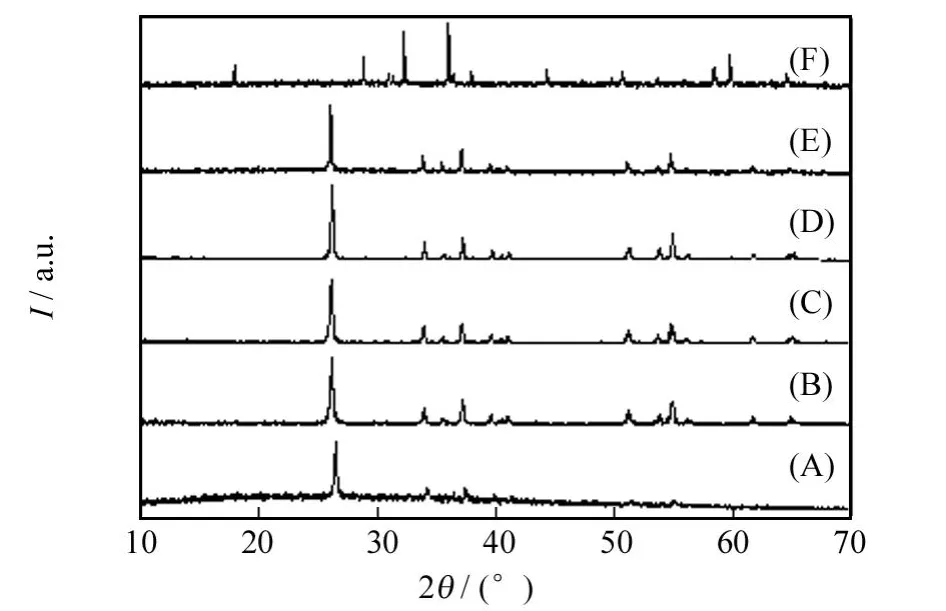
图1 不同温度反应不同时间所得产品的XRD谱图Fig.1 XRD patterns of the products synthesized at different temperature for various time
图2给出了140℃,180℃,220℃温度下反应6~24 h所合成样品的扫描电镜照片.由图2A~C可以看出,在这三个温度下反应6 h,所得产物均为MnOOH纳米棒,在温度较低时(图2a),MnOOH纳米棒的轮廓不清晰;随着反应温度的升高,纳米棒的形状变得明显(图2B),形貌统一,产品的结晶度提高;当温度升高到220℃时,MnOOH纳米棒变粗,棒的直径约为200~500 nm,棒的长度也有所增加,但长度不同,约4~6 μm(图2C),这可能是由于温度高的反应中反应粒子的活性较高且产物粒子的扩散较快而使反应程度增大所造成的结果.在相同温度(140℃或180℃)下,当反应时间延长至24 h,MnOOH纳米棒长粗、长长,同时,也变得粗细不均、长短不一(图2D和图2E).而当温度为220℃反应24 h后所得到的产物由MnOOH纳米棒转化为Mn3O4纳米短棒,其直径约为0.5~1μm,长度约为3~6μm(图2F).
溶剂也是控制反应过程和最终产物的主要因素.在相同的实验条件下,将反应溶剂改用纯去离子水而不加有机溶剂正丙醇,在140℃温度下水热反应6~12 h得到的产物为层状δ-MnO2和锰盐羟基化合物MnOOH和Mn(OH)4的混合物,其他情况下都得不到MnOOH,而只是得到四方相α-MnO2,图3给出了部分产品的XRD分析结果.在体积比为1∶1的去离子水和正丙醇体系中,MnOOH的生成可能与正丙醇溶剂的还原性有关.在中性环境且体系中MnO-4过量的情况下,反应系统中的MnO-4与Mn2+发生相互作用,一般可直接得到产物MnO2,而在本实验的溶剂热反应体系中,由于Mn2+是过量的,同时,由于还原性溶剂正丙醇的存在,使得体系中MnO-4与Mn2+发生化学反应生成锰氧化态较低一些的碱式氧化锰MnOOH.

图2 不同反应条件下所得产品的SEM照片Fig.2 SEM images of the products synthesized at different conditions
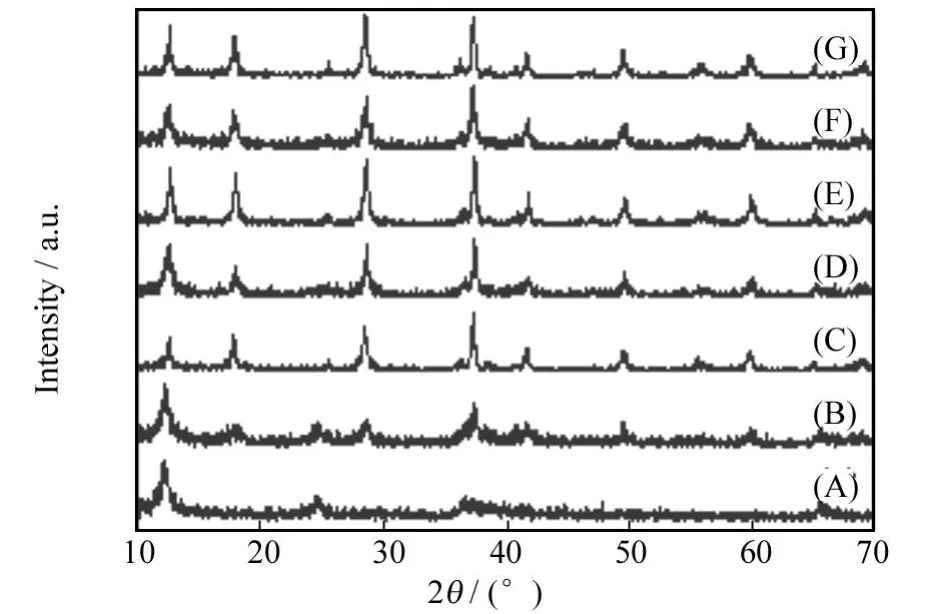
图3 水体系中不同温度下反应不同时间所得产品的XRD谱图Fig.3 XRD patterns of the products synthesized at different temperature for various time in water
2.2 MnOOH纳米棒的表征
对180℃温度下反应6 h后生成的MnOOH纳米棒进行透射电镜(TEM)和X射线能谱(EDS),红外光谱(FT-IR)分析表征.图4为其 TEM照片.由图4可以看出,样品为形貌统一的纳米棒状,其直径约为50~80 nm,长度约几个微米.X射线能谱分析结果表明样品中含有Mn和O两种元素,其原子比例接近于1∶2.
图5为MnOOH纳米棒的红外光谱图.由图5可以看出,在3 396 cm-1,2 669 cm-1,2 073 cm-1,1 632 cm-1,1 559 cm-1,1 412 cm-1,1 152 cm-1,1 116 cm-1,1 084 cm-1,591 cm-1,487 cm-1处出现了大小不同的吸收峰.在3 396 cm-1处出现了一个小吸收峰,为O-H的伸缩振动峰;在1 152 cm-1、1 116 cm-1、1 084 cm-1处的峰是由δ-1-OH、δ-2-OH、γ-OH的振动而引起的.在2 669 cm-1位置处的振动峰是由水锰矿结构中与氢键(O-H…O)有关的伸缩振动引起的;在1 632 cm-1处的峰归属于与Mn原子有相互作用的O-H伸缩振动,在2 073 cm-1处的振动峰可认为是2 669 cm-1处的O-H伸缩振动及591 cm-1位置处激发的Mn-O晶格振动的综合谱带.在591 cm-1和487 cm-1处有强而尖锐的窄峰,可归属于Mn-O的特征振动吸收峰.综上所述,上述FT-IR图与文献报道的γ-MnOOH的基本一致[20],因此可以进一步证明本实验中采用溶剂热法所得的产物为水锰矿型结构的MnOOH.

图4 MnOOH纳米棒的TEM照片Fig.4 TEM image of MnOOH nanorods
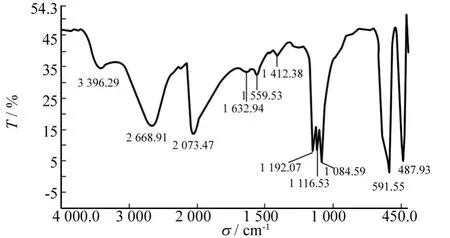
图5 MnOOH纳米棒的FT-IR光谱Fig.5 FT-IR spectrum of MnOOH nanorods
2.3 MnOOH纳米棒的热稳定性分析
对180℃温度下反应6 h后生成的MnOOH纳米棒在空气气氛中进行差热-热重分析,图6为样品的DTA-TG曲线.由图6可以看出,温度在15~200℃TG曲线有轻微的增重现象,这可能是因为在样品失去物理吸附水的同时,MnOOH发生了氧化作用生成 Mn(OH)4而导致的(4MnOOH+O2+6H2O→4Mn(OH)4).在温度为225℃时,样品的DTA曲线上出现了一个吸热峰,这对应于分子内脱水,即Mn(OH)4转化为锰的氧化物MnO2,同时在 TG曲线上200~250℃有失重行为.在温度为550℃左右DTA曲线有一个明显的吸热峰,这是由MnO2在高温下发生分解作用失去氧而引起的,此条件下的产物为Mn3O4(MnO2→Mn3O4+O2),此时 TG曲线有非常明显的下降,其失重率约为8.3%,这与理论失重率吻合.
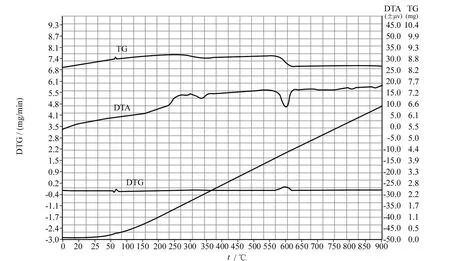
图6 MnOOH纳米棒的DTA-TG曲线Fig.6 DTA-TG curves of MnOOH nanorods
3 结论
采用溶剂热法制备了MnOOH纳米棒,棒直径约为50 nm,棒长达数微米.有关反应参数如反应温度、水热时间及溶剂等对纳米级MnOOH制备影响的研究结果表明:采用溶剂热法,在140~220℃,6~12 h条件下均可以得到MnOOH纳米材料;在MnOOH形成过程中,正丙醇起着至关重要的作用.
[1]HU Chi Chang,WU Yung Tai,CHANG Kuo Hsin.Low-temperature hydrothermal synthesis of Mn3O4and MnOOH single crystals:determinant influence of oxidants[J].Chem Mater,2008,20(9):2890-2894.
[2]CHENG Fang Yi,SHEN Jian,J I Wei Qiang,et al.Selective synthesis of manganese oxide nanostructures for electrocatalytic oxygen reduction[J].Appl Mater Int,2009,1(2):2460-466.
[3]ZHANG Yuan Guang,CHEN You Cun.Low-temperature hydrothermal synthesis of MnOOH nanorods[J].J Inorg Mater,2006,21(5):1249-1252.
[4]PORTEHAUL T D,CASSAIGNON S,BAUDRIN E,et al.Twinning driven growth of manganese oxide hollow cones through self-assembly of nanorods in water[J].Cryst Growth Des,2009,9(6):2562-2565.
[5]GAO Tao,NORBY P,KRUMEICH F,et al.Synthesis and properties of layered-structured Mn5O8Nanorods[J].J Phys Chem C,2010,114(2):922-928.
[6]GAO Tao,KRUMEICH F,NESPER R.Microstructures,surface properties,and topotactic transitions of manganite nanorods[J].Inorg Chem,2009,48(13):6242-6250.
[7]FERREIRA O P,OTUBO L,ROMANO R,et al.One-dimensional nanostructures from layered manganese oxide[J].Cryst Growth Des,2006,6(2):602-606.
[8]FU Xiao Ming,ZHONG Yun Bo,REN Zhong Ming,et al.Preparation of nanometer MnOOH by low-temperature neutralization method in low magnetic field[J].Rear Metal Mater Engin,2006,35(z1):351-354.
[9]LI Yu,TAN Hai Yan,LEBEDEV O,et al.Insight into the growth of multiple branched MnOOH nanorods[J].Cryst Growth Des,2010,10(7):2969-2976.
[10]DONG Xi Yan,ZHANG Xing Tang,CHENG Gang.Preparation and characterization of MnOOH nanorods in reverse micelles[J].Acta Chemica Sinica,2004,62(24):2441-2443.
[11]ZHANG Yong Cai,QIAO Tao,HU Xiao Ya,et al.Simple hydrothermal preparation ofγ-MnOOH nanowires and their low-temperature thermal conversion toβ-MnO2nanowires[J].J Cryst Growth,2005,280(3/4):652-657.
[12]MI Yu Hong,ZHANG Xiao Bin,ZHOU Sheng Ming,et al.Low temperature hydrothermal synthesis and characterization ofγ-MnOOH multipods[J].Chinese J Inorg Chem,2006,22(12):2242-2246.
[13]YANGBao Jun,ZHOU Tao,ZHOU A Yang,Research on synthesizing MnOOH nanotubes with self-sacrificing template route[J].Rear metals Cemented Carbides,2009,37(3):1-4.
[14]WANGLi,YUAN Zhong Zhi,CHEN Qiu Hong,et al.Sythesis of prismatic single crystalγ-MnOOH[J].J Inorg Mater,2007,22(4):667-670.
[15]OCANÄM.Uniform particles of manganese compounds obtained by forced hydrolysis of manganese(Ⅱ)acetate[J].Colloid Polym Sci,2000,278:443-449.
[16]YUAN Z Y,REN T Z,DU G H,et al.Facile preparation of single-crystalline nanowires ofγ-MnOOH andβ-MnO2[J].Appl Phys A,2005,80(4):743-747.
[17]ZHENG De Sha,YIN Zhi Lei,ZHANG Wei Ming,et al.Novel branchedγ-MnOOH andβ-MnO2multipod nanostructures[J].Cryst Growth Des,2006,6(8):1733-1735.
[18]QIAO Tao,XING Rong,ZHANG Yong Cai,et al.Low-temperature synthesis and characterization ofγ-MnOOH andβ-MnO2nanowires[J].Chinese Funct Mater,2004,35(z1):2823-2825.
[19]TANG Xing Fu,LIJun Hua,CHEN Jing Huan,et al.Synthesis and characterization ofγ-MnOOH nanorods with tetragonal prism cross section[J].Chinese J Inorg Chem,2008,24(9):1468-1473.
[20]SHARAMA P K,WHITTINGHAM M S.The role of tetraethyl ammonium hydroxide on the phase determination and electrical properties ofγ-MnOOH synthesized by hydrothermal[J].Mater Lett,2001,48(6):319-323.
Synthesis of nanosized MnOOHviasolvothermal route
CHEN Lin1,TIAN Li2*,LI Shuai2,ZHU Jin-liang2,LÜShu-zi
(1.Department of Student A f f airs,Hunan University of Science and Technology,Xiangtan411201,Hunan,China;
2.Department of Material Science and Engineering,Hunan University of Science and Technology,Xiangtan411201,Hunan,China)
O 614.7
A
1008-1011(2011)01-0053-05
2010-09-04.
中南大学博士后基金(1332/74341015511)、湖南科技大学博士启动基金(E51079)及教育科研基金(G30953)资助项目.
陈琳(1973-),男,工程师,硕士生.研究方向:纳米材料的制备及性能研究.E-mail:ltian@hnust.edu.cn.

