7种甲型H1N1流感病毒核酸检测方法的比较和验证
蔡 颖 周广彪 陈文婉 许如苏
(汕头出入境检验检疫局 广东汕头 515031)
7种甲型H1N1流感病毒核酸检测方法的比较和验证
蔡 颖 周广彪 陈文婉 许如苏
(汕头出入境检验检疫局 广东汕头 515031)
[目的]比较和验证7种甲型H1N1流感病毒核酸检测方法,筛选出可用于实验室日常检测的方法,并证实实验室具有正确操作这些方法的能力。[方法]应用7种方法检测甲型H1N1流感病毒核酸,包括5种SYBR Green I荧光RT-PCR法和2种Taqman探针荧光RT-PCR法的商业试剂盒,用于方法比较和验证的参考样品包括猪流感H1N1病毒核酸、2009年新甲型H1N1流感病毒核酸、能力验证样品等不同来源的核酸。[结果]2种预期用于猪流感H1N1病毒核酸检测的SYBR Green I荧光RT-PCR法均能达到预期目的;3种预期用于2009年新甲型H1N1流感病毒核酸检测的SYBR Green I荧光RT-PCR法均无法区分2009年新甲型H1N1流感病毒核酸和猪流感H1N1病毒核酸;2种Taqman探针荧光RT-PCR试剂盒均能正确检出2009年新甲型H1N1流感病毒核酸,但只有1种可检出能力验证阳性样品。[结论]5种SYBR Green I荧光RT-PCR法中有2种能用于猪流感H1N1病毒核酸的检测,另外3种不能用于新甲型H1N1流感病毒核酸的检测;2种Taqman探针荧光RT-PCR法的商业试剂盒能用于2009年新甲型H1N1流感病毒核酸的检测。
实时荧光RT-PCR;甲型H1N1流感病毒;检测;比较;方法证实
1 前言
2009年3月以来,一种新型甲型H1N1流感首先在墨西哥、美国等国家发生爆发流行[1],随后在世界范围内迅速蔓延[2]。此次流行的甲型H1N1流感病毒是一种新型病毒,其基因组内存在四源重配,其中PB2和PA基因源自禽流感H1N1病毒,PB1基因源自人季节性流感H3N2病毒,HA、NP和NS基因源自古典型猪流感H1N1病毒,NA及M基因源自欧亚系猪流感H1N1病毒[3,4]。为筛查流感可疑病例,控制流感疫情蔓延,同时监测这种新型病毒在动物中流行情况,迫切需要开发针对这种新型甲型H1N1流感病毒的检测方法。WHO、中国疾病预防控制中心先后发布了相关的检测方法荧光RT-PCR和普通RT-PCR方法[5,6]。对于基层检测机构,通常只需要进行少数样本的筛查,无需进行确证实验,如果完全按WHO、中国疾病预防控制中心的检测方法,需进行多个RT-PCR反应,合成标记的引物探针较多,检测成本比较高,工作量也较大,因此,成本相对低廉的SYBR Green I荧光RT-PCR法成为一种可供选择的替代方法。另外,不少试剂公司开发了相关荧光RT-PCR检测试剂盒,多数试剂盒只需进行一次反应即可得出初步结果,为基层检测机构的初筛提供了其他选择。按ISO/IEC 17025:2005的规定,实验室在引进新的标准方法之前需进行能力证实。为此,本实验室利用保存的猪流感H1N1病毒核酸、2009年新甲型H1N1流感病毒核酸等参考标准,对本室建立的5个SYBR Green I荧光RT-PCR法以及深圳太太基因工程有限公司、广州千江企业有限制公司的2个试剂盒进行了实验室内比较和验证,筛选出可用于实验室日常检测的方法,并证实本室有能力正确应用该方法进行检测。
2 材料与方法
2.1 材料
2.1.1 参考样品
2009年新甲型H1N1流感病毒核酸:由相关友好单位惠赠;猪流感H1N1亚型灭活病毒核酸:购自哈尔滨兽医研究所;2份试剂盒阳性对照:分别来自于深圳太太基因工程有限公司(以下简称“深圳太太”)、广州千江企业有限公司(以下简称“广州千江”),简称“太太阳性”和“千江阳性”;6份CNAS能力验证样品:由2009年CNAS甲型H1N1流感病毒核酸检测能力验证(CNAS T0459)提供者北京出入境检验检疫局检验检疫技术中心分发,指导书中标明样品为体外合成的HA、NA和M基因全序列RNA,编号分别为0206、0324、0387、0424、0540、0674,样品指定值由能力验证提供者在能力验证完成若干时间后通知本室。
2.1.2 SYBR Green I荧光RT-PCR引物
序列分别来自于WHO[5]、中国疾病预防控制中心[6]和张春明[7],见表1,由上海生工生物工程技术服务有限公司合成。

表1 SYBR Green I荧光RT-PCR引物序列
2.1.3 试剂
2种甲型H1N1流感病毒荧光PCR检测试剂盒分别由“深圳太太”、“广州千江”提供试用装,“深圳太太”试剂盒生产日期为2009.8.10,“广州千江”试剂盒生产日期为2009.8.11;One Step SYBR?Prime Script?RT-PCR Kit购于宝生物工程(大连)有限公司,RNA提取液为“深圳太太”试剂盒内所配。2.1.4 仪器
Smart Cycler II荧光PCR仪:美国Cephied公司产品。
2.2 实验方法
2.2.1 RNA提取
按国家标准GB/T 19438.1-2004《禽流感病毒通用荧光RT-PCR检测方法》进行。
2.2.2 SYBR Green I荧光RT-PCR条件
反应体系总体积为20μL,包括One Step SY BR?RT-PCR Buffer Ⅲ10μL、上下游引物各0.4μL、TaKaRa Ex Taq HS 0.4μL、Prime Script RT Enzyme Mix Ⅱ0.4μL、RNA模板5μL、DEPC H2O 3.6μL。PCR扩增程序为:42℃10 min,95℃1 min→(95℃10s,61℃30s,72℃1min)×5→(95℃10s,60℃45s,78℃6s采集荧光)×40→熔解曲线检测(程序一)。
2.2.3 Taqman荧光RT-PCR扩增程序
(1)按GB/T 19438.1-2004进行:42℃10 min,95℃1 min→(95℃10s,45℃30s,72℃1min)×5→(95℃10s,60℃30s采集荧光)×40(程序二);
(2)42℃10 min,95℃1 min→(95℃10s,61℃30s,72℃1min)×5→(95℃10s,60℃45s,78℃6s采集荧光)×40(程序三)。
使用“深圳太太”试剂盒扩增以下称为方法6,使用“广州千江”试剂盒扩增以下称为方法7。
3 结果
3.1 SYBR Green I荧光RT-PCR检测结果
5种SYBR Green I荧光RT-PCR法全部能检出猪流感H1N1病毒核酸,但其中仅有方法1、2能正确检出2009年新甲型H1N1流感病毒核酸;方法5对新甲型H1N1流感病毒核酸的扩增产物与参考标准的Tm值比较接近,但仔细分析还是略有差别,应为非特异性扩增产物。见表2、图1、图2。
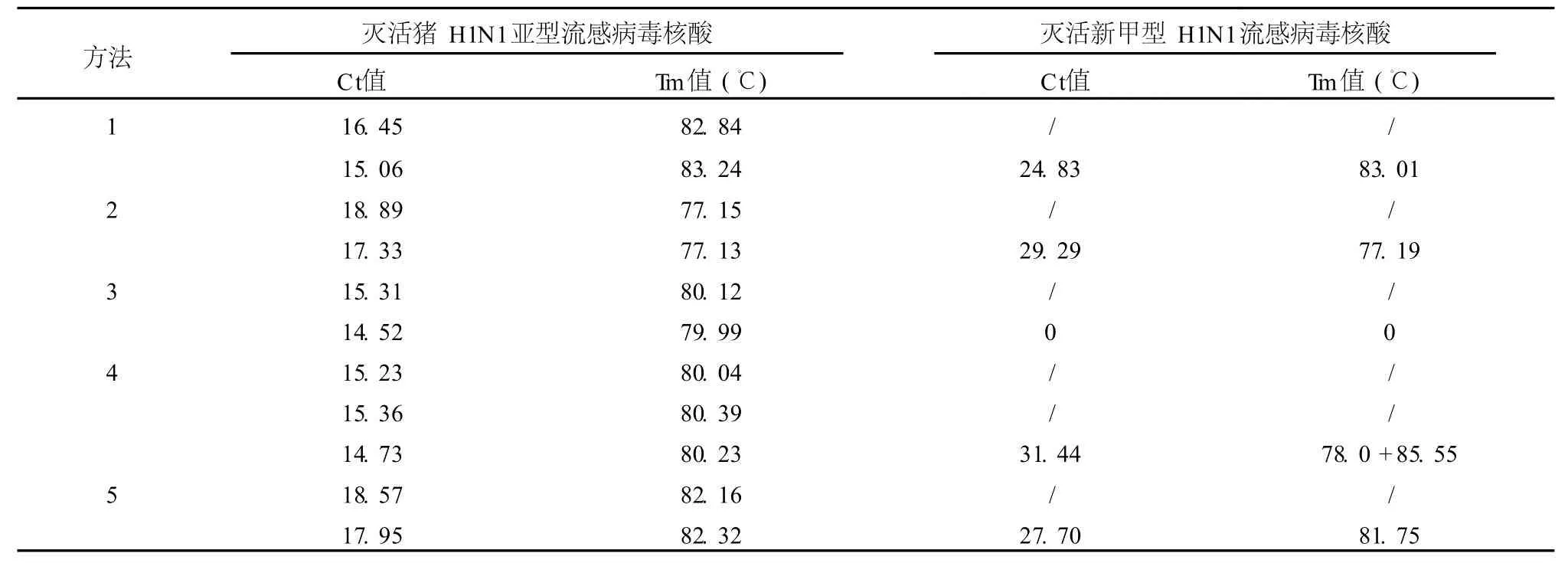
表2 SYBR Green I荧光RT-PCR检测结果
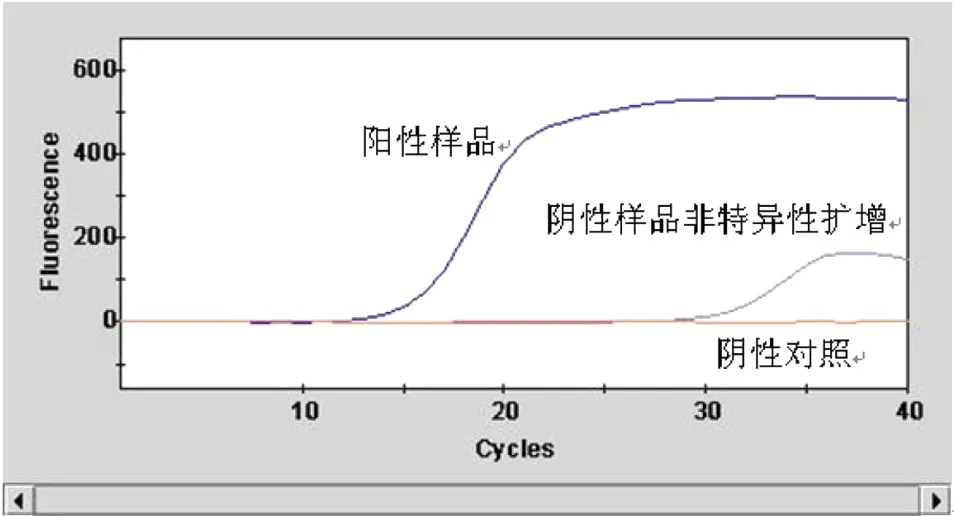
图1 SYBR Green I荧光RT-PCR扩增曲线图
3.2 2种Taqman荧光RT-PCR试剂盒检测结果
2种Taqman探针荧光RT-PCR法商业试剂盒都能检出2009年新甲型H1N1流感病毒核酸,也能检出自身所配阳性对照,但均无法检出非已方试剂盒的阳性对照和猪流感H1N1病毒核酸,见表3。
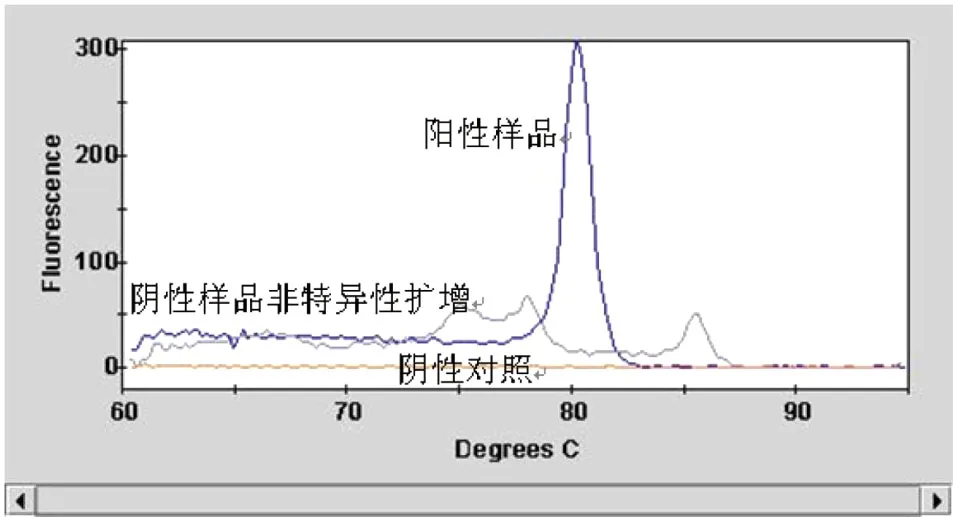
图2 SYBR Green I荧光RT-PCR扩增产物熔解曲线图

表3 2种Taqman荧光RT-PCR试剂盒检测结果(Ct值)
3.3 能力验证样品检测结果
“深圳太太”试剂盒扩能正确检测能力验证样品中的4个阳性和2个阴性;“广州千江”试剂盒的所有样品检测结果均为阴性,见表4和图3。

表4 能力验证样品检测结果(Ct值)
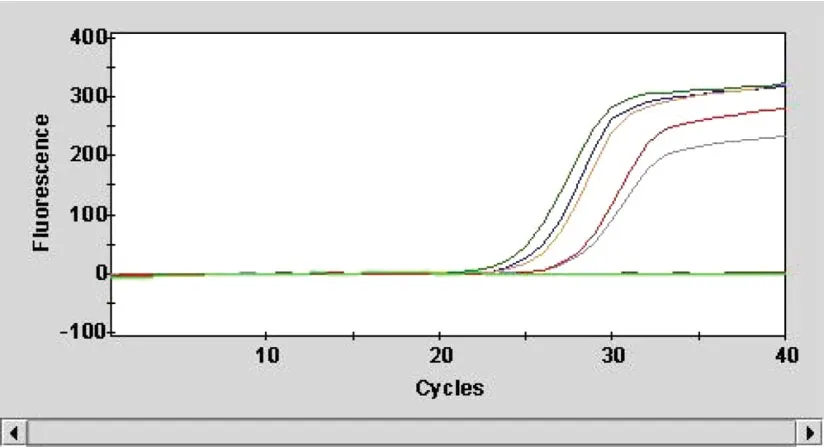
图3 Taqman荧光RT-PCR扩增曲线图
4 讨论
4.1 新方法开检能力证实
ISO/IEC 17025:2005条款5.4.2规定,“在引入检测或校准之前,实验室应证实能够正确地运用这些标准方法”。本研究中的7种方法有些来源于权威机构,有些来源于经审核获通过的学位论文,还有些来源于经过一定程序验证的商业试剂盒,但要在本室正式使用,仍需进行方法证实。但方法证实不同于方法确认,方法证实侧重于证实能正确应用,仅需要按程序检测阴阳性对照,能得出正确结果即可,不需要象方法确认那样,可能只有少数具备较高水平技术人员、具备较为完备的各种阴阳性对照的实验室才能进行。因此,本实验室只是简单地应用新甲型H1N1流感病毒核酸、猪流感H1N1亚型灭活病毒核酸、能力验证中阳性样品作为阳性对照,新城疫病毒核酸、能力验证中阴性样品作为阴性对照,按程序进行检测,就可满足ISO/IEC 17025:2005中关于方法证实的要求。
4.2 SYBR Green I荧光RT-PCR法
常规RT-PCR方法的灵敏度比Taqman荧光RT-PCR方法低,而且需要制胶、跑胶、拍照等,方法比较繁琐,还有接触有毒物质溴乙锭的危险,出于实验室安全管理的考虑,应尽可能选用替代方法。SYBR Green I荧光RT-PCR就是一种不错的替代方法,可直接使用常规RT-PCR方法的引物,无需接触溴乙锭,操作上与Taqman荧光RT-PCR方法一样简便,也可实时观察扩增结果。虽然无法检测出扩增产物的片段大小,同时SYBR Green I与双链DNA的结合又是非特异性,但仍可通过熔解曲线区分非特异性信号和特异性信号。实验过程中笔者发现,非特异扩增产物的熔解温度(多数低于80℃)较特异性产物熔解温度低(多数高于80℃),这与文献[9]的描述一致。因此,可以通过提高信号采集温度来消除非特异性扩增曲线的出现,所以本研究采用了78℃而不是常用的60℃作为信号采集时的温度。
本研究建立的5种SYBR Green I荧光RTPCR法中,方法1、2、3中使用的引物原用于新甲型H1N1流感病毒核酸的探针法荧光RT-PCR检测[5,6],方法4、5使用的引物原用于猪流感H1N1病毒核酸的探针法荧光RT-PCR检测[7],选择探针法荧光RT-PCR的引物的优点在于,需要时可随时合成探针,与这些引物组合用于探针法荧光RTPCR检测。本研究的结果显示,这些引物用于SYBR Green I荧光RT-PCR检测基本取得了预期的效果。如方法1、2可正确检出新甲型H1N1流感病毒核酸,方法4、5则可正确检出猪流感H1N1病毒核酸。不过,也出现了一些预期外的结果,如方法3无法检出新甲型H1N1流感病毒核酸,但能检出猪流感H1N1病毒核酸;方法1、2也可检出猪流感H1N1病毒核酸;方法5也可检出新甲型H1N1流感病毒核酸。方法3出现预期外的结果的原因可能是,本研究的猪流感H1N1病毒核酸中正好与方法3的引物完全吻合,而本研究的新甲型H1N1流感病毒核酸正好在引物区变异,导致完全没有扩增产物。经作者使用美国国立卫生研究院的网上BLAST软件进行搜索后,发现这对引物虽然吻合的序列多数为新甲型H1N1流感病毒株,但也有个别猪流感H1N1病毒株核酸可完全吻合。同时也证明该对引物的特异性尚不十分理想。方法1、2也可检出猪流感H1N1病毒核酸的原因是这段引物的序列正好也与猪流感H1N1病毒核酸的序列完全吻合,而原文献的探针对应的序列正好为新甲型H1N1流感病毒株的特异性序列,所以原文献的探针法荧光RT-PCR可以特异性地检出新甲型H1N1流感,但仅使用其引物的SYBR Green I荧光RT-PCR则无法区分这两种流感病毒核酸。经作者使用网上BLAST软件进行搜索后,也证实了这个猜想。方法5虽然检出新甲型H1N1流感病毒核酸,但仔细分析其熔解曲线及Tm值,两种病毒核酸扩增产物的的熔解曲线不同,Tm值也略有差别,说明扩增产物不完全相同。
4.3 Taqman探针荧光RT-PCR法
Taqman探针荧光RT-PCR法具有特异性强、快速、灵敏、条件优化较为简单等优点,而且可以通过多色荧光PCR同时检测多个基因片段,但缺点是方法开发及检测的成本均比较高。对于检测样品不太多的基层检测机构,使用商业化试剂盒是一个不错的选择。但对于新甲型H1N1流感病毒这类高致病性病原核酸的检测,由于普通试剂公司缺乏合适的阳性对照,其试剂盒的有效性还需检测机构的验证或证实。本研究的结果显示,两个试剂盒均能正确检测各自试剂盒内阳性对照,说明其内部质控都控制得不错;都不能检出非己方的试剂盒阳性,是因为试剂盒中的阳性对照并非病毒的基因组RNA,而是体外合成的RNA片段,正好不包含与对方引物吻合的片段。总共分别检测新甲型H1N1流感病毒核酸3次,均为阳性,检测猪流感H1N1病毒核酸均为阴性,说明这两个试剂盒均可用于新甲型H1N1流感病毒核酸的检测。
4.4 能力验证样品
经中国实验室国家认可委员会(CNAS)认可的能力验证提供者在组织能力验证时提供给参加单位的样品均经过严格的稳定性、均匀性检测,可以作为基层检测机构难得的参考样品。虽然数量有限,但还是可以在方法证实甚至在方法确认中起到不小的作用。本研究结果显示,“深圳太太”试剂盒扩能正确检测能力验证样品中的4个阳性和2个阴性;“广州千江”试剂盒的所有样品检测结果均为阴性。这个结果进一步证实了“深圳太太”试剂盒对新甲型H1N1流感病毒核酸的检测能力。但“广州千江”试剂盒是否就不能用于新甲型H1N1流感病毒核酸的日常检测了呢?实际上,出于生物安全考虑,所有6个能力验证样品均为体外合成的HA、NA和M基因全序列RNA,而不是病毒的基因组RNA,推测“广州千江”试剂盒检测的目标序列位于这3个基因之外的序列上。
5 结论
本文初步证实了方法4、5检测猪流感H1N1病毒核酸及2个Taqman探针荧光RT-PCR试剂盒检测新甲型H1N1流感病毒核酸的有效性;证实了本室正确运用这4种方法的能力;证实方法1、2、3不能用于新甲型H1N1流感病毒核酸的检测。
[1] World health Organization.Pandemic(H1N1)2009-update 31.17 May 2009[EB/OL].http://www.who.int/csr/don/2009_05_17/en/index.html.
[2] World Health Organization.Pandemic(H1N1)2009-update 64.04 September 2009[EB/OL].http://www.who.int/csr/don/2009_09_04/en/index.html.
[3] Novel Swine-Origin Influenza A(H1N1)Virus Investigation Team.Emergence of a Novel Swine-Origin Influenza A(H1N1)Virus in Humans[J].N.Engl.J.Med,2009,360(25):2605-2615.
[4] Garten R J,DavisC T,RussellC A,et al.Antigenic and genetic characteristics of s wine-origin 2009 A(H1N1)influenza viruses circulating in humans[J].Science,2009,325(5937):197-201.
[5] CDC protocol of real time RT-PCR for influenza A(H1N1)[EB].http://www.who.int/csr/resources/publications/swineflu/realtimeptpcr/en/index.html.
[6] 甲型H1N1流感病毒实验室检测技术方案[EB/OL].http://www.chinacdc.cn/n272442/n272530/n273736/n273781/n4624704/n4661330/appendix/fangan.doc.
[7] 张春明.实时荧光定量PCR技术快速定量检测H3N2、H1N1和H1N2亚型猪流感病毒[D].新疆农业大学硕士论文.2008:32.
[8] CNAS-CL01检测和校准实验室能力认可准则(ISO/IEC 17025:2005)[S].
[9] Bustin SA.Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays[J].J.Mo1.Endocrinol,2000,25(2):169-193.
The Comparison and Validation of 7 Methods for the Detection of Nucleic Acid from H1N1
Influenza A Virus
Cai Ying,Zhou Guang biao,Chen Wenwan,Xu Rusu
(Shantou Entry-Exit Inspection and Quarantine Bureau,Shantou,Guangdong,515031)
[Objectives]To compare and validate 7 methods for the detection of nucleic acid from H1N1 influenza A virus,select suitable methods for routine detection in lab,and prove that our lab can properly operate these methods.[Methods]7 methods were compared and validated,including 5 SYBR Green I fluorescent RT-PCR methods and 2 Taqman fluorescent RT-PCR commercial kits.The reference samples were nucleic acid from swine influenza A virus H1N1,2009 novel H1N1 influenza A virus and 6 samples from CNAS proficiency test.[Results]The 2 SYBR Green I fluorescent RT-PCR methods anticipated for detection of the nucleic acid from s wine influenza A virus H1N1 works well;none of the 3 SYBR Green I fluorescent RT-PCR methods anticipated for detection of the nucleic acid from 2009 novelH1N1 influenza were unable to distinguish the 2009 novelH1N1 influenzaA virus from swine influenzaA virusH1N1.The 2 Taqman fluorescent RT-PCR commercial kits indicated good results for detecting 2009 novel H1N1 influenza,but only one read a correct result for detecting H1N1 samples in one proficiency test.[Conclusions]Among 5 SYBR Green I fluorescent RT-PCR methods,2 methods can be used in the detection of nucleic acid from swine influenza A virus H1N1,and other 3 methods are not proper for detecting 2009 novel H1N1 influenza A virus,while 2 Taqman fluorescent RT-PCR commercial kits can be used for detection of nucleic acid from 2009 novel H1N1 influenza A virus.
Real Time RT-PCR;Influenza A(H1N1)Virus;Detection;Validation;Confirmation of Method
Q939.47;R373.1

