E1A激活基因阻遏子促进人血管内皮细胞VEGF分泌和单层通透性增加*
王占胜, 韩雅玲, 康 建, 张效林, 陶 杰, 田孝祥, 闫承慧
(1沈阳军区总医院全军心血管病研究所心内科, 辽宁 沈阳 110016;2大连医科大学,辽宁 大连 116044)
E1A激活基因阻遏子促进人血管内皮细胞VEGF分泌和单层通透性增加*
王占胜2, 韩雅玲1△, 康 建1, 张效林1, 陶 杰1, 田孝祥1, 闫承慧1
(1沈阳军区总医院全军心血管病研究所心内科, 辽宁 沈阳 110016;2大连医科大学,辽宁 大连 116044)
目的探讨E1A激活基因阻遏子(CREG)诱导的人血管内皮细胞(ECs)单层通透性改变中的作用及机制。方法用CREG过表达及CREG表达下调的ECs为模型,Transwell chamber弥散模型观察ECs单层通透性的改变; 荧光倒置显微镜观察细胞骨架肌动蛋白F-actin及黏附连接蛋白VE-cadherin在ECs中的分布和形态学改变;酶联免疫吸附实验(ELISA)检测ECs血管内皮生长因子(VEGF)分泌。结果CREG过表达的ECs (EO组) 较EN组单层通透性明显增高 (P<0.05);CREG表达下调的ECs(ES组)较EN组单层通透性有所下降(P<0.05)。与EN组相比较,EO组细胞中F-actin排列紊乱,形成大量应力纤维; ES组F-actin则主要呈细丝状分布于细胞周边,中央分布较少。同时,EO组VE-cadherin在细胞周边的正常拉链状结构减少或缺失,细胞间隙增宽;而ES组VE-cadherin在细胞周边呈正常拉链状分布,细胞之间连接紧密。ELISA检测显示EO组细胞上清中VEGF分泌较EN组明显增加(P<0.05);ES组VEGF分泌较EN组减少(P<0.05)。应用VEGF中和抗体阻断后,CREG过表达引起的EO通透性增加的现象明显受到抑制。结论CREG过表达可能通过VEGF介导的信号途径引起F-actin重构及VE-cadherin减少,使血管内皮细胞单层通透性增加。
E1A激活基因阻遏子; 血管内皮细胞; VE-cadherin; 细胞骨架; 通透性; 血管内皮生长因子
人类心肌血管新生治疗为冠心病的治疗提供了一种新的方法,通过调节血管的生成及增加心肌血管的密度,可以提高心肌的灌注,改善患者的症状和提高劳动能力[1]。血管内皮细胞骨架蛋白改变,内皮细胞收缩或回缩,血管内皮细胞黏附连接蛋白VE-cadherin破坏,细胞间隙增大,引起血管通透性增加则是血管新生序列事件中重要的始动环节。因此,阐明血管内皮通透性改变的机制,寻找促进血管新生调控的活性分子,对缺血性疾病的防治具有重要意义。
本室先前研究已证实[2-4],E1A激活基因阻遏子(cellular repressor of E1A-stimulated genes, CREG)在胚胎血管发育早期即开始表达,参与了血管发生的调控。并且,进一步研究证实,CREG是血管平滑肌细胞成熟分化的重要调控因子,参与了血管成熟稳态的调控。但目前关于CREG在血管内皮细胞中表达的生物学作用尚未见报道。本研究以体外培养的人血管ECs系(VE)为研究对象,应用逆转录病毒载体分别介导CREG在VE细胞中过表达及表达下调,观察CREG表达对动脉ECs单层通透性的影响并探讨其调控血管内皮细胞通透性的机制及其与内皮细胞血管新生的作用。
材 料 和 方 法
1材料
1.1主要试剂 抗CD31单克隆抗体购于Sigma;抗CREG多克隆抗体购于R&D;Biotin-BSA购于Sigma;异硫氰酸四甲基罗丹明-鬼笔环肽(TRITC-phalloidin)购于Sigma;抗VE-cadherin多克隆抗体购于Sigma;抗血管内皮生长因子(vascular endothe-lial growth factor,VEGF)中和抗体购于R&D。
1.2细胞来源 人血管ECs 细胞系VE购自ATCC,我室已建立感染pLNCX-CREG 逆转录病毒的过表达(over expressing)CREG 蛋白VE细胞株命名为EO、感染pLNCX-shRNA-CREG 病毒CREG表达沉默(suppression)的VE细胞株命名为ES;转染的空载体对照组的VE细胞株命名为EN。上述细胞株均在含10%胎牛血清的DMEM培养液中培养,2-3 d传代1次。
2方法
2.1Western blotting检测CREG蛋白的表达 采用BCA法测定细胞裂解液中蛋白浓度,并进行SDS-PAGE、转膜、抗体结合及显色。Ⅰ抗为CREG多克隆抗体(1∶1 000),Ⅱ抗为HRP标记IgG(1∶2 000),按ECL试剂盒(Amersham)说明书进行检测显影。
2.2ECs单层通透性检测 参照Essler等[5]建立的方法,用示踪剂Biotin-BSA检测ECs单层通透性变化。将ECs接种在12孔Transwell chamber (0.4 μm pore size,12 mm diameter)多聚碳脂滤膜的弥散模型中,每个小室铺3×105个细胞,各设置2个复孔,置37 ℃、5%CO2的细胞培养箱培养,4 h后弃去未贴壁细胞,生长4 d细胞融合成单层后用于实验。在上室中加入Biotin-BSA使其为终浓度为100 mg/L,作用30 min后,分别从下室取60 μL培养基置于96孔板,加入链霉亲和素-过氧化物酶,TMB显色10 min,然后加入2 mol/L H2SO450 μL终止反应,Bio-Rad 550型酶标仪在波长470 nm处检测吸光度变化,实验重复5次,取平均值。
2.3免疫荧光法检测ECs的F-actin肌动蛋白的分布 将3组ECs接种于清洁灭菌的盖玻片上,待生长融合至细胞单层后,用37 ℃的PBS洗3次,4%多聚甲醛磷酸缓冲液固定15 min,0.2% Triton X-100 通透15 min,加入1%BSA磷酸缓冲液封闭1 h,用100 μg/L的TRITC-phalloidin[TRITC最大吸收波长为(540±25) nm,最大发射波长为(608±32) nm]进行F-actin肌动蛋白染色,置暗处反应60 min,30%甘油-PBS封片,在荧光倒置显微镜下观察肌动蛋白细胞骨架F-actin的分布变化。
2.4免疫荧光法检测ECs黏附连接蛋白VE-cadherin改变 将3组ECs培养在清洁灭菌的盖玻片上,待生长融合至细胞单层后,用37 ℃的PBS洗3次,4%多聚甲醛室温固定20 min,0.2% Triton X-100室温通透15 min,PBS洗涤3次后,5%山羊血清封闭30 min,加入抗人VE-cadherin抗体(1∶100)4 ℃孵育过夜,PBS洗涤3次,加入荧光标记Ⅱ抗(1∶100)室温孵育2 h,PBS洗涤3次,甘油封片,在荧光倒置显微镜下观察VE-cadherin表达的变化。
2.5酶联免疫吸附实验(ELISA)测ECs的VEGF分泌 将3组ECs在60 mm培养皿中融合至80%左右,弃去培养基,无菌PBS洗涤10 mL×3次,尽量吸尽残留液体,加无血清的DMEM 4 mL(以尽量少的液体覆盖细胞表面),置37 ℃、5% CO2的细胞培养箱继续培养24 h后收集上清,进行VEGF的ELISA检测,根据ELISA试剂盒说明书进行。实验前以细胞计数结果校对上样量,使上样量保持一致。紫外透射仪读取结果,每次实验读数取3个,重复5次。
2.6抗VEGF中和抗体阻断实验 同时应用抗VEGF中和抗体(0.5 mg/L)对3组内皮细胞预处理12 h,用Transwell chamber嵌套装置按前述方法测定ECs单层的通透性。应用抗VEGF中和抗体(0.5 mg/L)对3组ECs预处理12 h后,按前述方法进行ECs肌动蛋白骨架F-actin及黏附连接蛋白VE-cadherin的免疫荧光染色及观察。
3统计学处理

结 果
1Westernblotting检测CREG蛋白的表达
结果显示,ES组CREG表达量明显减少,经计算CREG表达量为正常组的48.9%(对β-actin比值比为0.42±0.01,P<0.05)。EO组CREG表达量与对照组EN相比表达量明显增高(1.20±0.03,P<0.05),增加了38.2%,见图1。

图1Westernblotting检测分析3组ECs的CREG表达量
2CREG过表达增加ECs单层的通透性
在Western blotting检测上述各转染组细胞中CREG的表达基础上,应用示踪剂Biotin-BSA检测发现,CREG过表达的EO细胞单层通透性明显增加(0.0490±0.0016),与EN对照组(0.0376±0.0061)比较差异显著(P<0.05)。同时,CREG表达沉默的ES组单层通透性下降(0.0324±0.0114),与EN对照组(0.0376±0.0061)比较差异显著(P<0.05),见图2,结果提示CREG过表达引起内皮细胞通透性增加。
3CREG过表达引起ECs肌动蛋白骨架F-actin重排和VE-cadherin表达减少
应用激光共聚焦显微镜观察,可见EN组细胞连接紧密,F-actin主要分布于细胞周边,呈“花环”样排列,少量呈细丝状无序地分布于胞浆,核周偶有应力纤维形成。而CREG过表达的EO组细胞中的F-actin则明显呈向心性回缩, F-actin边聚现象消失,胞浆内的F-actin明显增多,出现大量应力纤维,并呈典型的竹排样结构。CREG表达沉默的ES组细胞中F-actin分布与EN组相似,主要分布于细胞周边,中心也有少量分布。进一步应用免疫组化检测细胞中黏附连接蛋白VE-cadherin,发现EN组和ES细胞中VE-cadherin在单层融合血管内皮细胞的周边呈正常拉链状排列,细胞之间连接紧密。EO组细胞中VE-cadherin分布明显减少,同时细胞间隙增宽,见图3。上述实验结果提示,CREG过表达引起内皮细胞骨架蛋白重排和细胞间隙连接蛋白表达下降。
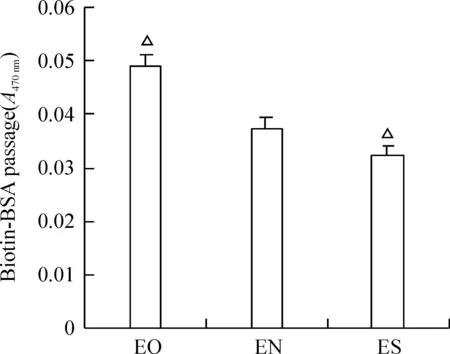

图2Transwell测量3组ECs通透性的结果

Figure 3. Immunocytochemical staining of F-actin and VE-cadherin in different groups.
图3免疫荧光染色观察3组ECs的F-actin及VE-cadherin的变化
4VEGF介导CREG诱导的血管内皮通透性改变
ELISA检测3组细胞上清中VEGF的结果显示,与EN组(577.20±10.43) ng/L相比,CREG过表达的EO组细胞中VEGF分泌最高(1 392.00±5.83) ng/L,而CREG沉默的ES中VEGF最低(391.40±4.04),三者(EO组、EN组、ES组)间差异显著(P<0.05),见图4。加入VEGF中和抗体后,EO组细胞单层通透性下降至(0.0388±0.0013)与处理前(0.0490±0.0017)比较差异显著(P<0.05),见图5A;同时细胞F-actin应力纤维解聚,见图5B,VE-cadherin回复为细胞周边拉链状分布,见图5C。


图4ELISA方法检测培养基中VEGF的分泌

图5VEGF中和抗体对CREG诱导ECs通透性改变及F-actin、VE-cadherin表达的影响
讨 论
CREG是1998年Gill等首次从HeLa细胞系克隆出来的,研究证实CREG是一种分泌型糖蛋白,其在多种细胞中发挥抑制增殖和促进分化的作用。我室前期研究表明CREG过表达可通过PI3K-Akt途径促进体外培养的人动脉ECs的迁移;可通过PI3K途径促进动脉ECs的增殖[6]。由此我们可以推测CREG可能是正常血管维持稳态的重要调控蛋白,对于血管正常生理功能起重要作用。
本实验研究表明,CREG过表达可诱导ECs通透性增加,促进ECs的VEGF分泌。CREG引起ECs通透性增高时,一方面,ECs的肌动蛋白细胞骨架解聚,出现大量的应力纤维,加入VEGF中和抗体后,F-actin分布向细胞膜处转移,细胞内应力纤维形成有所减少;另一方面,EO组ECs的VE-cadherin在ECs周边的正常链状染色减少或脱失,加入VEGF中和抗体后,VE-cadherin在血管内皮细胞周边的正常染色增多,提示CREG引起F-actin重新分布、VE-cadherin在ECs周边的正常链状染色减少或脱失及增加血管内皮细胞通透性的作用可能是通过VEGF介导来实现的。CREG表达下调可减低ECs通透性,减少ECs的VEGF分泌,使F-actin主要分布在ECs周边,VE-cadherin在ECs周边呈正常链状染色,连接紧密,与EO组加入VEGF中和抗体后的表现相似,进一步证实VEGF在CREG引起ECs单层通透性增高中介导的作用。促进心肌缺血区血管新生的能力,进而限制损伤区域,是缺血性心脏病治疗的一个重要方法。ECs通透性增高是血管新生的一个重要环节,可使血浆蛋白溢出血管外,导致纤维蛋白在血管外凝结,形成血管生成的临时基质。这些基质一方面促进血管的生成,另一方面促使一些间质细胞进一步形成成熟的血管基质,从而有利于血管的生成。 因此探讨ECs通透性改变及其机制研究尤为重要,目前认为ECs单层通透性变化与F-actin的重新分布及VE-cadherin表达的减少和脱失有关。F-actin的变化可通过VE-cadherin的链状结构影响黏附连接,使ECs间裂隙和内皮通透性发生改变[7,8]。
总之,CREG作为一种新的具有维持血管稳态的重要调控蛋白,其大量表达可以增加ECs的VEGF表达,而VEGF是一种特异性作用于血管ECs表面受体的生长因子,能够维持血管正常状态和完整性,增加血管通透性,诱导血管发生并促进血管生成[9]。目前的研究表明CREG能够促进ECs的增殖和迁移[6],而ECs穿过周围细胞外基质增殖和迁移是血管新生事件中的一个重要环节[10]。因此,CREG可以用于缺血性心肌梗死的促血管新生的治疗。基于VEGF表达时程,在心肌梗死中血管生成活动可能是一个延迟反应,那么,VEGF在亚急性及慢性阶段是否可以应用CREG调控VEGF的表达从而充分利用内源性VEGF并获得长期且最佳效果有待进一步探讨。随着医学科学发展,CREG有望成为缺血性心脏病治疗的又一可靠、有效的手段。
[1] Stegmann TJ, Hoppert T, Schneider A, et al.Induction of myocardial neoangiogenesis by human growth factors. A new therapeutic approach in coronary heart disease[J].Herz,2000,25(6):589-599.
[2] 韩雅玲,闫承慧,刘海伟,等. E1A激活基因阻遏子过表达诱导体外培养大鼠平滑肌细胞分化[J]. 生物化学与生物物理进展, 2004, 31(12):1099-1105.
[3] 韩雅玲,邓 捷,梁 明,等. 逆转录病毒介导的E1A激活基因阻遏子抑制大鼠颈动脉球囊损伤后新生内膜形成[J]. 中国病理生理杂志, 2007, 23(10):1873-1877.
[4] Han Y, Guo L, Yan C, et al. Adenovirus-mediated intra-arterial delivery of cellular repressor of E1A-stimulated genes inhibits neointima formation in rabbits after balloon injury[J]. J Vasc Surg, 2008, 48(1):201-209.
[5] Essler M,Retzer M,Bauer M,et al.Mildly oxidized low density lipoprotein induced contraction of human endothelial cells through activation of Rho/Rho kinase and inhibition of myosin light chain phosatase[J].J Biol Chem,1999,274(43):30361-30364.
[6] 陶 杰.CREG基因调控人动脉内皮细胞迁移和增殖的作用及其机制研究[D].西安:第四军医大学,2009,49-60.
[7] Mackay DJ, Hall A. Rho GTPases[J].J Biol Chem,1998,273(33):20685-20688.
[8] Thurston G,Turner D.Thrombin-induced increase of F-actin in human umbilical vein endothelial cells[J].Microvasc Res,1994,47(1):1-20.
[9] 陈 勇,周正炎,季振威,等.组织修复中血管内皮生长因子作用及应用的研究进展[J].同济大学学报,2003,24(4):285-288.
[10]李树岩,李淑梅,董明慧,等.VEGF基因转染同种异体骨髓间充质干细胞治疗心肌梗死的实验研究[J].中国老年学杂志,2007,27(7):622-625.
EffectsofcellularrepressorofE1A-stimulatedgenesonVEGFreleaseandmonolayerpermeabilityofhumanvascularendothelialcells
WANG Zhan-sheng2, HAN Ya-ling1, KANG Jian1, ZHANG Xiao-lin1, TAO Jie1, TIAN Xiao-xiang1, YAN Cheng-hui1
(1DepartmentofCardiology,GeneralHospitalofShenyangCommandofPLA,Shenyang110016,China;2DalianMedicalUniversity,Dalian116044,China.E-mail:wzs20700079@163.com)
AIM: To study the effects and mechanism of cellular repressor of E1A-stimulated genes (CREG) on VEGF release and monolayer permeability of human vascular endothelial cells (ECs).METHODSThe monolayer permeability of ECs was measured by transwell chamber model. The expression and localization of F-actin and VE-cadherin were examined by immunofluroscence using Olympus IX-70 fluorescent microscope. Enzyme-linked immunosorbent assay (ELISA) were performed to determine the concentration of vascular endothelial growth factors(VEGF) in the culture medium. VEGF neutrilization antibody was used to block the expression of VEGF in the cells.RESULTSThe monolayer permeability of CREG over-expressing ECs (EO group) was significantly higher than that of the normal control ECs (EN group,P<0.05). The monolayer permeability of CREG suppressing ECs (ES group) was lower than that in EN group (P<0.05). F-actin cytoskeleton in EO group showed disorganized, polymerized and bundled obviously to form large quantity of stress fibers in the central portion of the cells, whereas F-actin in EO group was mainly observed in the peripheral portion of the cells and only small amounts in the central portion of the cells. A widespread gap formation and a loss of VE-cadherin staining at the periphery were found in the cells of EO group. Inversely, the cells in ES group showed the localization of VE-cadherin at the cell-cell contacts tightly and the formation of zipper-like structures. Compared with EN group, the secretion of VEGF in the cell culture supernatants increased in EO group, but decreased in ES group (P<0.05). Furthermore, the changes of ECs permeability, cytoskeleton reorganization and loss of VE-cadherin induced by CREG were abolished by the addition of anti-VEGF neutralizing antibody.CONCLUSIONCREG over-expression increases the monolayer permeability of ECs, induces the cytoskeleton reorganization and reduces VE-cadherin expression by enhancing the secretion of VEGFinvitro.
Cellular repressor of E1A-stimulated genese; Vascular endothelial cells; VE-cadherin; Cytoskeleton; Permeability; Vascular endothelial growth factor
R363
A
10.3969/j.issn.1000-4718.2011.01.007
1000-4718(2011)01-0037-05
2010-04-13
2010-09-03
国家自然科学基金资助项目(No.30770793; No.30971218; No.30800465)
△通讯作者Tel:024-23056183; E-mail: wzs20700079@163.com

