HPLC法测定银州柴胡中五种皂苷的含量
符 颖,朱占军,黄 帅,斯建勇,魏建和,潘瑞乐
中国医学科学院北京协和医学院药用植物研究所,北京100193
HPLC法测定银州柴胡中五种皂苷的含量
符 颖,朱占军,黄 帅,斯建勇,魏建和,潘瑞乐*
中国医学科学院北京协和医学院药用植物研究所,北京100193
首次建立HPLC法同时测定银州柴胡中柴胡皂苷a、c、d、e和f五种皂苷含量的方法。流动相为乙腈-水梯度洗脱,柱子为Hibar·RT RP-18(4.6 mm×250 mm,5 μm),流速1.0 mL/min,柱温30℃,检测波长210 nm。柴胡皂苷a、c、d、e和f的线性范围及相关系数分别为:21.78~43.56 μg(r=0.9993),3.94~9.85 μg(r=0.9994),20.68~51.70 μg(r=0.9998),1.67~5.57 μg(r=0.9997),1.91~6.70 μg(r=0.9992);柴胡皂苷a、d的加样回收率分别为101.5%和98.5%。该方法操作简便,结果准确,重现性好,为柴胡药材多指标质量分析方法的建立和银州柴胡药用提供了参考依据。
HPLC;银州柴胡;柴胡皂苷a;柴胡皂苷c;柴胡皂苷d;柴胡皂苷e;柴胡皂苷f
柴胡是一味疗效显著的常用中药,具有疏肝解郁、升提中气之功能,主治感冒发热、寒热往来、胸胁腹痛、黄疸肝炎及月经不调等。《中国药典》(2005年版一部)收载柴胡原植物为伞形科植物北柴胡Bupleurum chinense DC和狭叶柴胡B.scorzonerifolium Willd.的干燥根[1]。由于柴胡临床用量大,而且主要依靠采挖野生资源,因此,随着北柴胡和南柴胡资源的减少,该属多种植物在产地当柴胡药用,造成商品来源十分混杂,质量难以控制。现代研究表明柴胡皂苷是柴胡的主要有效成分,具有解热、抗炎、抗肿瘤、免疫调节等多种作用,目前多以柴胡皂苷a、柴胡皂苷d的含量作为柴胡质量控制的指标,但不同品种柴胡所含的柴胡皂苷a、d有很大差别,有些甚至检测不出[2-10]。因此,建立科学客观反映柴胡质量的评价标准已成为当前柴胡研究的热点,其中多指标分析方法是主要的研究模式。
银州柴胡B.yinchowense Shan et Y.Li广泛分布于甘肃、青海等西北省区,是当地柴胡的主流品种,但银州柴胡的化学成分和质量分析未见报道。本文采用从银洲柴胡中分离得到的5个柴胡皂苷单体作为对照品,对甘肃产10批银州柴胡含量进行测定,为柴胡多指标质量分析方法的建立和银州柴胡药用提供了参考依据。
1 实验方法
1.1 仪器与试剂
Waters系列高效液相色谱仪,Waters 600 controller,Waters 600 pump,Waters 2487 dual absorbance detector,Waters Empower工作站。电子分析天平(上海天平仪器厂),KQ5200B型超声波清洗器(昆山市超声仪器有限公司),乙睛、甲醇为色谱纯(Fisher公司)。Wahaha纯净水(市售),提取用甲醇为分析纯(北京化工厂)。
柴胡皂苷a和柴胡皂苷d对照品均由中国药品生物制品检定所提供(批号分别为:110777-200406和110778-200505),柴胡皂苷c、e和f为本实验室自制,经IR、MS和NMR等光谱鉴定结构,HPLC纯度检测均大于98%。银州柴胡样品从甘肃不同产地收集,经作者鉴定为植物银州柴胡B.yinchowense的干燥根。
1.2 色谱条件
色谱柱:Hibar·RT RP-18(4.6 mm×250 mm,5 μm);保护柱:SecurityGuard(美国 Phenomenex公司);流动相:乙腈-水梯度洗脱,洗脱程序见表1 (Table 1);流速:1.0 mL/min;柱温:30℃;检测波长:210 nm;进样量:20 μL。在此条件下,五种柴胡皂苷分离良好。
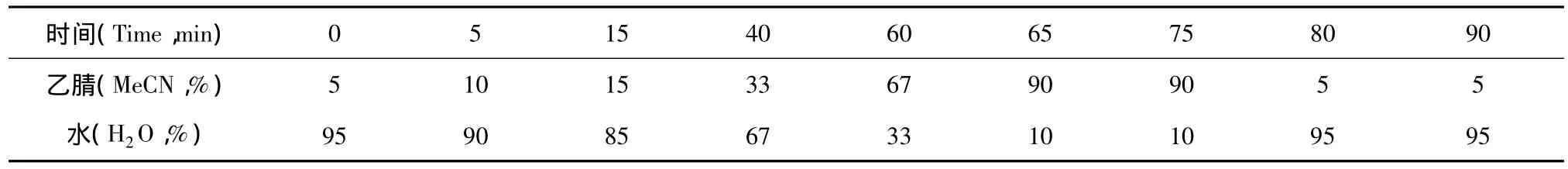
表1 乙腈-水洗脱梯度表Table 1 Elution program
1.3 对照品溶液制备
精密称定柴胡皂苷 a 21.78 mg、柴胡皂苷 c 10.37 mg、柴胡皂苷d 20.68 mg、柴胡皂苷e 5.99 mg和柴胡皂苷f 10.19 mg,分别置于2 mL容量瓶中,用色谱甲醇定容得对照品原液。分别吸取不同体积的对照品原液于1 mL容量瓶中,用色谱甲醇稀释定容,即得系列混合对照品稀释溶液,其中柴胡皂苷 a的浓度依次为 1.089,1.361,1.633,1.905,2.178 mg/mL,柴胡皂苷c为0.197,0.271,0.345,0.419,0.493 mg/mL,柴胡皂苷d为1.034,1.422,1.810,2.198,2.585 mg/mL,柴胡皂苷e为0.0835,0.132,0.181,0.230,0.279 mg/mL,柴胡皂苷f为0.0955,0.155,0.215,0.275,0.335 mg/mL。
1.4 供试品溶液制备
取柴胡药材粉末(40目)约1 g,精密称定,置100 mL三角瓶中,精确加入5%氨水甲醇溶液50 mL,密闭,于30℃水温超声提取0.5 h,过滤,滤渣用甲醇润洗两次,每次10 mL,合并滤液,回收至干,残渣用色谱甲醇定容于5 mL容量瓶,摇匀,微孔滤膜过滤(0.45 μm),弃初滤液,取续滤液,即得供试品溶液。
1.5 测定方法
分别精密吸取对照品稀释溶液和供试品溶液各20 μL,注入液相色谱仪,记录90 min的色谱图,外标法定量。
2 结果与讨论
2.1 检测波长选择
柴胡皂苷类成分无紫外吸收,仅在末端203 nm处有最大吸收波长,但在该波长基线噪音大,梯度洗脱时基线漂移严重,若选择210 nm作为检测波长,乙腈-水系统作为流动相,基线噪音和漂移均较小,且色谱图与203 nm比较无显著差别,因此,选择210 nm为检测波长。
2.2 样品制备方法的确定
由于柴胡皂苷a、d在提取过程中受酚类或酸性成分的影响,易使环氧醚键开环,转化为柴胡皂苷b1、b2,因而通常采用弱碱性溶剂提取原生柴胡皂苷a、c、d。本研究考察了甲醇、30%甲醇、60%甲醇作为提取溶剂(三种提取溶剂中均加入5%氨水),HPLC测定结果表明五种皂苷含量无显著性差异,但用30%甲醇和60%甲醇提取时杂质过多,定容困难,并且对色谱柱损害大,故选5%氨水甲醇作为提取溶剂。
以5%氨水甲醇为提取溶剂,考察了加热回流提取1 h、30℃水温超声提取0.5 h和1 h三种提取方法,HPLC测定结果表明五种皂苷含量无明显差异,故选用30℃水温超声提取0.5 h作为提取方法。
2.3 方法学考察
2.3.1 稳定性考察
精密吸取同一供试品溶液20 μL,分别于0、1、2、4、8、12、24 h进样,记录HPLC色谱图,柴胡皂苷a、柴胡皂苷c、柴胡皂苷d、柴胡皂苷e和柴胡皂苷f的色谱峰的相对峰面积RSD值分别为1.24%、1.19%、1.05%、1.29%、1.34%,均小于2%,表明样品在24 h内稳定性良好。
2.3.2 精密度考察
精密吸取同一供试品溶液20 μL,连续重复进样6次,记录五种柴胡皂苷的峰面积,其RSD值分别为0.82%、0.57%、0.71%、0.68%、0.92%,表明仪器的精密度良好。
2.3.3 线性关系考察
精密吸取对照品稀释溶液20 μL注入HPLC仪,记录峰面积,以对照品质量为横坐标,峰面积值为纵坐标,绘制标准曲线,其回归方程分别为:

结果表明柴胡皂苷a在21.78~43.56 μg,柴胡皂苷c在3.94~9.85 μg,柴胡皂苷d在20.68~51.70 μg,柴胡皂苷e在1.67~5.57 μg,柴胡皂苷f在1.91~6.70 μg范围内对照品含量与峰面积呈良好的线性关系。
2.3.4 重复性考察
取同一样品5份,按供试品溶液制备方法,处理样品,记录色谱图,各主要色谱峰的相对峰面积RSD分别为:2.94%、2.89%、2.87%、3.51%、3.95%,方法重复性良好。
2.3.5 回收率试验
精密称取已知含量的柴胡样品共6份,每份0.25 g,分别加入柴胡皂苷a和柴胡皂苷d对照品原液各100 μL,按供试品溶液制备方法处理,测定柴胡皂苷a和柴胡皂苷d的含量,计算二者平均回收率分别为101.5%(RSD为2.33%)和98.5% (RSD为2.56%)。由于柴胡皂苷c、e、f对照品量比较少,未进行回收率试验研究。
2.4 样品测定
根据测定方法对10批银州柴胡进行含量测定,对照品及样品的色谱图见附图1及图2,测定结果见Table 2(SSa、SSb、SSc、SSe及SSf分别为柴胡皂苷a、b、c、e和f)。



表2 银州柴胡中五种柴胡皂苷的含量(%)Table 2 The contents of five saponins in root of B.yinchowense
3 结论
首次建立了HPLC法同时测定五种柴胡皂苷含量的分析方法,并用该方法对10批银州柴胡中五种皂苷的含量进行了测定,结果表明银州柴胡中柴胡皂苷a、c和d的含量较高,而柴胡皂苷e和f的含量较低。本研究为建立柴胡药材多指标质量分析方法及银州柴胡药用提供了参考依据。
从表2中可知银州柴胡中柴胡皂苷a、c、和d的含量之和为1.40%~2.01%,与文献[8]报道的不同产地北柴胡中这三种皂苷的含量之和接近。从柴胡皂苷a、c和d含量这一指标,银州柴胡与北柴胡相似,但银州柴胡能否作为法定药材,尚需对其药效、毒性等多学科综合研究。
1 The Pharmacopoeia Committee of People’s Republic of China.Pharmacopoeia of People’s Republic China,Part I,Beijing:Chemical Industry Press(国家药典委员会.中华人民共和国药典,一部).Beijing:Chemical Industry Press,2005.198.
2 Zhang HN(张宏娜),Zhao YY(赵玉英),Liang H(梁鸿),et al.Simultaneous HPLC-ELSD determination of saikosaponins a,c,d,f in Radix Bupleuri.Chin J Pharm Anal(药物分析杂志),2007,27:1150.
3 Xiong MX(熊梦晓),Huang BS(黄必胜),Bai Y(白杨),et al.Determination of Saikosaponin a,d in Bupleurum by RPHPLC.Res Pract Chin Med(现代中药研究与实践),2007, 22(2):42.
4 Pan RL(潘瑞乐),Chen DH(陈迪华),Chen JM(陈建明),et al.Determination of saikosaponin a and d in Radix Buplerui by RP-HPLC.Central South Pharm(中南药学),2004,2:199-200.
5 Ma MC(麻明臣),Liu J(刘娟),Chen YF(陈宇峰),et al.Quantitative analysis of saikosaponin a in wild Bupleurum by HPLC,YaoWuYanJiu(药物研究),2008,17(12):33.
6 Yu J(余菁),Liang WQ(梁卫青).Determination of saikosaponin a and d in radix Buplerui from different areas by HPLC.J Zhejiang Univ Tradit Chin Med(浙江中医药大学学报),2007,31:374:375.
7 Song HG(宋宏刚),Xu HH(许红辉),Pei CY(裴彩云),et al.Determination of saikosaponin a and d in Radix Buplerui by HPLC-ELSD.Lishizhen Med Mater Med Res(时珍国医国药),2006,17:1964-1964.
8Lin DH(林东昊),Mao RG(茅仁刚),Wang ZH(王智华),et al.Determination of Saikosaponin a,c,d in Bupleurum Chinese DC.from different areas by HPLC.Chin Tradit Patent Med(中成药),2002,24:382-384.
9Mao RG(茅仁刚),Lin DH(林东昊),Wang ZH(王智华),et al.Quantitative analysis of saikosaponin a,c,d in different species of Radix Buplerui by HPLC.Chin Tradit Herb Drugs(中草药),2002,33:412-414.
10 Wang GZ(王光忠),Li QY(李秋怡),Zhang LP(张莲萍),et al.Determination of Saikosaponin a,d in Radix buplerui by HPLC-ELSD.Lishizhen Med Mater Med Res(时珍国医国药),2006,17:1721-1722.
Determination of five saikosaponins in Bupleurum yinchowense by HPLC
FU Ying,ZHU Zhan-jun,HUANG Shuai,SI Jian-yong,WEI Jian-he,PAN Rui-le*
Institute of Medicinal Plant development,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100193,China
A method was established for determining five saikosaponins simultaneously,including saikosaponins a,c,d,e and f in the root of Bupleurum yinchowense by HPLC for the first time.Separation was achieved by A Hibar·RT C18 column(250 mm×4.6 mm,5 μm)using acetonitrile and water as the mobile phase with gradient elution at the f1ow rate of 1.0 mL/min,column temperature at 30℃ and the wavelength of UV detection was 210 nm.There were good linear correlations between the studied concentrations of the five saikosaponins and their chromatographic peak areas,and the correlation coefficients were 0.9992-0.9998.The recoveries of saikosaponins a and d were 101.5 and 98.5%,respectively.The RSD of precision and accuracy was less than 3%.This method is simple,accurate and reproducible,and also provides a reference for establishing the multiple-value quality control method for Radix Buplerui and the use of B.yinchowense as a medicine.
HPLC;Bupleurum yinchowense;saikosaponin a;saikosaponin c;saikosaponin d;saikosaponin e;saikosaponinf
1001-6880(2011)03-0494-04
2009-10-12 接受日期:2010-02-04
创新药物研究开发技术平台建设(2009ZX09301-003)
*通讯作者 Tel:86-10-57833286;E-mail:rlpan@implad.ac.cn
R284.2
A

