蛋白酶在乙醇溶液中的性质及构象*
刘玉芳,王淼
(江南大学食品学院江苏 无锡,214122)
蛋白酶在乙醇溶液中的性质及构象*
刘玉芳,王淼
(江南大学食品学院江苏 无锡,214122)
对碱性蛋白酶和木瓜蛋白酶在乙醇溶液中的性质和构象进行了研究。研究结果表明,在乙醇溶液中,碱性蛋白酶和木瓜蛋白酶催化反应的最适温度有不同程度下降,下降幅度为5~10℃;它们的最适pH与在缓冲液体系中相差不大。2种蛋白酶在醇溶液中的稳定性随着乙醇浓度的升高而下降,特别是当乙醇浓度上升至60%,2种蛋白酶的稳定性均迅速下降。在相同的乙醇浓度下,木瓜蛋白酶的稳定性比碱性蛋白酶高。当乙醇浓度为60%时,木瓜蛋白酶的半衰期是碱性蛋白酶的21倍。圆二色谱研究表明,在乙醇溶液中碱性蛋白酶和木瓜蛋白酶的二级结构均发生了明显变化,荧光光谱表明,在乙醇溶液中2种蛋白酶的荧光强度均有明显减弱,表明它们的三级结构均发生明显变化。
碱性蛋白酶,木瓜蛋白酶,酶学性质,圆二色谱,荧光光谱
植物蛋白中有很多水不溶而醇溶的蛋白质,开发利用这些蛋白质,需要研究蛋白酶在醇溶体系中的性质和应用。例如,小麦蛋白主要包括醇溶蛋白和谷蛋白,醇溶蛋白约占蛋白总量的49%,多由非极性氨基酸组成多肽链,富含谷氨酸(主要以谷氨酰胺的形式存在),占总蛋白含量的40% ~69%[1]。
碱性蛋白酶主要用于洗涤剂行业,在食品工业也有广泛的应用,它是一种内切酶,适宜在50~55℃、pH9~11的碱性条件下使用[2]。木瓜蛋白酶属巯基蛋白酶,具有较宽的底物特异性的内肽酶,主要由富含α-螺旋的10~111、208~212位氨基酸残基的L-区和富含β-折叠的1~9、112~207位氨基酸残基的R-区组成[3],最适 pH 值 5.7 ~6.0,最适温度 55 ~60℃[4]。
国内外对蛋白酶在乙醇溶液中的研究主要集中在酶的构象分析,对于蛋白酶在乙醇溶液中的性质,以及结构与性质之间的关系研究较少[5]。本文以碱性蛋白酶和木瓜蛋白酶这2种应用较广泛的蛋白酶作为研究对象,系统研究了蛋白酶在醇溶体系中的性质及结构,为醇溶蛋白及蛋白酶在醇溶体系中的开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
碱性蛋白酶,美国Sigma公司;木瓜蛋白酶,南宁庞博生物技术有限公司;福林酚试剂,上海荔达生物科技有限公司;其余试剂均为色谱纯或分析纯。
1.2 主要仪器
V-1800型可见分光光度计,上海美谱达仪器有限公司;旋转蒸发仪 RV-10,德国 IKA集团;F-7000荧光光谱仪,日本日立公司;MOS-450 AF-CD圆二色光谱仪,法国Bio-logic公司。
1.3 主要方法
1.3.1 蛋白酶活力的测定
采用福林酚法[6]。1个酶活力单位为在特定的条件下(温度可采用25℃或其它适用温度、pH等条件),每分钟催化1 mol底物转化为产物的酶量。
1.3.2 最适温度和最适pH
取蛋白酶于35~70℃,30%和50%的乙醇溶液中,以麦醇溶蛋白为底物测定其剩余蛋白酶活力,确定最适温度和最适pH。
1.3.3 蛋白酶在乙醇溶液中的稳定性
将蛋白酶加入不同浓度、pH乙醇溶液中,置于40~60℃的恒温水浴中,隔一段时间取出酶液,以酪蛋白为底物在水溶液中测定其剩余酶活力。
1.3.4 蛋白酶在乙醇溶液中的失活动力学[7]
将蛋白酶加入30%、40%、50%、60%乙醇溶液,在恒温放置一定时间,每隔一定时间取出部分酶液,测定剩余酶活。
根据Arrhenius方程(lnA=-kt和lnK=lnK0-(Eo/Rt)计算失活动力学参数。其中A是酶活,U/g;T是绝对温度,K;E0是活化能,t1/2是半衰期,min;t是保温时间,min;R是气体常数,8.314 510J/(K·mol);k是速率常数,1/min。
1.3.5 乙醇溶液中蛋白酶的构象测定
圆二色光谱:取蛋白酶溶于50%乙醇溶液中,分别于常温(25℃)和低温(4℃)放置24 h。测定远紫外区(190~250 nm)CD谱,扫描速度1 nm/s,重复5次。圆二色谱用平均椭圆度[θ]表示,单位为deg·cm2/dmol[8]。
荧光光谱检测:样品处理方式同圆二色光谱检测。荧光扫描采用F-7000 FL型分光光度计,激发波长为280 nm,发射波长为 290 ~450 nm[9]。
2 结果与讨论
2.1 蛋白酶在乙醇溶液中的最适温度
由于反应体系的改变会影响酶的催化性质,为此,本研究首先对2种蛋白酶在醇体系中的最适温度进行了研究。研究结果见图1和图2。
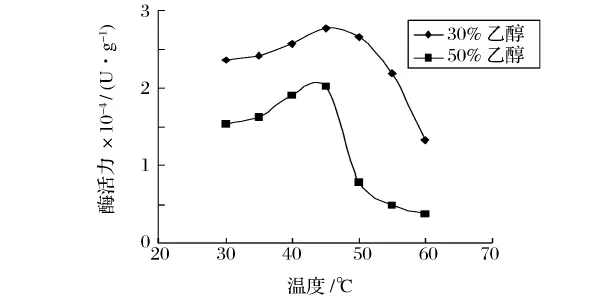
图1 碱性蛋白酶在乙醇溶液中的最适温度
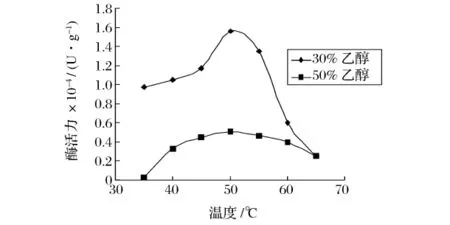
图2 木瓜蛋白酶在乙醇溶液中的最适温度
从图1可以看出,碱性蛋白酶在乙醇溶液中最适温度为45℃,而它在水溶液中的最适温度是50~55℃。从图2可以看出,木瓜蛋白酶在乙醇溶液中的最适温度下降至50℃,比其在水溶液中的最适温度(55~60℃)下降了5~10℃。随着温度的升高,一方面反应速度会加快,但另一方面酶蛋白容易变性,特别是在醇溶液中。在这2种因素的共同作用下,蛋白酶的最适温度下降5~10℃。
2.2 蛋白酶在乙醇溶液中的最适pH
碱性蛋白酶和木瓜蛋白酶在水溶液中的最适pH是9.0~11.0和5.7~6.0。它们在醇溶液中的最适pH见图3和图4。
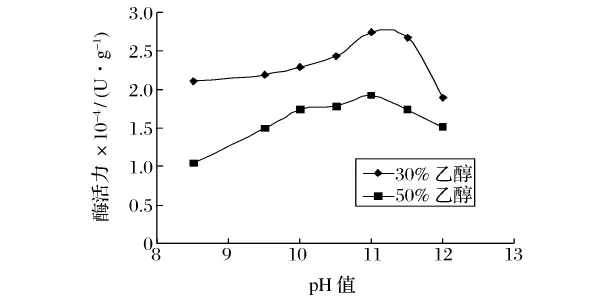
图3 碱性蛋白酶在乙醇溶液中的最适pH值
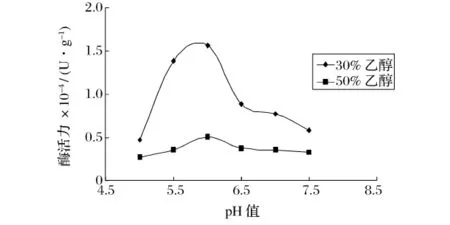
图4 木瓜蛋白酶在乙醇溶液中的最适pH值
可以看出,在30%和50%的乙醇溶液中,碱性蛋白酶的最适pH为11.0左右;木瓜蛋白酶的最适pH为6.0左右,这与它们在水溶液中的最适pH相差不大。
2.3 蛋白酶在乙醇溶液中的稳定性
2.3.1 温度对蛋白酶在乙醇溶液中稳定性的影响
图5和图6是不同温度下碱性蛋白酶和木瓜蛋白酶在30%乙醇溶液中剩余酶活随时间的变化的曲线。
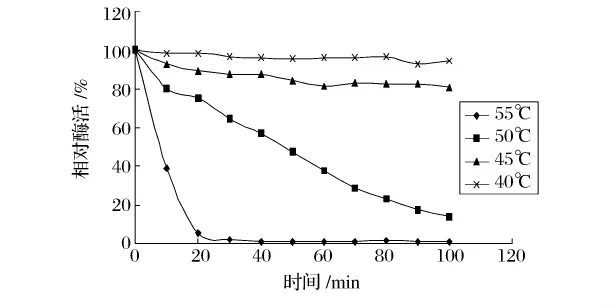
图5 碱性蛋白酶在30%乙醇溶液中的热稳定性
从图5可以看出,碱性蛋白酶在30%乙醇溶液中40℃下保温100 min活力几乎没有损失。随着温度升高,碱性蛋白酶的稳定性下降。在温度升高到55℃时,碱性蛋白酶稳定性迅速下降,在30 min后活力几乎降至0。而木瓜蛋白酶在30%乙醇溶液中50℃保温10h后的活力下降了19%。在这一条件下,木瓜蛋白酶的剩余酶活随时间的变化程度最小(见图6),表明木瓜蛋白酶在这种条件下稳定性较高。由此可以看出,在30%乙醇浓度中,与碱性蛋白酶相比,木瓜蛋白酶较耐高温。
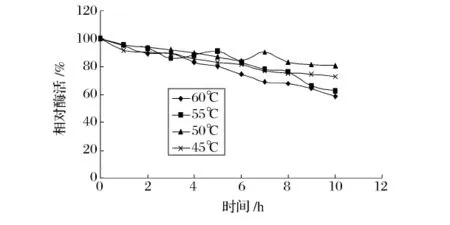
图6 木瓜蛋白酶在30%乙醇溶液中的热稳定性
2.3.2 醇浓度对蛋白酶在乙醇溶液中稳定性的影响
从图7和图8可以看出,碱性蛋白酶和木瓜蛋白酶在乙醇溶液中的稳定性随醇浓度的升高而降低。碱性蛋白酶在乙醇浓度为30%,40%,50%,60%条件下保温 100 min后,酶活分别降低了 5.44%,16.32%,25.57%和92.24%。而木瓜蛋白酶在乙醇浓度为30%,40%,50%,60%条件下预热10h后,酶活分别降低了26.86%,29.04%,26.16%,49.54%。尤其当乙醇浓度达到60%时,碱性蛋白酶保温100 min后,活力仅剩7%;在相同的乙醇浓度下,木瓜蛋白酶保温10h后,活力还剩50%左右。
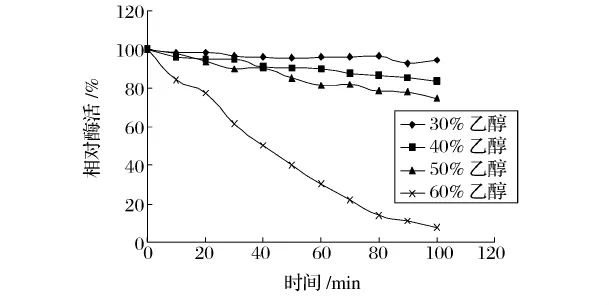
图7 碱性蛋白酶在不同浓度乙醇溶液中的稳定性
2.3.3 pH值对蛋白酶在乙醇溶液中稳定性的影响
图9和图10表示在不同的pH下碱性蛋白酶和木瓜蛋白酶在30%乙醇浓度下酶活力随时间的变化曲线。从图9可以看出,碱性蛋白酶在 pH9.5的30%乙醇溶液中稳定性较好,恒温10 h后,酶活是初始酶活的89.1%。从图10可以看出,pH 6.5时,木瓜蛋白酶保温10h后,酶活力下降了11%;当pH上升至9.5时,酶活在4h内迅速下降至1.8%。这些结果表明木瓜蛋白酶在酸性和中性条件下稳定性较好。在适宜的条件下,pH对2种蛋白酶在乙醇溶液中稳定性的影响较小。
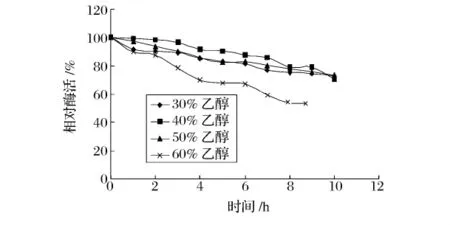
图8 木瓜蛋白酶在不同浓度乙醇溶液中的稳定性
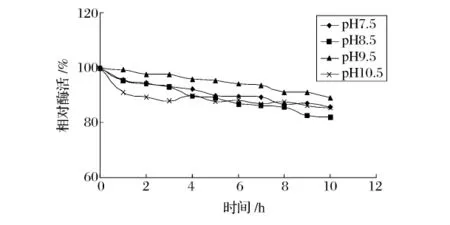
图9 碱性蛋白酶在30%乙醇溶液中的pH稳定性
2.4 蛋白酶在乙醇溶液中的失活动力学
为了进一步研究不同浓度的乙醇溶液对蛋白酶的失活作用,本实验研究了30%,40%,50%,60%乙醇溶液中蛋白酶的失活动力学,失活动力学曲线如图11和图12。
蛋白酶在乙醇溶液中的失活动力学研究表明(图11和图12),蛋白酶的失活属于一级动力学(R2>0.98),可根据Arrhenius方程计算失活动力学参数,见表1和表2。
从图11可以看出,碱性蛋白酶在30%、40%、50%乙醇溶液中的酶活力比较稳定,当乙醇浓度上升至60%时,碱性蛋白酶失活现象较明显。表1可以看出,随着乙醇浓度的上升,失活速率常数不断升高,活化能E0不断下降,半衰期不断减小。当醇浓度上升至60%时,失活速率常数比30%时升高了32倍,活化能比30%时降低了9 014 J,半衰期从30%的862.50 min急剧降低至41.50 min。
从图12、表2可以看出,木瓜蛋白酶在30%、40%、50%乙醇溶液中较稳定,失活速率常数k大致相等,活化能和半衰期也相差不大;乙醇浓度上升至60%时,失活速率常数上升至0.001 2,活化能和半衰期都有明显的下降趋势。在30%乙醇浓度下,木瓜蛋白酶的半衰期是碱性蛋白酶的2倍;当乙醇浓度上升至60%时,木瓜蛋白酶的半衰期是碱性蛋白酶的21倍。
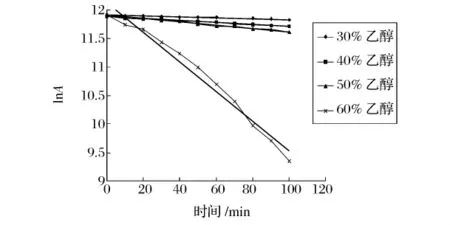
图11 碱性蛋白酶在乙醇溶液中失活动力学曲线
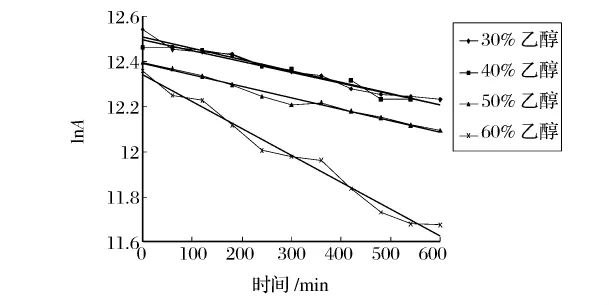
图12 木瓜蛋白酶在乙醇溶液中失活动力学曲线
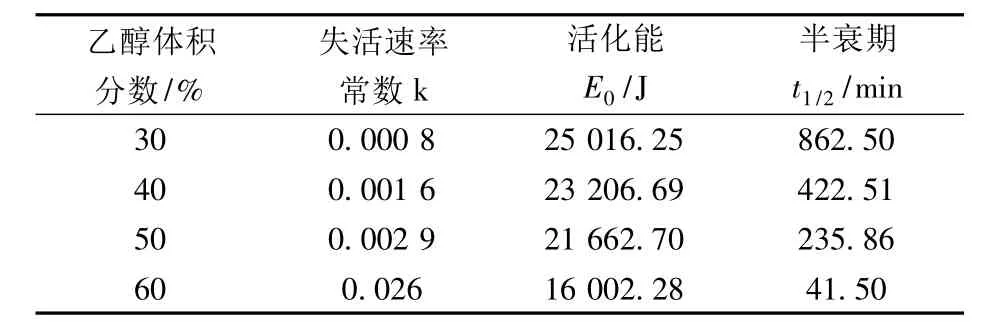
表1 碱性蛋白酶在乙醇溶液中的失活动力学参数
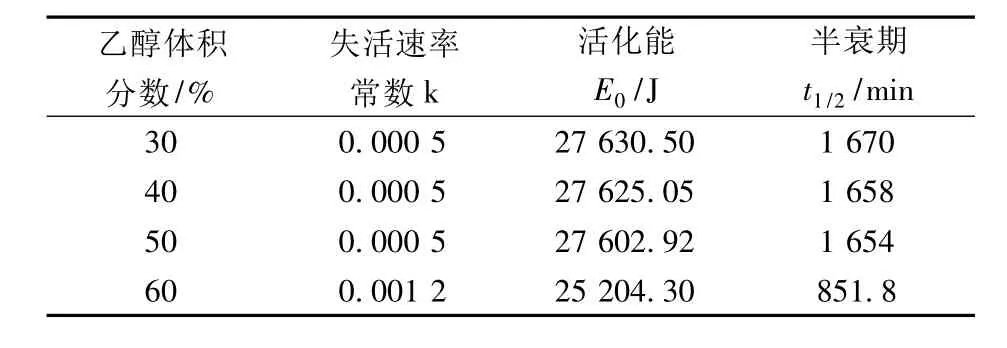
表2 木瓜蛋白酶在乙醇溶液中的失活动力学参数
2.5 乙醇溶液中蛋白酶的构象
为了研究蛋白酶在乙醇溶液中的构象,以及构象与性质之间的关系,本研究采用圆二色光谱法和荧光光谱法考察蛋白酶在乙醇溶液中的二级和三级结构。一般蛋白质的圆二色光谱远紫外区的负槽(205~235 nm波长范围)形状与主链构象密切相关,典型的α-螺旋在209 nm和222 nm左右有2个负槽;β-折叠在215 nm处有1个负槽[10]。从图13和图14可以看出,乙醇对蛋白酶的二级结构有较大影响。在50%的乙醇溶液中碱性蛋白酶和木瓜蛋白酶的α-螺旋含量明显减少。但温度和酶在醇溶液中保存的时间对其构象的影响较小。荧光光谱主要是由蛋白质的内源性荧光基团Trp和Tyr残基发射的,它反映蛋白质分子在溶液中的三级结构。Trp和Tyr荧光峰位(λmax)分别是 348 nm 和 303 nm[11]。荧光光谱的变化主要取决于生色基团的微环境、空间配置关系所引起的能量转移、解离状态和介质的变化[5]。从图15和图16可以看出,在不同的温度和时间下,碱性蛋白酶的荧光光谱在乙醇溶液中发生了不同程度的红移,荧光强度均减小,说明在极性的乙醇溶液中Trp残基趋向蛋白质分子表面,而Tyr残基被掩蔽到分子内部。木瓜蛋白酶的最大荧光强度从348 nm左右蓝移至338 nm左右,说明在极性的乙醇溶液中Trp残基趋向蛋白质分子内部。
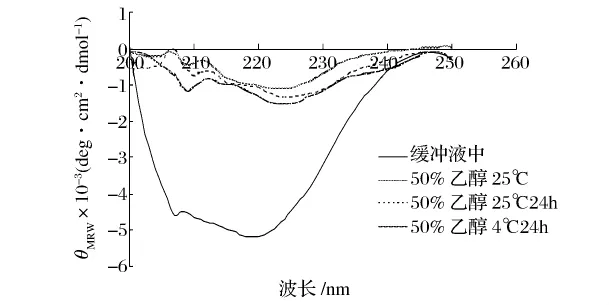
图13 碱性蛋白酶在乙醇溶液中的圆二色谱图
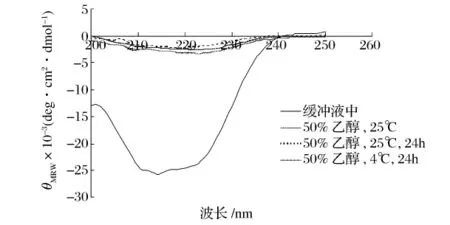
图14 木瓜蛋白酶在乙醇溶液中的圆二色谱图
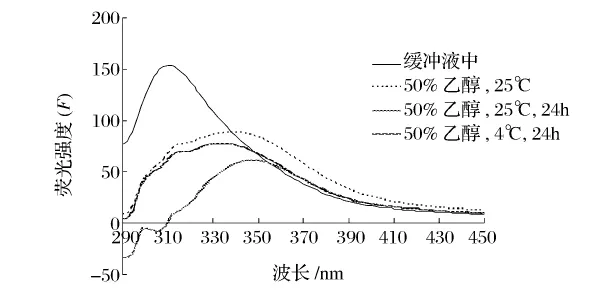
图15 碱性蛋白酶在乙醇溶液中的荧光光谱图
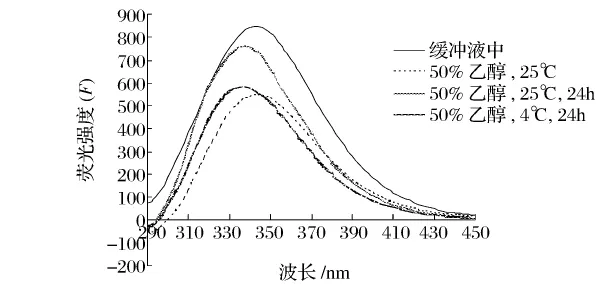
图16 木瓜蛋白酶在乙醇溶液中的荧光光谱图
3 结论
(1)在乙醇溶液中,碱性蛋白酶和木瓜蛋白酶催化反应的最适温度有不同程度下降,下降幅度为5~10℃;它们的最适pH与在缓冲液体系中相差不大。
(2)2种蛋白酶的稳定性随着乙醇浓度的升高而下降,尤其是当乙醇浓度上升至60%,碱性蛋白酶和木瓜蛋白酶的稳定性迅速下降。在相同的乙醇浓度下,木瓜蛋白酶的稳定性比碱性蛋白酶高。当乙醇浓度为60%时,木瓜蛋白酶的半衰期是碱性蛋白酶的21倍。
(3)圆二色谱研究表明,在乙醇溶液中碱性蛋白酶和木瓜蛋白酶的二级结构均发生了明显变化。荧光光谱表明,碱性蛋白酶在乙醇溶液中发生了明显的红移,而木瓜蛋白酶发生了不同程度的蓝移,荧光强度均有明显减弱,表明两种蛋白酶在乙醇溶液中三级结构发生了明显变化。
[1] 孙少敏.小麦醇溶蛋白溶液的流变特性研究[J].食品科学,2007,28(3):34 -37.
[2] 夏凡,琚争艳.微生物碱性蛋白酶在食品工业中的应用及其安全性研究进展[J].山东食品发酵,2008(2):19-22.
[3] Andr'as Szab'o et al.Spectroscopic studies of stability of papain in aqueous organic solvents[J].Journal of Molecular Catalysis B:Enzymatic,2006,41:43-48.
[4] 熊华.木瓜蛋白酶的应用研究进展[J].四川食品与发酵,2005(4):9-11.
[5] 初志战,黄卓烈,巫光宏,等.乙醇溶液对木瓜蛋白酶催化活性的影响[J].热带亚热带植物学报,2005,13(14):329-312.
[6] 张学英.蛋白酶及其活力的测定[J].酿酒,2008,35(6):100-102.
[7] 陈群,颜思旭,陈瑶琪.中华猕猴桃蛋白酶热失活动力学[J].厦门大学学报,1990,29(1):89 -93.
[8] Hasige A Sathish.The differential stability of the left and right domains of papain[J].Process Biochemistry,2009,44:710-716.
[9] Dilek Coskuner Ozturk.Water miscible mono alcohols effect on the structural conformation of Bacillus clausii GMBAE 42 serine alkaline protease[J].Journal of Molecular Catalysis B:Enzymatic,2010,64:184 -188.
[10] 陶慰孙,李惟,姜涌明.蛋白质分子基础[M].第二版.北京:高等教育出版社,1995:227-230.
[11] Chamani J.Mechanism for stabilization of the molten globule state of papain by sodiumn-alkyl sulfates:Spectroscopic and calorimetric approaches[J].Journal of Colloid and Interface Science,2008,322:119-127.
[12] Soumen Ghosh.Physicochemical and conformational studies of papain/sodium dodecyl sulfate system in aqueous medium[J].Colloids and Surfaces A:Physicochem Eng Aspects,2005(264):6-16.
[13] 陈清西,严思旭.果菠萝蛋白酶在有机溶剂微扰时的分子折叠与活力变化的研究[J].高等学校化学学报,1993,14(3):424 -427.
[14] 陈清西.果菠萝蛋白酶在有机溶剂中的变性和失活动力学的研究[J].厦门大学学报,1993,32(1):88-93.
[15] 杨伟东.黑曲霉产β-甘露聚糖酶的纯化及酶学性质研究[J].安徽农业科学,2009,37(20):9 366-9 374.
The Properties and Conformation of Proteases in Ethanol Solution
Liu Yu-fang,Wang Miao
(The School of Food Science and Technology(SFST) ,Jiangnan University,Wuxi 214122,China)
The properties and conformation of alkaline protease and papain in ethanol solutions were researched.The results showed that the optimum temperature of alkaline protease and papain in ethanol solutions were reduced with the increase of ethanol concentration.The range of temperature descent was 5~10℃.The optimum pH in ethanol solutions had little difference comparing with buffer solution.With the increase of ethanol concentration,the stability of alkaline protease and papain were affected.Especially,when the concentration of ethanol solutions was up to 60%,the stability of alkaline protease and papain decreased rapidly.The stability of papain was higher than alkaline protease in the same ethanol concentration and the half-life of papain was 21 times of alkaline protease in 60%ethanol.The Circular dichroism spectra of the protease in ethanol solutions showed that the secondary structure of alkaline protease and papain were altered seriously.The Fluorescence spectra of the protease ethanol solution indicated that the fluorescence intensity of alkaline protease and papain in ethanol solutions were both weakened.These results confirmed that in ethanol solution the tertiary structure of those protease were changed obviously.
Alkaline protease ,papain,enzymatic properties,circular dichroism spectra,fluorescence spectra

