乳酸菌中幽门螺杆菌 ureB基因的食品级表达与优化*
陈帅印,张荣光,范清堂,段广才#
1)郑州大学公共卫生学院流行病学教研室;河南省分子医学重点实验室郑州 450001 2)郑州大学基础医学院寄生虫学教研室郑州 450001
#通讯作者,男,1958年 8月生,博士,教授,研究方向:分子流行病学,E-mail:gcduan@public2.zz.ha.cn
乳酸菌中幽门螺杆菌 ureB基因的食品级表达与优化*
陈帅印1),张荣光2),范清堂1),段广才1)#
1)郑州大学公共卫生学院流行病学教研室;河南省分子医学重点实验室郑州 450001 2)郑州大学基础医学院寄生虫学教研室郑州 450001
#通讯作者,男,1958年 8月生,博士,教授,研究方向:分子流行病学,E-mail:gcduan@public2.zz.ha.cn
幽门螺杆菌;ureB基因;乳酸乳球菌;食品级表达载体;条件优化
目的:以乳酸乳球菌 (Lactococcus lactis,L.lactis)为宿主菌构建幽门螺杆菌 (Helicobacter pylori,H.pylori)尿素酶B(UreB)的食品级表达系统。方法:从重组质粒 pMD19-T-ureB上酶切得到 ureB基因片段,与含有筛选标记 lacF基因的L.lactis表达载体 pNZ8149经双酶切后定向连接,应用 PCR、酶切和测序的方法鉴定重组子。重组菌用乳联菌肽诱导表达,用正交表实验进行表达条件的优化,通过 SDS-PAGE和Western blot对重组蛋白进行鉴定。结果:重组菌NZ3900/pNZ8149-ureB经鉴定与预期相符。优化结果显示在菌体培养到D600nm为 0.40左右时加入终浓度为 25μg/L的乳联菌肽诱导 5 h产量最高,通过Western blot能检测到UreB的表达。结论:构建了 ureB基因食品级表达系统,并得到了表达的最优条件。
1 材料与方法
1.1 菌株及质粒 大肠杆菌DH5α由河南省分子医学重点实验室保存,质粒 pMD19-T-ureB和重组工程菌 TB1/pMAL-c2X-ureB由作者所在的课题组前期构建[7]。L.lactis表达载体 pNZ8149及L.lactisNZ3900购自荷兰N IZO研究所。
1.2 主要试剂 限制性内切酶NcoⅠ、XbaⅠ和 T4 DNA连接酶购自美国 Promega公司,质粒提取试剂盒和 Taq DNA聚合酶由北京天根生物公司提供, DNA回收纯化试剂盒为 Axygen公司产品,乳联菌肽(nisin)为 Sigma公司产品。
1.3 重组质粒的构建和转化 从大肠杆菌DH5α/ pMD19-T-ureB中提取质粒,酶切回收得到 ureB基因。pNZ8149以NcoⅠ、XbaⅠ双酶切后和回收的ureB用 T4 DNA连接酶 23℃连接 4 h,乙醇沉淀纯化。将纯化的连接产物与电转化感受态细胞NZ3900混匀后,转入预冷的电转化杯 (Bio-Rad公司)中,电击参数:2.2 kV、25μF、200Ω,4.98 ms。电击后加入 1 mL预冷的 G M17MC恢复培养基,将菌液转入 1.5 mL的离心管中,冰上静置 5 min,30℃厌氧培养 2 h,取适量菌液涂布于 Elliker培养基, 30℃厌氧培养过夜,挑取阳性菌落培养,提取质粒。对重组质粒进行酶切、PCR和测序鉴定。将阳性重组质粒命名为 pNZ8149-ureB,获得的阳性工程菌命名为NZ3900/pNZ8149-ureB。
1.4 重组乳酸菌 NZ3900/pNZ8149-ureB诱导表达条件的优化及表达 采用L25(53)正交表,取诱导剂 nisin的质量浓度 (A)、诱导时机 (B)和诱导持续时间(C)3个因素,每个因素设 5个水平:A因素为5、25、50、100和 150μg/L,B因素菌液D600nm为0.10~、0.15~、0.20~、0.30~、0.40~0.60,C因素为诱导 1、2、3、4和 5 h。将阳性重组菌及空载体对照菌接种于LM17培养基中,30℃厌氧培养过夜后,取过夜培养菌以 1∶25比例接种于LM17培养基中,30℃厌氧培养,按照正交实验设计的不同组合进行诱导。终止培养后菌液 8 000 r/min、4℃离心 5 min收集菌体,用 PBS洗 1次,离心后加入 400 μL Column buffer(20 mmol/L Tris-Cl、200 mmol/L NaCl、1 mmol/L EDTA和 10 mmol/Lβ-巯基乙醇)重悬菌体。用溶菌酶破碎菌体,Bradford法测得各样品的总蛋白浓度。按每孔 50μg上样量,计算上样体积,加入凝胶加样缓冲液(含DTT)充分混匀,120 g/L SDS-PAGE进行电泳。用 BandScan软件分析得出UreB蛋白占总蛋白的比例;根据各样品的总蛋白浓度计算出每mL培养基得到目的蛋白的量。
1.5 表达产物鉴定 重组乳酸菌表达的蛋白经SDS-PAGE电泳后,用Bio-Rad半干式电转印仪将胶上的蛋白转移到硝酸纤维素膜上,同时设空白菌株NZ3900/pNZ8149为对照。转印结束后,以制备的小鼠抗 UreB免疫血清为一抗,HRP标记的羊抗鼠IgG为二抗,联苯胺作为底物进行Western blot。
2 结果
2.1 重组质粒 pNZ8149-ureB的构建及鉴定 见图 1。构建的重组质粒测序结果和 GenBank上公布的 Hp-MEL27 ureB基因进行BLAST对比,序列完全一致。
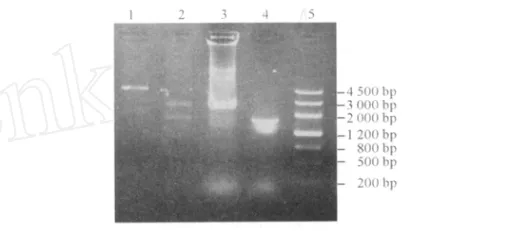
图 1 重组质粒 pNZ8149-ureB的 PCR和酶切鉴定
2.2 重组蛋白诱导表达条件的优化 正交实验结果见表 1、2。可知,各因素对实验结果影响大小的次序是B>A>C,且只有因素B(诱导时机)对实验结果的影响有统计学意义,在 B5A2C5条件下,UreB蛋白产率最高,此时的产量为 12.900 mg/L,占总蛋白的7%左右。
2.3 重组菌表达的 UreB蛋白活性鉴定 NZ3900/ pNZ8149-ureB各孔均现预期蛋白相对分子质量为64 000的条带,而对照空菌 NZ3900/pNZ8149无对应条带(图 2)。
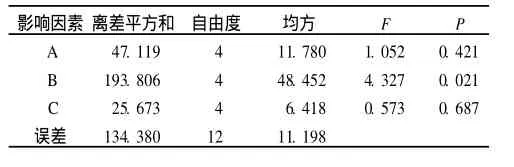
表1 正交实验方差分析结果
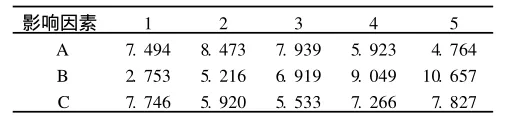
表2 3因素各水平边际均值 mg/L
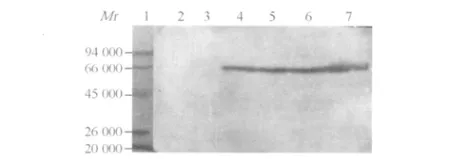
图 2 重组菌表达的 UreB蛋白W estern blot的结果
3 讨论
乳酸菌作为益生菌,在工业、农业和医学医药等领域与人类生活密切相关。L.lactis是乳酸菌类的一个属,近年来作为一种新型表达系统成功地表达了多种外源基因,显示了很大的发展潜力。已有不少的保护性抗原在乳酸菌中表达,Lee等[9]用L.lactis表达系统表达 UreB,能够激发小鼠的免疫应答; Kim等[10]也在L.lactisMG1363中表达了H.pyloricag12基因,以口服方式免疫小鼠并产生了相应的免疫保护作用。但是构建的这些表达系统均用抗生素抗性基因为筛选标记,存在潜在的生物危害,不能广泛应用。因此需要研发完全的食品级的表达载体。目前利用最广泛的表达系统是 N I CE(Nisincontrolled expression)系统。该系统中诱导剂 nisin作用于蛋白激酶 nisK基因,随后通过磷酸化激活反应蛋白 nisR基因,产生的激活蛋白诱导位于 nis A启动子后的目的基因表达[8]。
该研究采用的宿主菌NZ3900含有 nisK和 nisR基因,表达载体 pNZ8149含有 nis A启动子。pNZ8149的 nis A启动子的起始密码子 ATG处有NcoⅠ酶切位点,这样使插入的目的基因与启动子nis A的核糖体结合位点 (SD)区域构成翻译融合,较转录融合表达具有更高的表达活性[11]。表达载体pNZ8149含有 lacF基因,转化入 lacF基因缺失的宿主菌NZ3900中,使原来不能利用乳糖的NZ3900可以发酵乳糖并产酸;引起周围 pH值降低,使筛选培养基中的溴甲酚紫由紫色变为黄色。这种利用乳糖为选择标记的表达系统,所有的元件都是食品级的,因此口服具有安全性。
诱导剂浓度、诱导时机和诱导持续时间是影响目的蛋白表达的主要因素,通过正交实验的统计结果分析可以看出,诱导的时机最为重要,应在菌体达到对数生长期时(D600nm为 0.40~0.60)加入适量的诱导剂进行培养,目的蛋白 UreB的最高产量为12.900 mg/L,占总蛋白的 7%左右。
总之,作者成功构建了 ureB的乳酸乳球菌食品级表达系统,并表达了UreB蛋白,经Western blot反应证明,表达的UreB蛋白有很好的免疫反应性。H.pylori的免疫保护途径主要来自黏膜免疫,乳球菌与M细胞吸收的生物可降解微粒大小相近,能有效激发黏膜免疫反应[12]。因此口服的食品级乳酸乳球菌表达载体在H.pylori疫苗的研发中有重要的前景。
[1]MarshallBJ,Warren JR.Unidentified curved bacilli in the stomach of patientswith gastritis and peptic ulceration[J]. Lancet,1984,1(8390):1311
[2]王凯娟,王润田.中国幽门螺杆菌感染流行病学Meta分析[J].中华流行病学杂志,2003,24(6):443
[3]Wang KX,Chen L.Helicobacter pylori L-for m and patients with chronic gastritis[J].World J Gastroenterol, 2004,10(9):1306
[4]Peter S,Beglinger C.Helicobacter pylori and gastric cancer:the causal relationship[J].Digestion,2007,75(1):25
[5]Michetti P,Corthesy-Theulaz I,Davin C,et al.I mmunization of BALB/c mice against Helicobacter felis infection with Helicobacter pylori urease[J].Gastroenterology,1994,107(4):1002
[6]张荣光,段广才,郗园林.幽门螺杆菌 omp11基因的克隆及序列分析[J].中华微生物学和免疫学杂志,2003, 23(12):951
[7]代丽萍,段广才,范清堂.pMAL-C2融合表达幽门螺杆菌HspA-UreB重组蛋白[J].中华消化杂志,2003,23(11):700 [8]Kleerebezem M,Quadri LE.Peptide pheromone-dependent regulation of antimicrobial peptide production in Grampositive bacteria:a case of multicellular behavior[J]. Peptides,2001,22(10):1579
[9]LeeMH,Roussel Y,WilksM,et al.Expression of Helicobacter pylori urease subunit B gene in Lactococcus lactis MG1363 and its use as a vaccine delivery system against H. pylori infection in mice[J].Vaccine,2001,19(28/29):3927
[10]Ki m SJ,Jun DY,Yong CH,et al.Expression of Helicobacter pylori cag12 gene in Lactococcus lactisMG1363 and its oral administration to induce systemic anti-Cag12 i mmune response in mice[J].ApplMicrobiolBiotechnol,2006,72(3):462
[11]MolletB,KnolJ,Pool manB,et al.Directed genomic integration, gene replacement,and integrative gene expression in Streptococcus ther mophilus[J].J Bacteriol,1993,175(14):4315
Food-grade expression ofhelicobacter pyloriureB gene inLactococcus lactisand optimization for its expression conditions
CHEN Shuaiyin1),ZHANG Rongguang2),FAN Q ingtang1),DUAN Guangcai1)1)Departm ent of Epidem iology,College of Public Health,Zhengzhou University;Henan Key Laboratory of M olecularM edicine,Zhengzhou 4500012)Departm ent of Parasitology,College of B asicM edical Sciences, Zhengzhou University,Zhengzhou 450001
Helicobacter pylori;urease subunitB gene;Lactococcus lactis;food-grade expression vector;condition optimization
Ai m:To construct food-grade expression system ofHelicobacter pylori(H.pylori)urease subunitB(UreB) in Lactococcus lactis(L.lactis)using lacF selective marker.Methods:The ureB gene was obtained from the recombinant vector of pMD19-T-ureB by enzyme digestion,and then inserted into pNZ8149 food-grade expression vector.lacF as foodgrade selection for growth on lactose.Then the recombinant plasmid pNZ8149-ureB was electrotransformed intoL.lactisNZ3900.The recombinant protein was detected by SDS-PAGE andWestern blot.Orthogonal design was used to optimize the expression conditions of UreB.Results:Western blot demonstrated that the UreB protein was expressed in theL.lactistransfor mant.The optimized conditionswere determined as follows:induction of expression was carried out at the cells density ofD600nm≈0.40 with 25μg/L nisin,and harvest after5 h.As a result,themaximum yield ofUreB was esti mated to be 7%of total soluble cellular proteins.Conclusion:The food-grade expression vector system of UreB has been constructed and the optimized expression conditions have been obtained. 1983年澳大利亚科学家Warren和Marshall首次从胃上皮细胞中分离出幽门螺杆菌 (Helicobacter pylori,H.pylori)[1]。据流行病学调查[2],全世界成人约 50%携带H.pylori,其是慢性胃炎、胃和十二指肠消化性溃疡的主要病因[3-4]。近年来发现了多种H.pylori的有效保护性抗原成分,如尿素酶 B (UreB)、HspA、Omp11和 CagA[5-6]等。目前对H. pylori疫苗的研究常以减毒沙门氏菌作为活菌载体,但活的减毒沙门氏菌在人体及动物体内仍有一定的毒性,故不能用于体质弱的群体如婴幼儿、年老者及免疫缺陷者。以乳酸乳球菌 (Lactococcus lactis,L. lactis)作为活菌疫苗载体,可以避免以上问题。作者以L.lactis为宿主菌构建H.pyloriUreB的食品级表达系统,并用正交实验进行表达条件的优化,以获得食品级的H.pylori活菌疫苗。
R183
*中国博士后科学基金资助项目 20070410252
(2010-04-28收稿 责任编辑徐春燕)

