腹足纲动物毒性测试候选物种的研究
郑师梅,周启星,2*,熊红霞 (.南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 30007;2.中国科学院沈阳应用生态研究所,中国科学院陆地生态过程重点实验室,辽宁 沈阳 006)
腹足纲动物毒性测试候选物种的研究
郑师梅1,周启星1,2*,熊红霞1(1.南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071;2.中国科学院沈阳应用生态研究所,中国科学院陆地生态过程重点实验室,辽宁 沈阳 110016)
随着对内分泌干扰物在腹足纲动物中危害性的关注,软体动物污染生态问题逐渐受到重视.基于该研究方向现有进展,就几种典型腹足纲动物作为化学品测试受试生物的候选物种进行了论述,认为4种前鳃亚纲生物(新西兰泥蜗、鱼盘螺、福寿螺和铜锈环棱螺)和1种肺螺亚纲生物(静水椎实螺)具有生态意义,可以作为标准受试生物来发展.相对于其他国外学者提议的 4种生物,我国学者提议的铜锈环棱螺具有本土意义,在化学品毒性测试过程中应该受到重视.在以上论述基础上,对腹足纲动物毒性测试今后研究的发展方向进行了展望.
化学品;受试生物;腹足纲动物;污染生态问题;生态意义
在化学品毒性测试中,受试生物的选择对正确评价化学品影响很大.自20世纪80年代以来,经济合作发展组织(OECD)、国际标准化组织(ISO)等国际组织致力于将化学品测试以及基准研究的受试生物动物化.OECD推荐的受试生物有以下几类:鱼类包括斑马鱼(Brachydanio rerio)、黑头软口鲦(Pimephales promelas)、鲤鱼(Cyprinus carpio)、日本青鳉(Oryzias latipes)、蓝鳃太阳鱼(Lipomis macrochirus)、孔雀鱼(Poecilia reticulata)和虹鳟(Oncorhynchus mykiss)[1];沉积物测试生物是摇蚊幼虫(Chironomus tentans)[2]. ISO推荐斑马鱼、蓝鳃太阳鱼、黑头软口鲦和孔雀鱼作为淡水鱼的代表[3].美国环境保护局(USEPA)推荐摇蚊幼虫、端足类淡水虾(Hyalella azteca)和夹杂带丝蚓(Lumbriculus varigatus)作为沉积物的受试生物[4].美国试验与材料协会(ASTM)推荐的沉积物受试生物除了包括 USEPA推荐的生物外,还包括蜉蝣幼虫(Hexagenia limbata)、大型蚤(Daphnia magna)、网纹水蚤(Ceriodaphnia dubia)和颤蚓(Tubifex tubifex)等[5].而我国近几年开发的受试生物主要是鱼类,包括剑尾鱼(Xiphophorus helleri)、稀有鮈鲫(Gobiocypris rarus, 我国特有种)和红鲫(Carassius auratus)等[3,6].可见,目前发展的实验生物主要是脊椎动物中的鱼类和无脊椎动物中的节肢动物,却缺少了无脊椎动物很重要的一部分——软体动物,特别是其中的腹足纲动物.虽然USEPA在1985年提出水质基准推导准则时,将软体动物纳入到了受试物种体系中,却不是如脊椎动物和节肢动物一样的必选物种[7],这说明推导的水质基准难以为软体动物提供应有的保护作用.1995年USEPA发展了一个基于腹足纲前鳃亚纲生物红鲍螺(Haliotis rufescens)幼体发育的方法用来检测废水的毒性[8],但不是针对化学品的测试.
1 腹足纲动物毒性测试的生态意义
软体动物超过了130000种,共有7个纲,其中已知的 110000种腹足纲动物占软体动物的85%[9],其物种的重要生态意义不应该被忽略.蜗牛是腹足纲物种的重要代表,虽然已经被用作湖泊营养级水平的指示生物[10]和污染的指示生物
[11-12],但是这只是腹足纲物种生态意义的部分体现,其生态意义的重要性还没有被完全的认识和开发.
资料表明,动物对化学品的敏感性存在差异,不论是脊椎动物与无脊椎动物之间,还是脊椎动物之间、无脊椎动物之间.Oetken等[13]研究发现,抗癫痫药卡巴咪嗪(carbamazepine)对夹杂带丝蚓和新西兰泥蜗(Potamopyrgus antipodarum)没有显著影响,而对摇蚊幼虫有明显的剂量-效应关系.Nassef等[14]研究发现,卡巴咪嗪对日本青鳉的进食行为和游泳速度都产生影响.而 Nentwig等[15]发现,抗抑郁药氟西汀(fluoxetine)对摇蚊幼虫没有明显的剂量-效应影响,却使夹杂带丝蚓的生殖有略微增加,并且造成了新西兰泥蜗的生殖率大幅度降低.Foran等[16]发现,氟西汀对日本青鳉的产卵率、受精率或者受精卵的孵化没有明显影响.Stuart等[17]发现,肥鳃螺(Gillia altilis)对五氯苯酚的敏感性比金鱼和黑头呆鱼的高,而Robertson等[18]却发现杀虫剂二嗪农(diazinon)对肥鳃螺的LC50比对蓝鳃太阳鱼,虹鳟鱼和蓝点石斑的大.由以上结果可知,用单一物种来鉴定所有的环境污染问题是存在矛盾的,基于鱼类和节肢动物的化学品测试体系的代表性有待完善,需要把软体动物特别是腹足纲动物这部分补充进来.
实地检测数据表明,软体动物对污染物有很高的敏感性,并对污染物有指示作用和富集作用[19-28],其中最经典的例子是有机锡导致至少150种海洋前鳃亚纲动物的性畸变[9,24-28],一些敏感的新腹足目种类在三丁基锡污染严重的地区已经灭绝[24],而脊椎动物或节肢动物未受到或受到很小的影响.因此用软体动物作为毒性试验生物,能填补软体动物缺失的生态意义.
2 腹足纲动物毒性测试最重要的候选物种
2.1 新西兰泥蜗
新西兰泥蜗属于腹足纲(Gastropoda)的前鳃亚纲(Prosobranchia)角崔螺科(Hydrobiidae).它原产于新西兰,后来被引入到世界其他地方,在小溪、河流和湖泊等淡水生态系统中分布广泛,在河口等咸水中也有分布.雌雄异体,有单性生殖和双亲生殖两种,生殖方式为卵胎生.成螺的平均壳高在4.3mm左右,最高能够达到6mm.它们从植物、石头或者沉积物的表面刮食碎屑、藻类和细菌[29].
Duft等[29]提出3种前鳃亚纲生物作为评价内分泌干扰物的候选物种,分别是新西兰泥蜗、大 羊 角 螺 (Marisa cornuarietis,瓶 螺 科Ampullariidae)和网纹织螺(Nassarius reticulatus,蛾螺科Buccinidae).这3种生物对内分泌干扰物都有很高的敏感性,见表 1,但是新西兰泥蜗在实验操作方面的优势最多,所以Duft等最终选择该生物作为候选物种,并推荐该生物28d的繁殖实验作为标准测试.新西兰泥蜗的优势依据为新西兰泥蜗和大羊角螺已经在实验室成功培养,具有实际应用的优势;欧洲的新西兰泥蜗只有雌性螺,进行单性生殖,而来自单性的个体对胁迫因子反应的差异性比来自双性种类的少;由表1看到,新西兰泥蜗的测试终点容易处理,实验周期相对较短.而大羊角螺和网纹织螺的测试需要先进的技术检测性畸性,且实验周期相对较长.
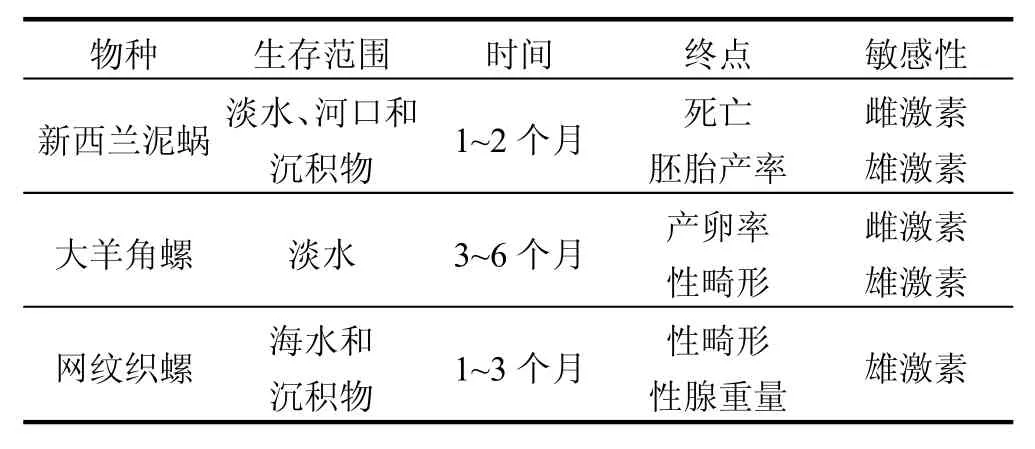
表1 新西兰泥蜗、大羊角螺和网纹织螺的实验参数[29]Table 1 The experimental parameters of Potamopyrgus antipodarum, Marisa cornuarietis and Nassarius reticulates[29]
2.2 静水椎实螺
静水椎实螺(Lymnaea stagnalis)是腹足纲肺螺亚纲(Pulmonata)的椎实螺科(Lymnaeidae)物种,体型为中大型,壳高可达60mm以上,栖息于缓流或静水水域,食草性,雌雄同体,主要是自体受精,也存在异体受精[30].
Lagadic等[30]指出,从1960开始,不断有报道称肺螺暴露在大量异型物质(包括在无脊椎动物或者脊椎动物中已知的内分泌干扰物)下,其繁殖行为会发生改变.内分泌干扰物不仅直接与受体结合,也间接通过对荷尔蒙的生产、可得性或者代谢相关的生物化学过程的干扰调节内源荷尔蒙水平,或者通过调节受体来干扰[30-31].所以,肺螺很可能正在遭受与前鳃亚纲螺的性畸形不同的内分泌干扰危害,然而此危害未受到重视.
同时,EDIETA (Endocrine Disruption in Invertebrates: Endocrinology, Testing and Assessment)工作组中的deFur等在1999年的报道中指出,在非前鳃亚纲螺——静水椎实螺和紫贻贝(Mytilus edulis)中可能发生了非有机锡内分泌干扰物的影响[32],具体指,DDT和(4-氯-2-甲基苯氧基)乙酸甲酯导致静水椎实螺的产卵率下降[33],金属镉明显抑制紫贻贝雌性和雄性性腺卵泡的发育,同时对产卵频率有刺激作用[34].由于静水椎实螺的神经荷尔蒙控制的繁殖已经完全被研究清楚,几种荷尔蒙多肽的结构和受体的主要结构已经建立,所以Lagadic等[30]提议将静水椎实螺作为内分泌干扰物对肺螺影响的模式生物.
2.3 鱼盘螺
鱼盘螺(Valvata piscinalis)属于腹足纲前鳃亚纲的盘螺科(Valvatidae),雌雄同体,异体受精,滤食或者刮食小颗粒的营养碎屑、硅藻和细菌.通常存在于松软沉积物和泥浆的表层,在运河、水沟、池塘、湖泊以及河流等的水生态系统都能发现它,在欧洲、加拿大、美国和亚洲西部,鱼盘螺通常是优势种[35].
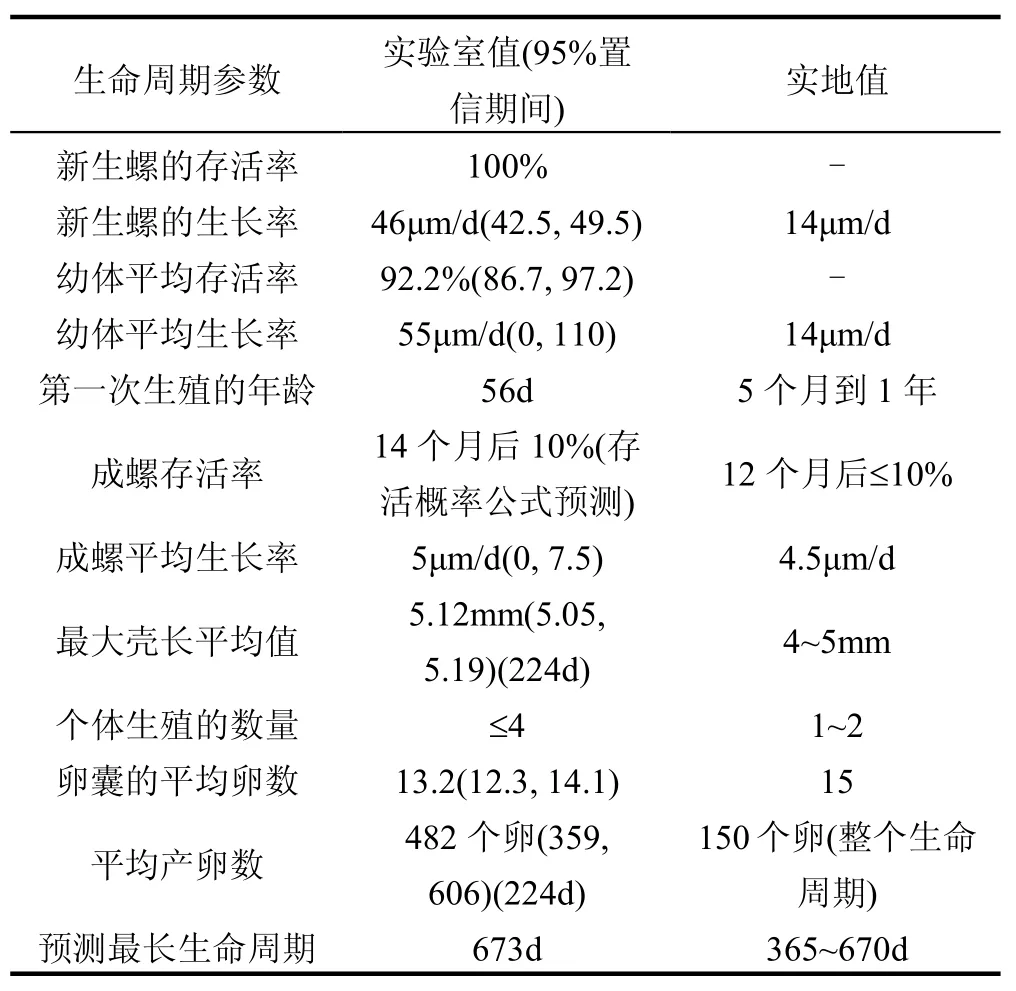
表2 鱼盘螺的生命周期参数[35]Table 2 Life cycle parameters for Valvata piscinalis[35]
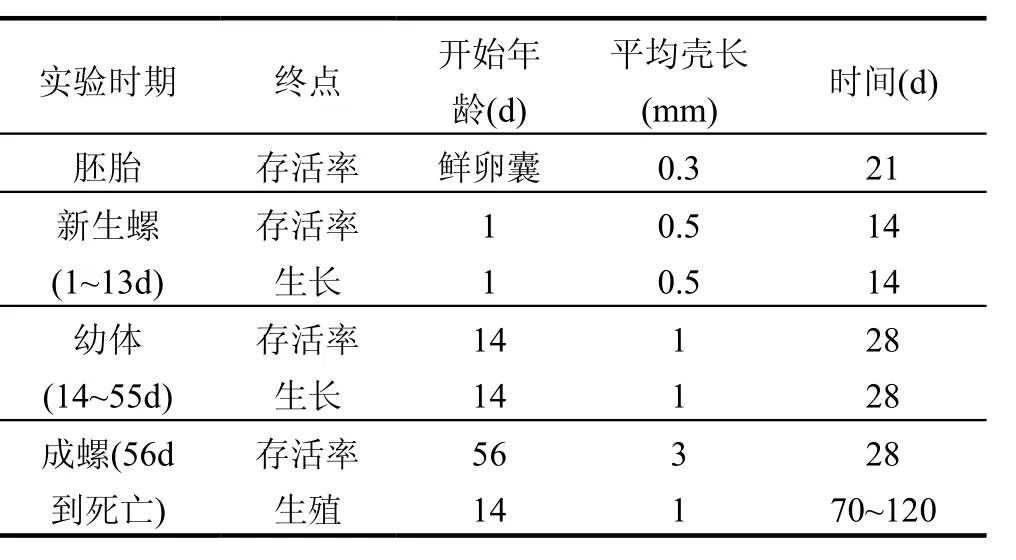
表3 鱼盘螺实验的推荐[35]Table 3 Recommendations for testing with Valvata piscinalis [35]
Ducrot等[35]将鱼盘螺作为沉积物毒性测试的一种新的候选生物,并提出了培养和测试的实验方案.该螺的生物/生态特点跟其他的腹足纲生物相似,其对化合物的敏感性具有代表性.该生物在实验室里被成功培养了六代,由表2看到,实验室中的新生螺和幼体的生长速率以及产卵量都比实地条件的高.Ducrot等推荐,该螺从胚胎到成螺都可以作为毒性测试生物,见表3.
2.4 福寿螺
福寿螺(Pomacea lineata)是腹足纲前鳃亚纲的瓶螺科生物,是一种两栖类腹足动物,能离开水体短暂生活.个体大,能达到70mm左右,为雌雄异体,体内受精,体外发育的卵生动物.多集群栖息于池边浅水区,是以植物性饵料为主的杂食性螺类[36].
Melo等[36]将福寿螺作为巴西东北部本土动植物受试生物的代表,利用筛选法半定量地确定不依赖时间的 LC50和依赖时间 ILC50.用新生的(4d)、饥饿的福寿螺作为实验生物,如果第4d或者5d内急性毒性明显(即死亡明显),研究者应继续实验直至实验生物的死亡停止或者对照的存活率低于90%.延长的实验期间(一般10~14d)能够看到实验浓度之间更加清晰的区别,一般足够分辨不依赖时间的最低观察死亡浓度(LOMC)和无观察死亡浓度(NOMC) (分别对应于最低观察效应浓度LOEC,无观察效应浓度NOEC).
2.5 铜锈环棱螺
铜锈环棱螺(Bellamya aeruginosa)属于腹足纲前鳃亚纲的田螺科(Viviparidae),个体中等大小,能达到27mm,雌雄异体,卵胎生.在我国河流、湖泊、水库、水沟等淡水水体中分布广,数量大,主要栖居在富含有机物的沉积物中,以摄食沉积物中有机碎屑、细菌和藻类为生.该物种还是一些鱼类(如青鱼)的食物,同时也被人们食用[37].
Ma等[37]研究了铜锈环棱螺在实验室条件下的生命特征,建立了该物种的实验室培养和沉积物毒性评价的实验方案,推荐该生物作为沉积物测试的候选物种.与卵生腹足动物(如鱼盘螺)相比,铜锈环棱螺的卵胎生的生长特点有助于培养,因为在其生命早期阶段不需要特别的照顾.同时与鱼盘螺和新西兰泥蜗相比,Ma等认为铜锈环棱螺有明显的优势,主要体现在它的个体相对较大(成螺比另外两种高出 17mm),有助于实验的处理.基于铜锈环棱螺的生活史,Ma等推荐幼螺(7d~28d)、中螺(28~112d)和成螺(> 112d)都可以用来评价沉积物毒性.
3 存在问题
Giesy等[38]在1989年选择沉积物毒性测试的受试生物时,虽然他们认为螺类和蛤类生物对研究很有用,但是他们也指出了该类生物作为受试生物的局限性:很难准确地确定终点(一般指死亡);确定实际的暴露剂量存在困难;培养该类生物存在困难.基于以上考虑,以往未将该类生物列入受试物种.
虽然现代方法学的发展解决了以上的局限性[35],但是到目前为止,软体动物还没有常规的用于化学品毒性分析中.在 USEPA2005年的生态毒理受试物种数据库中仅有47种软体动物被用于实验室的毒理测试[35],随着近几年对该类物种生态意义关注度的增加,到2010年6月数据库中蜗牛的种类增加到180种[39].尽管种类丰富度增加,同时有大量关于软体动物毒理实验的文献,但是到目前仍未发展一种淡水的或者海水的软体动物作为化学品测试的标准受试生物.
对于新西兰泥蜗,Duft等[29]指出,尽管该生物对雌性和雄性激素均有高敏感性,但是具有一般生殖毒性的其他物质(如重金属和多环芳烃)也能产生与内分泌干扰物相似的影响,因此研究者要排除一般生殖毒性物质的影响.实际上,新西兰泥蜗 28d的繁殖测试,是 EDIETA工作组为OECD发展无脊椎动物内分泌测试推荐的实验方案.对于静水椎实螺,Lagadic等[30]指出,尽管充分了解其神经荷尔蒙控制繁殖的内分泌系统,但是在现有内分泌学的知识水平上还不能清楚的检测化学品诱导的内分泌干扰,因此针对内分泌干扰物对静水椎实螺影响的大部分研究,都是从整体方法中间接的探索可能的根源,而且涉及到的机制是否为内分泌干扰仍不清楚.
对于内分泌干扰物的测试,Matthiessen等[24]指出,目前的研究表明,软体动物特别是蜗牛是对内分泌干扰物最敏感的生物.deFur等在内分泌干扰物对无脊椎动物的影响中指出[32],在发展内分泌干扰物的测试中,昆虫和前鳃亚纲蜗牛是最有希望的候选物种. Matthiessen[40]认为新西兰泥蜗暴露 28d不足以覆盖所有可能的内分泌过程,因此提议将软体动物的整个生命周期作为实验周期.考虑到静水椎实螺的生命周期比新西兰泥蜗的短,故Matthiessen[40]建议静水椎实螺作为整个生命周期的实验生物,新西兰泥蜗作为部分生命周期的实验生物.同样,Segner等[41]考虑到对无脊椎动物内分泌系统的有限了解,也认为无脊椎动物的内分泌干扰物实验更适于在整个生命周期测试,并认为整个生命周期测试是评价无脊椎动物内分泌干扰物的黄金标准.
对于鱼盘螺,Ducrot等[35]比较了加标 Zn沉积物对鱼盘螺和摇蚊幼虫的生长毒性.鱼盘螺的LOEC为624mg/kg,而摇蚊幼虫第2代、第3代和第4代的LOEC分别是953、1382、1400mg/kg,都高于鱼盘螺.同时,该螺水体中Zn的24h LC50为31.6mg/L也低于文献[42]中大型蚤的35.4mg/L.这些结果表明鱼盘螺对Zn的短期测试和长期测试的敏感性均比两种标准实验物种高.
对于福寿螺,Melo等[36]指出,该螺在毒性研究中不具有代表性,但是当它饥饿的时候,对低浓度水平的工业污水和除草剂反应的敏感性和一致性在可接受的信用区间.新生螺对百草枯(paraquat)的 ILC50和 LC50分别是 0.15和0.35mg/L,LOMC和 NOMC分别是 0.12和0.07mg/L,与文献[43]中的水蚤、钩虾、石蝇、镖水蚤和波鱼相比,福寿螺的LC50要低一个数量级.此实验方案独特之处在于饥饿过程,实验动物的敏感性因此增加.而Coller等[44]利用Melo的方法研究除草剂农达(Round-up)的毒性时发现,不能清晰的分辩死亡是由除草剂的毒性导致的还是饥饿导致的,所以Coller将饥饿过程去掉,喂食新生螺,选择体重增长率替代死亡作为反应参数,并证明这个参数更好.Melo实验中得到的百草枯的LC50使 Coller实验中的生物在 6d内全部死亡,说明在存活率基础上估算出来的LC50将生物放在了一个极其脆弱的生存水平上. Coller还发现,延长高浓度农达的暴露时间,以死亡率为依据,螺未显示出更高的敏感性.
关于铜锈环棱螺,加标 Cu沉积物对幼螺的存活率和生长的 LOEC为 195μg/g,低于成螺的570 μg/g,表明幼体对加标Cu沉积物的敏感性比成螺高[37].幼螺和成螺的LOEC比文献[45]中端足类淡水虾和摇蚊幼虫的(>2010μg/g)都要低,说明铜锈环棱螺比两个标准受试生物对沉积物的Cu更为敏感.
对于选择实验最适生物,Buikema等[46]、Giesy等[38]以及 ASTM[47]提出了相似的标准:生物必须代表一种对于分类、营养级或者生态位很重要的生态组;生物必须在环境中广泛存在,全年可得,且在实验室容易培养,遗传稳定;研究者应该知道其生理学、遗传学、分类学、行为学等方面的信息;生物对毒物的反应必须是敏感的、一致的、可以检测的;生物个体必须对疾病和身体伤害有抵抗.以上标准对候选生物来说,最重要的方面是对污染物的敏感性.因此,除了新西兰泥蜗和静水椎实螺,对于其余3种候选生物来说,还欠缺大量污染物的急性和慢性的敏感性信息.
文献中推荐的5种腹足纲候选生物有4种前鳃亚纲生物和1种肺螺亚纲生物.与前鳃亚纲螺不同,肺螺亚纲生物均无厣,对毒物不能回避,所以对毒物比较敏感,因此在发展腹足纲模式受试生物的时候应该适当增加该类生物的比重.该类生物用肺呼吸,适合于水体毒性实验而不适合沉积物毒性实验[37].
4 对发展我国模式生物毒性测试的一点思考
在建立化学品测试方面,我国落后于美国、欧洲等发达国家和地区.我国化学品环境管理的技术导则主要是参考OECD的相关框架和内容而制定,如“化学品测试导则(HJ/T 153-2004)”、“新化学品危害评估导则(HJ/T 154-2004)”和“化学品测试合格实验室导则(HJ/T 155-2004)”.《水和废水检测分析方法》[48]和《化学品测试方法》[49]推荐的实验生物除了我国的稀有鮈鲫和剑尾鱼外,其余都是国际通用物种.由于生态系统的敏感种和优势种具有地域特性,因此使用国际通用物种不能真实的反映化学品对我国本土生物的影响,势必会对我国本土生物的保护造成欠缺,甚至可能产生不可恢复的危害.因此发展适合我国本土的实验生物对于保护我国的自然环境和生态系统很重要.目前软体动物的标准受试生物在国际上还是个技术空白,国际组织(如OECD)和某些国家正在发展软体动物实验准则,将软体动物列入化学品测试准则的受试生物中.我国学者也应该认识到软体动物长期处于欠保护的事实,发展符合我国生态系统的软体动物尤其是腹足纲动物的化学品测试准则.
我国腹足纲动物毒性测试的发展水平低于发达国家,目前可供选择用来发展模式生物的实验物种有限.淡水腹足动物的研究主要集中在田螺科和椎实螺科,海洋腹足动物的研究相对较多,其中很多的研究是针对有机锡内分泌干扰的毒性.在这些研究中,只有一种淡水腹足纲生物作为候选物种发展,那就是 Ma等[37]提议的铜锈环棱螺,作为我国沉积物实验的候选物种.国外学者提议的新西兰泥蜗在亚洲从未被发现,因此发展铜锈环棱螺对我国具有本土意义.刘保元[50]研究过水体污染物对铜锈环棱螺的影响,所以铜锈环棱螺还可以作为水体毒性的实验生物来发展.
5 今后研究展望
5.1 开发我国本土腹足纲受试生物
鉴于我国腹足纲毒性测试发展落后的情况,我国科研工作者应该开发更多具有本土意义的物种.除了前鳃亚纲螺外,肺螺在我国分布也很广,因此也应该考虑将肺螺发展为受试生物.由于内分泌干扰物对生物危害的严峻性,我国学者应该结合和借鉴国际内分泌干扰物测试的发展,开发我国本土的腹足纲内分泌干扰物实验生物.
目前我国正在发展我国生态系统的水质基准[51],而面临的最大困难是缺少本土的模式受试物种[52],因此开发我国本土的腹足纲测试物种将为水质基准的制定提供技术支持,同时避免了USEPA在制定水质基准时对软体动物不重视的问题.
5.2 优化新西兰泥蜗和静水椎实螺的实验
新西兰泥蜗和静水椎实螺的实验程序在形成国际化准则之前,需要大量的实验优化和有效化,建立一个具有充分说服力和最小成本的实验准则[40].这需要生物对更多内分泌干扰物的敏感性信息,最佳实验时间(28d或者56d),还需要实验新西兰泥蜗作为水体毒性生物的情况,以及两种螺繁殖模式对软体动物整体的代表性程度,更深层次的需要调查种群反应的基因变化.
5.3 重视无脊椎动物内分泌系统的研究
由于对无脊椎动物内分泌系统知识的匮乏,当前内分泌干扰物测试的实验生物主要是鱼类和两栖动物[53-54],那么无脊椎动物能否在内分泌干扰物测试中作为实验生物, 起决定性作用的无疑是无脊椎动物内分泌系统的研究.除去前鳃亚纲螺的性畸形/性间性的特殊情况,在缺少特殊暴露标志物的情况下,整体的反应标准(存活率、生长、生殖等)是目前评价无脊椎动物内分泌干扰物的唯一选择.然而,这种方法很难确定对生物的影响是否归因于化合物的内分泌活性[41],所以,发展机制独特性的生物标志物在评价无脊椎动物内分泌干扰物测试中很有价值,同时生物标志物还能用来指导实验物种的选择[55].
5.4 拓展鱼盘螺和铜锈环棱螺的实验,整合福寿螺实验到国家标准程序中
下一步的研究应该评价鱼盘螺和铜锈环棱螺对培养条件的耐受性及其耐受性对生物量产率的影响,以及评价其他培养条件对产率的影响,进而优化培养条件.在此基础上,研究两种螺对大量污染物的敏感性信息.鱼盘螺和铜锈环棱螺也可作为水体毒性受试生物,这需要进一步实验无沉积物的情况.
提议将福寿螺作为巴西本土生物的代表,希望能将该生物常规用于除草剂和污水毒性的急性毒性测试中,并推荐将该毒性实验作为常规的程序列入国家标准程序中,作为早期预警检测工具.
[1] OECD (Organisation for economic cooperation and development) guidelines for the testing of chemicals, 203, 1992. Fish, Acute Toxicity Test [R].
[2] OECD guidelines for the testing of chemicals, 218, 2004. Sediment-Water chironomid toxicity test using spiked sediment [R].
[3] 沈英娃,王 宏,卢 玲.化学品环境管理与水生实验动物 [J].中国比较医学杂志, 2004, 14(1):54-57.
[4] USEPA (U. S. Environmental Protection Agency).2000Methods for measuring the toxicity and bioaccumulation of sedimentassociated contaminants with freshwater [R]. second edition. EPA-600-R-99-064. Washington DC, Office of Science and Technology; Duluth, Minnesota, Office of Research and Development.
[5] ASTM (American Society for Testing and Materials), 2003. Test method for measuring the toxicity of sediment-associated contaminants with fresh water invertebrates [R]. E1706-00e1.
[6] 龙 华,汪登强,陈建武,等.几种实验用鱼的研究现状 [J]. 实验动物与比较医学, 2005,25(3):175-180.
[7] Stephan C E., Mount D J, Hansen D J, et al. Guidelines for deriving numerical national water quality criteria for the protection of aquatic organisms and their uses [R]. PB85-227049. U. S. Environmental Protection agency office of research and development environmental research laboratories. 1985.
[8] Chapman G A, Denton D L, Lazorcha J M, editors. Short-term methods for estimating the chronic toxicity of effluents and receiving waters to west coast marine and estuarine organisms [R]. Washington DC: US Environmental Protection Agency. 1995. EPA/600/R-95-136. 661p.
[9] Oehlmann J, Di B P, Tillmann M, et al. Endocrine disruption in prosobranch molluscs: evidence and ecological relevance [J]. Ecotoxicology, 2007,16(1):29-43.
[10] Clarke AH. Gastropods as indicators of trophic lake stages [J]. The Nautilus, 1979,94:138-142.
[11] Moncheva Snejana, Namiesnik Jacek, Apak Resat, et al. Rapana venosa as a bioindicator of environmental pollution [J]. Chemistry and Ecology, 2011,27(1):31-41.
[12] Hao Oliver J. Bioindicators for water quality evaluation-a review [J]. Journal of the Chinese Institute of Environmental Engineering, 1996,6(1):1-19.
[13] Oetken M, Nentwig G, Löffler D, et al. Effects of pharmaceuticals on aquatic invertebrates. Part I. the antiepileptic drug carbamazepine [J]. Archives of Environmental Contamination and Toxicology, 2005,49(3):353-361.
[14] Nassef Mohamed, Matsumoto Shuhei, Seki Masanori, et al. Acute effects of triclosan, diclofenac and carbamazepine on feeding performance of Japanese medaka fish (Oryzia latipes) [J]. Chemosphere, 2010,80(9):1095-1100.
[15] Nentwig G. Effects of pharmaceuticals on aquatic invertebrates. Part II: the antidepressant drug fluoxetine [J]. Archives of Environmental Contamination and Toxicology, 2007,52(2): 163-170.
[16] Foran Christy M., Weston James, Slattery Marc, et al. Reproductive Assessment of Japanese Medaka (Oryzias latipes) Following a Four-Week Fluoxetine (SSRI) Exposure [J]. Achives of Environmental Contamination and Toxicology, 2004,46(4): 511-517.
[17] Stuart R J, Robertson J B. Acute toxicity of pentachlorophenol to the freshwater snail, Gillia altilis [J]. Bull Environmental Contamination and Toxicology, 1985,35(5):633-640.
[18] Robertson J B, Mazzella C. Acute toxicity of the pesticide diazinon to the freshwater snail Gillia altilis [J]. Bulletin of Environmental Contamination and Toxicology, 1989,42(3): 320-324.
[19] Gaitonde D, Sarkar A, Kaisary S, et al. Acetylcholinesterase activities in marine snail (Cronia contracta) as a biomarker of neurotoxic contaminants along the Goa coast, West coast of India [J]. Ecotoxicology, 2006,15(4):353-358.
[20] Sarkar A, Gaitonde Dipak C S, Sarkar A, et al. Evaluation of impairment of DNA integrity in marine gastropods (Cronia contracta) as a biomarker of genotoxic contaminants in coastal water around Goa, West coast of India [J]. Ecotoxicology and Environmental Safety, 2008,71(2):473-482.
[21] Liang L N, Shi J B, He B, et al. Investigation of methylmercury and total mercury contamination in mollusk samples collected from coastal sites along the Chinese Bohai Sea [J]. Journal of Agricultural and Food Chemistry, 2003,51(25):7373-7378.
[22] Francesca P, Elena C, Maria G M, et al. Concentrations of organotin compounds and imposex in the gastropod Hexaplex trunculus from the Lagoon of Venice [J]. Science of the Total Environment, 2004,332(1-3):89-100.
[23] 贺广凯.黄渤海沿岸经济贝类体中重金属残留水平 [J]. 中国环境科学, 1996,16(2):96-100.
[24] Matthiessen P, Gibbs P E. Critical appraisal of the evidence for tributyltin-mediated endocrine disruption in mollusks [J]. Environmental Toxicology and Chemistry, 1998,17(1):37-43.
[25] Craig P G, Scott P W. Imposex still evident in eastern Australia 10years after tributyltin restrictions [J]. Marine Environmental Research, 2003,55(2):101-112.
[26] Tan K S. Imposex in Thais gradate and Chicoreus capucinus (Mollusca, Neogastropoda, Muricidae) from the Straits of Johor: a case study using penis length, area and weight as measures of imposex severity [J]. Marine Pollution Bulletin, 1999,39(1-12):295-303.
[27] Depledge M H, Billinghurst Z. Ecological significance of endocrine disruption in marine invertebrates [J]. Marine Pollution Bulletin, 1999,39(1-12):32-38.
[28] 施华宏,黄长江.有机锡污染与海产腹足类性畸变 [J]. 生态学报, 2001,21(10):1711-1717.
[29] Duft M, Schmitt C, Bachmann J, et al. Prosobranch snails as test organisms for the assessment of endocrine active chemicals-an overview and a guideline proposal for a reproduction test with the freshwater mudsnail Potamopyrgus antipodarum [J]. Ecotoxicology, 2007,16(1):169-182.
[30] Lagadic L, Coutellec M-A, Caquet T. Endocrine disruption in aquatic pulmonate mollusks: few evidences, many challenges [J]. Ecotoxicology, 2007,16(1):45-59.
[31] Oetken Matthias, Bachmann Jean, Schulte-Oehlmann Ulrike, et al. Evidence for Endocrine disruption in invertebrates [J]. International review of Cytology, 2004,236:1-44.
[32] DeFur P L, Crane M, Ingersoll C, et al. Endocrine disruption in invertebrates: endocrinology, testing, and assessment [R]. In: Proceeding of the workshops on endocrine disruption in invertebrates. 1999, Noordwijkerhout, SETAC Press, Pensacola, The Netherlands.
[33] Woin Per, Brönmark Christer. Effect of DDT and MCPA (4-Chloro-2-Methylphenoxyacetic Acid) on reproduction of the pond snail, Lymnaea stagnalis [J]. Bulletain of Environmental contamination and Toxicology, 1992,48(1):7-13.
[34] Kluytmans J H, Brands F, Zandee D. Interactions of cadmium with the reproductive cycle of Mytilus edulis [J]. Marine Environmental Research, 1988,24(1-4):189-192.
[35] Ducrot V, Cognat C, Mons R, et al. Development of rearing and testing protocols for a new freshwater sediment test species: the gastropod Valvata piscinalis [J]. Chemosphere, 2006,62(8): 1272-1281.
[36] Melo L E L, Coler R A, Watanabe T, et al. Development the gastropod Pomacea lineata (Spix, 1827) as a toxicity test organism [J]. Hydrobiologia, 2000,429(1-3):73-78.
[37] Ma T W, Gong S J, Zhou K, et al. Laboratory culture of the freshwater benthic gastropod Bellamya aeruginosa (Reeve) and its utility as a test species for sediment toxicity [J]. Journal of Environmental Science, 2010,22(2):304-313.
[38] Giesy JP, Hoke RA. Freshwater sediment toxicity bioassessment: rationale for species selection and test design [J]. Journal of Great Lakes Research, 1989,15(4):539-569.
[39] USEPA. Aquatic toxicity information retrieval database [EB/OL]. http://cfpub.epa.gov/ecotox/, 2010-6.
[40] Matthiessen P. An assessment of endocrine disruption in mollusks and the potential for developing internationall [J]. Integrated Environmental Assessment and Management, 2008,4(3):274-284.
[41] Segner H, Caroll K, Fenske M, et al. Identification of endocrine-disrupting effects in aquatic vertebrates and invertebrates: report form the European IDEA project [J]. Ecotoxicology and Environmental Safety, 2003,54(3):302-314.
[42] Guilhermino L, Diamantino T, Caolina Silva M, et al. Acute toxicity test with Daphnia magna: an alternative to mammals in the prescreening of chemical toxicity? Ecotoxicology and Enivronmental Safety, 2000,46(3):357-362.
[43] Hellawell JM. Biological indicators of freshwater pollution and environmental management [M]. Elsevier Applied Science Publishers New York, 1986.
[44] Coller R A, Coler R R, Felizardo EKG, et al. Applying weight gain in Pomacea lineata (Spix, 1827) (Mollusca: Prosobranchia) as a measure of herbicide toxicity [J]. Brazilian Jounal of Biology, 2005,65(4):617-623.
[45] Huggett DB, Gillespie Jr WB, Rodgers Jr JH. Copper bioavailability in Steilacoom Lake sediments. Archives of Environmental Contamination and Toxicology, 1999,36(2):120-123.
[46] Buikema A L, Niederlehner B R, Cairns J. Biological Monitoring, Part IV-Toxicity Testing [J]. Water Research, 1982,16(3):239-262.
[47] ASTM 2002. Standard guide for designing biological tests with sediments (ASTM designation: E 1525-02) [S]. In: Annual Book of ASTM Standards. Vol 11.05. Philadelphia, PA. 844–868.
[48] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002.
[49] 国家环境保护总局《化学品测试方法》编委会.化学品测试方法 [M]. 北京:中国环境科学出版社, 2004.
[50] 刘保元.磷矿浮选剂的选矿尾水对铜锈环棱螺生殖的影响 [J].环境科学与技术, 1988,1:8-11.
[51] Wu Fengchang, Meng Wei, Zhao Xiaoli, et al. China embarking on development of its own national water quality criteria system [J]. Environmental Science and Technology, 2010,44(21): 7992-7993.
[52] 雷炳莉,金小伟,黄圣彪,等.太湖流域 3种氯酚类化合物水质基准的探讨 [J]. 生态毒理学报, 2009,4(1):40-49.
[53] 郝丽妮,赵砚彬,彭 辉,等.梭鱼和青鳉鱼 ERa介导的雌激素活性比较研究 [J]. 中国环境科学, 2010,30(11):1490-1495.
[54] Weltje L, Schulte-Oehlmann U. The seven year itch-progress in research on endocrine disruption in aquatic invertebrates since 1999 [J]. Ecotoxicology, 2007,16(1):1-3.
[55] Hutchinson T H. Small is useful in endocrine disrupter assessment-four key recommendation for aquatic invertebrate research [J]. Ecotoxicology, 2007,16(1):231-238.
[17] Ho Y S, McKay G. Pseudo-second order model for sorption processes [J]. Process Biochem, 1999,34:451-465.
[18] Schiewer S, Balaria A. Biosorption of Pb2+by original and protonated citrus peels: equilibrium, kinetics, and mechanism [J]. Chem Eng J, 2009,146:211-219.
[19] Wang X S, Qin Y. Equilibrium sorption isotherms for of Cu2+on rice bran [J]. Process Biochem, 2005,40:677-680.
[20] Ahmet S, Mustafa T. Kinetic and equilibrium studies of biosorption of Pb(II) and Cd(II) from aqueous solution by macrofungus (Amanita rubescens) biomass [J], J Hazard Mater, 2009,16:1004-1011.
[21] Ho Y S, Porter J F, McKay G. Equilibrium isotherm studies for the sorption of divalent metal ions onto peat: copper, nickel and lead single component systems [J]. Water Air Soil Pollut, 2002, 141:1-33.
[22] 王焕校.污染生态学 [M]. 北京:高等教育出版社, 2000.
[23] Suleman Q, Anwar R S, Muhammas U. Biosorption of lead from aqueous solution by Ficus religiosa leaves: Batch and column study [J]. J Hazard Mater, 2009,166:998-1005.
[24] Sibel T A, Asli G, Burcu A. Investigation of the biosorption characteristics of lead(II) ions onto Symphoricarpus albus: Batch and dynamic flow studies [J]. J Hazard Mater, 2009,165:126-133.
[25] Merroun M L, Geipel G, Nicolai R. Complexation of uranium (VI) by three eco-types of Acidithiobacillus ferrooxidans studied using time-resolved laser-induced fluorescence spectroscopy and infrared spectroscopy [J]. Biometals, 2003,16:331-339.
Discussion on candidate species of gastropoda organisms in toxicity testing.
ZHENG Shi-mei1, ZHOU Qi-xing1,2*, XIONG Hong-xia1(1.Key Laboratory of Pollution Processes and Environmental Criteria, Ministry of Education, Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China;2.Key Laboratory of Terrestrial Ecological Process, Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China). China Environmental Science, 2011,31(8):1390~1397
With an attention to the hazard of endocrine disruptors on gastropoda organisms, the pollution-ecological problem of mollusks is being concerned gradually. Based on the current progress in the research area, several typical gastropoda organisms were discussed as the candidate species of testing organisms in the toxicity testing of chemicals. In view of their ecological significance, the four candidate prosobranchia species (Potamopyrgus antipodarum, Valvata piscinalis, Pomacea lineate and Bellamya aeruginosa) and one pulmonata organism (Lymnaea stagnalis) were suggested to develop as the standard testing organisms. Compared with the four other organisms proposed by foreign scholars, Bellamya aeruginosa proposed by Chinese scholars is of indigenous significance. Thus, attentions should be paid to the species in the toxicity testing of chemicals. On the basis of above discussions, the aspects of research on gastropoda organisms as candidate species in the toxicity testing in the future were prospected.
chemical;testing organism;gastropoda organism;pollution-ecological problem;ecological significance
X171.5
A
1000-6923(2011)08-1390-08
2010-11-01
国家环保公益性项目(200909041);国家自然科学基金资助项目(40930739)
* 责任作者, 教授, Zhouqx@nankai.edu.cn
郑师梅(1983-),女,山东安丘人,博士研究生,主要从事水质基准与生态毒理学研究.发表论文3篇. adsorption and kinetics of chromium(VI) removal from aqueous solutions by Ocimum americanum L. seed pods [J]. J Hazard Mater, 2009,161:709-713.
作者简介:李国新(1981-),男,湖北公安人,博士,主要从事城市水环境生态与修复研究.发表论文10余篇.

