工业铁屑(零价铁)还原硝基苯影响因素研究
苏 燕,赵勇胜,赵 妍,薄艳蓉,王贺飞,王玮瑜 (吉林大学地下水资源与环境教育部重点实验室,吉林 长春 130021)
硝基苯是一种剧毒物质,广泛存在于燃料,医药,化工等排放的废水中.硝基苯具有强烈的致癌致突变性,长期接触会对植物生长和人体健康产生很大影响.研究表明,每年有上百吨硝基苯在生产、运输储存和使用的过程中发生泄漏而导致环境污染[1],我国松花江、黄河、长江等水域都检测出了硝基苯的存在[2].硝基苯的化学性质比较稳定,且不易被生物降解[3].目前,对硝基苯废水的处理方法主要集中在物化法和生物法.由于硝基苯结构的稳定性,生物处理的效果并不好,但有研究者运用厌氧生物法降解硝基苯废水[4].物化法处理硝基苯废水更方便快捷,并且在此过程中可以大大提高废水的可生化性.
零价铁具有强还原性,对氯代烃,硝基苯以及农药等有机污染物具有很好的处理效果[5-9],有研究针对零价铁填充的PRB技术已经广泛应用于重金属、石油烃、溶解性营养成分以及硝基芳香化合物的处理[10-13].由于处理成本低,对于大面积泄露,爆炸等场地污染的处理具有重大意义.我国对零价铁处理硝基苯的研究在20世纪80年代就开始了,对于零价铁处理硝基苯的降解机理和影响因素虽然有很多研究,但是针对工业铁屑对硝基苯的降解的进一步研究尚有不足.本文研究的是废弃工业铁屑对硝基苯还原的影响因素,以期对实现资源重复利用提供参考.
1 实验材料和方法
1.1 实验材料
实验所用零价铁来自炼钢厂工业废渣,实验用水是实验室配制硝基苯溶液.
1.2 实验方法
研究初始硝基苯浓度、零价铁含量和pH值对 NB还原作用影响是间歇取样的批试验,实验设计如下:
(1) 硝基苯初始浓度对还原效果影响:零价铁含量为50g/l,溶液pH值为7,硝基苯的初始浓度分别为127.5、311.25和467.01mg/L.
(2) 零价铁含量对还原效果影响:硝基苯初始浓度为311.25mg/L,溶液pH值为7,零价铁含量分别为25,50,100g/L.
(3) 溶液pH值对还原效果的影响:硝基苯初始浓度为311.25mg/L,零价铁含量为50g/L,溶液pH值分别为2.94,7,11.89.
取样时间定为零价铁与硝基苯溶液接触后20,60,120,240,360,480min.在进行每一批次的实验中,分别取100mL溶液于不加零价铁的空试剂瓶中,作为空白对照实验监测硝基苯在振荡过程中的挥发作用.
1.3 测试方法
本实验中硝基苯和苯胺的检测均采用气相色谱法 GC-2010进行测定.测试条件是:采用岛津GC-2010进行测样,进样口温度200℃;检测器温度:220℃;分流进样,分流比为2:1;载气:氮气,纯度 99.999%;程序升温:初始温度 60℃,保持1min,5℃/min升温至105℃;每次进样1µL.pH值采用便携式pH计进行测定.
2 结果与讨论
2.1 零价铁还原硝基苯的动力学
有研究表明硝基苯的还原反应是一级动力学反应[5].那么一级动力学方程式是:

两边同时取对数得:

那么 ln([ArNO2]/[ArNO2]0)就是一个关于时间t的一次函数.
图1显示的是硝基苯浓度467.01mg/L,pH值为7时,零价铁含量为50g/L条件下,硝基苯还原的衰减动力学即 ln([ArNO2]/[ArNO2]0)与时间 t成线性关系,且方程式为:
ln([ArNO2]/[ArNO2]0)=-0.00891t(R2= 0.9839)
由此可见,本文得出的结论与前人研究结果类似,零价铁还原硝基苯反应符合一级动力学.

图1 零价铁还原硝基苯的动力学拟合曲线Fig.1 Dynamics fitting curve of the reduction of NB by ZVI
2.2 硝基苯的初始浓度对还原效果的影响
当pH值为7,零价铁含量为50g/L时,不同的硝基苯初始浓度下,硝基苯的降解和苯胺的生成如图 2所示.当硝基苯的初始浓度分别为127.5,311.25,467.01mg/L时,在4,6,8h的取水水样中,硝基苯的衰减率均达到100%.由此可见,硝基苯的初始浓度对其衰减率有很大影响.由图2可知,硝基苯的浓度越小,苯胺的生成速率越大,当硝基苯的初始浓度是127.5mg/L时,在1h时苯胺的生成几近最大值,而初始浓度为311.25,467.01mg/L时,苯胺达到最大值的时间分别是 4,6h.当硝基苯浓度分别是 127.5,311.25,467.01mg/L时,计算可得硝基苯的一级衰减速率常数k分别为-0.01532、-0.01235和-0.00891min-1.由此可见,在所考察的范围内,硝基苯的还原速率与硝基苯的初始浓度成反比.

图2 不同硝基苯浓度硝基苯衰减和苯胺的生成曲线Fig.2 The generate curves of aniline and NB underdifferent concentrations of NB

2.3 零价铁含量对还原效果的影响
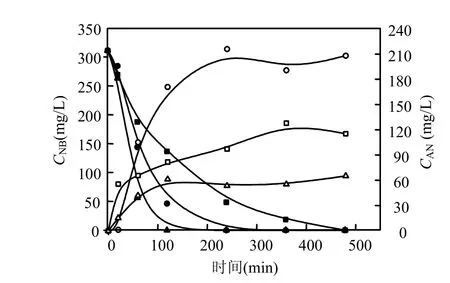
图3 不同零价铁浓度硝基苯衰减和苯胺的生成曲线Fig.3 The generate curves of aniline and NB underdifferent concentrations of ZVI

硝基苯的初始浓度为311.25mg/L,初始pH值为7时,不同的零价铁含量下,硝基苯的降解和苯胺的生成曲线如图3所示.由图可知,零价铁含量分别是100,50,25g/L时,在2,4,8h的水样中,已无硝基苯的存在.由此可知,硝基苯的衰减速率和零价铁含量成正比关系.当零价铁含量为50g/L时,苯胺的生成量最大,100g/L时苯胺的生成量最小.零价铁含量50g/L时更利于苯胺的生成,原因是零价铁含量太低,不利于铁屑表面的活性点部位与硝基苯的接触,零价铁含量太高使生成的苯胺吸附于铁屑表面从而使苯胺生成降低.经计算拟合,零价铁含量分别是25,50,100g/L时,硝基苯的一级衰减速率常数分别是-0.00783、-0.0165和-0.02991min-1.因此,在所考察的范围内,零价铁含量越大,硝基苯的衰减速率也越大.
2.4 pH值对还原效果的影响
实验选取硝基苯的初始浓度为311.25mg/L,零价铁浓度为50g/L时,溶液pH值分别为2.94,7,11.89,即考察在酸性、中性和碱性 3种环境,零价铁对硝基苯的还原效果.由图4可知,pH值分别是为2.94,7时,在4h的水样中,硝基苯的衰减率均达到100%,而pH值11.89时,在反应8h时硝基苯的衰减率达到84.64%.由此可得,碱性环境不利于硝基苯的衰减.硝基苯的衰减方程式是:
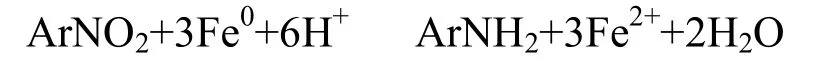
由方程式可知,硝基苯的还原过程中需要一定量的H+,而pH值越高,H+的获得就越少,因此碱性环境不利于反应的进行.另外,碱性条件下 OH-容易与 Fe2+结合生成沉淀从而抑制反应进行.pH值为7时,苯胺的生成量最大, pH值为2.94时其次, pH值是11.89时,苯胺的生成量最小.由此可知,酸性环境加快了零价铁的腐蚀,同时在碱性条件下生成的氢氧化物沉淀抑制反应的进行,使酸性和中性条件下更有利于苯胺的生成.经计算拟合,当pH 值分别为2.94,7,11.89时,硝基苯的一级衰减速率常数分别是-0.01805、-0.0165和-0.00336min-1.由此可得,溶液的pH值与硝基苯的衰减率成反比关系.零价铁还原硝基苯过程伴随pH值的变化,图5是该反应中pH值的变化曲线.由图可知,对于pH值为2.94环境,pH值随着反应的进行逐渐增加,由于还原过程需要 H+,因此随着反应进行,H+被消耗使溶液pH值升高.对于pH值为7的环境,反应的1h内pH值逐渐升高,随后恢复到7左右,原因是还原反应只要发生在前 2h之内,因此前2h的pH值高于初始值.pH值为11.89环境中的pH值在反应过程中变化很小.
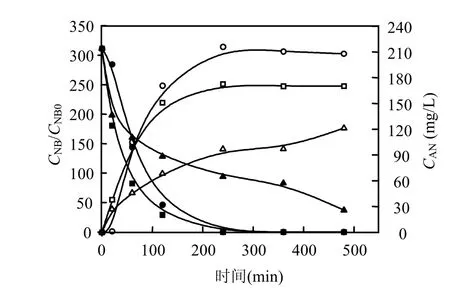
图4 不同pH下硝基苯衰减和苯胺的生成曲线Fig.4 The generate curves of aniline and NB under different pH


图5 不同pH条件下pH随时间的变化曲线Fig.5 Change curves of pH with time under different pH
3 结论
3.1 不同初始硝基苯浓度、不同零价铁含量和不同pH值条件下,零价铁对硝基苯的还原反应均符合一级动力学模型.
3.2 硝基苯的还原速率与初始硝基苯浓度成反比.零价铁含量影响硝基苯的还原速率.在考察范围内,零价铁含量越高,还原速率越大,利于还原反应进行.但是零价铁含量过高或过低,均不利于苯胺的生成.
3.3 pH值影响还原反应.pH值越低还原反应越容易发生,还原速率越大,有利于还原反应的进行.碱性环境不利于还原反应的进行.酸性环境下,随着还原反应的进行,pH值逐渐升高;中性环境下,pH值在前2h大于初始值,而后降到初始水平.
[1]Yoshida K, Shigeoka T, Yamauchi F. Estimation of environmental fate of industrial chemicals [J]. Toxicology Environmental Chemosphere, 1988,17:69-85.
[2]邢立群,郑新梅,刘红玲,等.中国主要河流中硝基苯生态风险研究 [J]. 中国环境科学, 2011,31(2):301-306.
[3]Gerlach R, Steiof M, Zhang C L, et al. Low aqueous solubility electron donors for the reduction of nitro-aromatics in anaerobic sediments [J]. Contamination Hydrology, 1999,36:91-104.
[4]陈 玲,刘 强.不同价态铁对硝基苯的厌氧降解及影响因素[J]. 同济大学学报(自然科学版), 2009,37(4):510-514.
[5]Johnson T L, Scherer M M, Tratnyek P G. Kinetics of halogenated organic compound degradation by iron metal [J]. Environmental Science and Technology, 1996,30:2634-2640.
[6]Agrawal A, Tratnyek P G. Reduction of nitro-aromatic compounds by zero-valent iron metal [J]. Environmental Science and Technology, 1996,30:153-160.
[7]Antoine G. Degradation of benomyl, picloram, and dicamba in a conical apparatus by zero-valent iron power [J]. Chemosphere,2001, 43: 1109-1117.
[8]Tyrovola K, Nikolaidis N P, Veranis N, et al. Arsenic removal from geothermal waters with zero-valent iron-effect of temperature, phosphate and nitrate [J]. Water Resources, 2006,40:2375-2386.
[9]Alowitz M J, Scherer M M. Kinetcs of nitrate, nitrite, and Cr (Ⅵ)reduction by iron metal [J]. Environmental Science and Technology, 2002,36:299-306.
[10]Jeen S W, Blowes D W, Gillham R W. Performance evaluation of granular iron for removing hexavalent chromium under different geochemical conditions [J]. Journal of Contaminant Hydrology,2008,95(1/2):76-91.
[11]Lien H L, Wilkin R T. High-level arsenite removal from groundwater by zero-valent iron [J]. Chemosphere, 2005,59(33):377-386.
[12]Wilkin R T, Su C, Ford R G, et al. Chromium-removal processes during groundwater remediation by a zero-valent iron permeable reactive barrier [J]. Environmental Science and Technology,2005,39(12):4599-4605.
[13]Su C M, Puls R W. Nitrate reduction by zero-valent iron: Effects of formate, oxalate, citrate, chloride, sulfate, borate, and phosphate [J]. Environmental Science and Technology, 2004,38(9):2715-2720.

