桃叶杜鹃菌根显微结构及侵染情况
欧 静 ,刘仁阳 ,陈 训
桃叶杜鹃菌根显微结构及侵染情况
欧 静1,刘仁阳1,陈 训2
(1.贵州大学 林学院,贵州 贵阳 550025;2.贵州省科学院,贵州 贵阳 550001)
采用酸性品红染色法对贵州不同地域分布的桃叶杜鹃根系染色压片,对其菌根进行显微结构及菌根侵染情况观察。结果表明,野生桃叶杜鹃菌根结构复杂,根外被密集的菌丝包被形成菌丝鞘,无根毛,在菌根中具有杜鹃花类菌根特有典型结构菌丝结,也有穿梭于细胞间的有隔菌丝和束状菌丝等结构。野生植株菌根侵染指标较高;不同地域的菌根侵染指标差异显著,贵阳鹿冲关成年开花植株高于百里杜鹃方家坪成年开花植株;不同季节侵染指标两地春季高于夏季。分布于百里杜鹃的开花成年树侵染指标明显低于幼树。播种苗侵染指标较低,2a播种苗侵染指标较1a呈上升趋势。
桃叶杜鹃菌根;杜鹃花类菌根;显微结构;侵染指标
杜鹃花是我们传统十大名花之一,在国际园艺观赏植物中占有重要地位[1]。许多杜鹃花生长于土壤贫瘠,昼夜温差大的恶劣环境,其中菌根起到重要的作用。杜鹃花类菌根(Ericoid Mycorrhiza,ERM),又称为拟欧石楠类菌根,是杜鹃花科除浆果鹃属Arbutus、熊果属Arctostaphylos外植物根系与一些土壤真菌形成典型特征的共生体[2]。国外有较多报道证明ERM对杜鹃花类植物克服恶劣环境、加强吸收养分起到很重要的作用[3-5],接种菌株能大大提高杜鹃花的生长量[6-7]。我国虽然是杜鹃花的故乡,但关于ERM的研究却极少[8-9]。ERM皮层细胞中有不同于其它菌根的特殊结构,即菌丝结(hyphal coil)[2]。据资料,杜鹃花科拟欧石楠Calluna vulgaris 、越橘Vaccinium spp.、北美杜鹃花Rhododendron spp.、彭土杜鹃Rh. ponticum、马醉木Pieris spp.、石岩杜鹃变种 Rh.obtusum var.Kaempferi、云锦杜鹃Rh. fortunei、银叶杜鹃Rh.argyrophyllum 、繁花杜鹃Rh. floribundum等植物根系内具有ERM典型结构菌丝结[8-12]。
桃叶杜鹃Rhododendron annae Franch.,分布于我国西南地区,花清雅高洁或艳丽夺目,叶形美观,树冠圆满,花期5~6月,作为园艺观赏花卉极有开发潜力。近年来高山常绿杜鹃花得到了较多的重视[13-14],但对桃叶杜鹃的研究报道较少[15-16]。本文对桃叶杜鹃菌根显微结构及侵染情况进行报道,为桃叶杜鹃菌根化育苗及资源保护与利用提供基础依据,并对丰富ERM资源有较大意义。
1 材料与方法
1.1 采样地概况
根样材料分别采自贵州省贵阳市鹿冲关森林公园桃叶杜鹃模式标本产地和贵州百里杜鹃风景区普底方家坪桃叶杜鹃分布区。鹿冲关桃叶杜鹃产地位于东经 106°43′17″, 北纬 26°38′12″,海拔1 360~1 390 m,山地黄壤土,土层厚度30~80 cm,pH4.8~5.1,种群优势种为马尾松Pinus massoniana 和白栎Quercus fabri ,桃叶杜鹃数量较少,且几乎为成年树,幼树少见;百里杜鹃方家坪桃叶杜鹃分布区位于东经105°53′30″,北纬27°14′51″,海拔 1 800 ~ 1 830 m,硅质黄壤土,土层厚度20~50 cm,pH4.5~5.0,几乎为桃叶杜鹃纯林。
1.2 采样与试验方法
实验样地20 m×20 m,选择5株样本植株进行采集根样,记录株高、地径,鹿冲关菌根样编号为LCG-T,百里杜鹃方家坪菌根样编号为BL-T。分别在春、夏两季定点定样两批采样。3次重复,每重复样株之间距离100 m以上。1 a、2 a苗取自百里杜鹃风景区杜鹃苗圃,播种基质混有杜鹃林下土壤。样根均带土保湿放置于冰桶内带回实验室,存放4℃冰箱中备用。
菌根侵染观测采用酸性品红染色镜检法。步骤采用Komanik P P. 等(1980)方法[17]:洗根-透明-漂洗-软化-酸化-染色-脱色;随机取50根段,每根段8 mm左右长,5个一组镜检。3次重复。
1.3 侵染记录与计算
记录菌根侵染情况,计算侵染指标[18]。侵染分级标准分为0级(侵染比例0%)、1级(侵染比例<1%)、2 级(侵染比例<10%)、3级(侵染比例<50%)、4级(侵染比例<80%)、5级(侵染比例>90%);菌丝结丰富度(丰度)划分为E0:没有,E1:很少,E2:较多,E3:丰富。
侵染率F%=受侵染的根段数/观察的根总段数*100;
整个根系的菌根侵染强度M%=(95n5+70n4+30n3+5n2+n1)/全部根段数(n5表示:5级侵染的根段数;n4表示:4级侵染的根段数,等等);
侵染根段的菌根侵染强度m%=M*全部根段数/侵染根段数;
侵染根段的菌丝结丰度e%=(100mE3+50mE2+10mE1)/100;mE=((95n5E3+70n4E3+30n3E3+5n2E3+n1E3)/n)*100/m ;
整个根系的菌丝结丰度E%=e*M/100。
1.4 统计分析
使用EXCEL和SPSS软件进行数据统计分析及作图。
2 结果与分析
2.1 桃叶杜鹃菌根的形态结构及菌丝体形态
桃叶杜鹃根系由大量细弱如发的侧根组成,因此被称作发根。新生根为乳白色至淡黄色,老根大部分为棕色至深棕色。经过透明染色后,观察到侧根结构简单,由1层表皮细胞、1-2层皮层细胞和中柱组成,其根部被密集的根外菌丝所包围,形成菌丝鞘hyphal sheath(又称为菌套,见图1.A),无根毛结构。
被真菌侵染的菌根可见细胞增大现象,发根本身结构并未改变。菌根表皮细胞及皮层细胞内可见不同颜色深浅的菌丝,可见ERM特殊结构菌丝结hyphal coil (又称为菌丝团或菌丝卷,见图1.BCL)。菌丝结大多在皮层细胞中央分布,有些几乎充满整个细胞(见图1.C)。有些菌根的菌丝结只单独在一个细胞内分布,而有的真菌菌丝体会穿过细胞进入另一个细胞内。菌丝复合体形态为菌丝群随意聚集、打结、延伸、反曲(见图1.DE)。入侵点在生长区与伸长区均有见,入侵菌丝在侵入点附近较细,进入细胞内部后明显变粗,侵入点的菌丝有单菌丝(见图1.C,箭头所示为入侵点)和多菌丝等形式(见图1.F,箭头所示为入侵点)。个别根的皮层内观察到泡囊结构(见图1.G)。
在桃叶杜鹃根内还发现在侧根的分支处可见较多的染色较深的物质积累 (见图1.H)。穿梭于细胞间的有隔菌丝(见图1.I,箭头示隔)和束状菌丝(见图1.J)也在样根中发现。另外,在同一个菌根上观察到分布于细胞内、细胞间和细胞外的菌丝结构(见图1.K)。
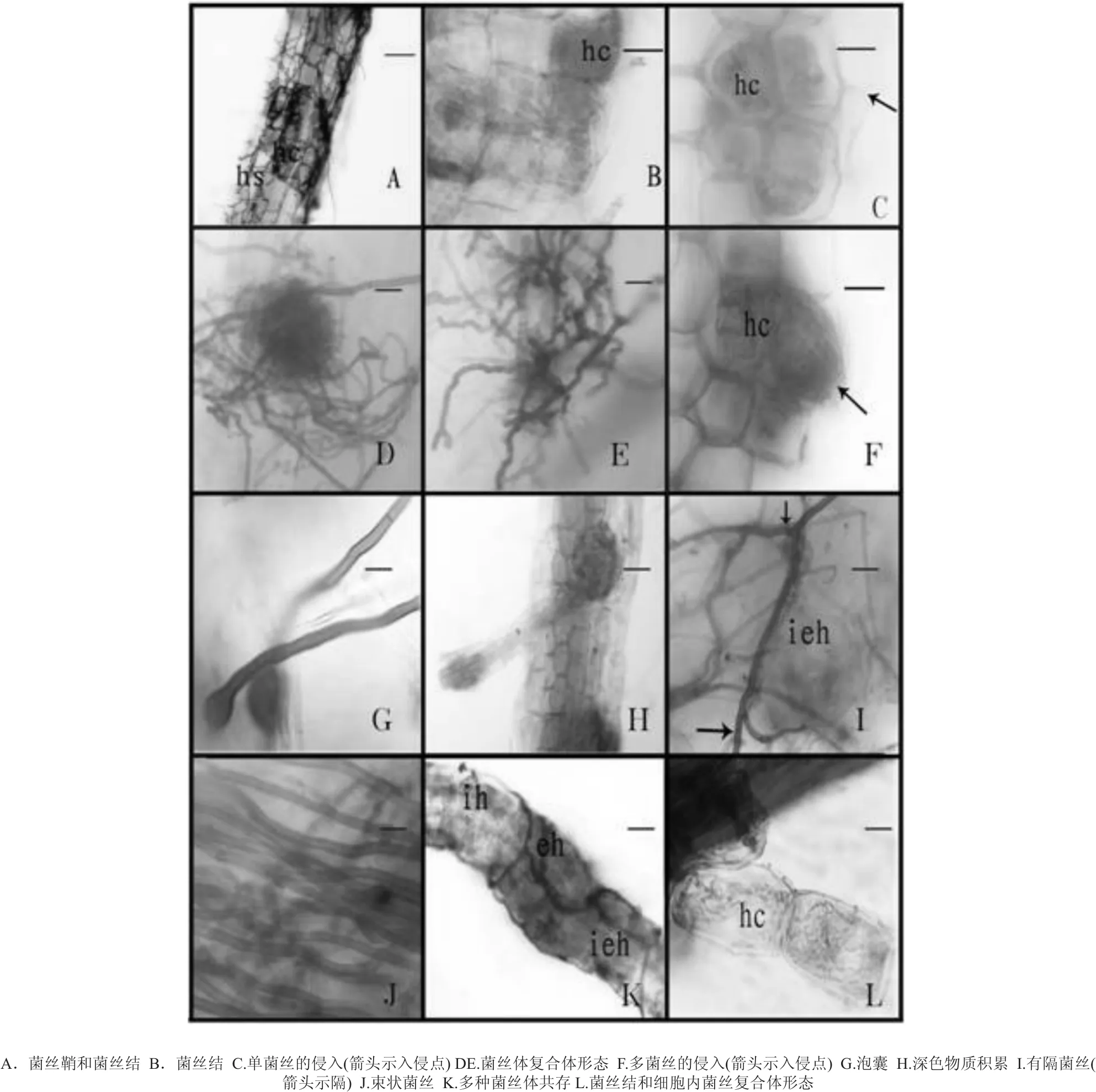
图1 桃叶杜鹃侧根显微结构(A,H,K标尺=25 μm;其它标尺=15 μm)Fig.1 Microstructure of hair root of R. annae (A,H,K Bars correspond to 25μm;other Bars correspond to 15μm)
2.2 不同分布地桃叶杜鹃菌根形态结构
从表1可能看出,在不同的分布地,桃叶杜鹃菌根的形态结构有所差异。百里杜鹃分布区的样根内大多数具有ERM典型结构菌丝结,而在鹿冲关分布区则观察到更多复杂的菌根结构。
2.3 桃叶杜鹃根系真菌侵染情况
2.3.1 不同分布地野生桃叶杜鹃根系真菌侵染比较
对不同分布地,株高与地径相近的野生桃叶杜鹃菌根侵染情况测定计算。结果表明,两地桃叶杜鹃根系均完全形成菌根,侵染率为100%(见表2)。从图2可以看出,LCG-T菌根春夏两季其它侵染指标显著大于BL-T菌根(P<0.05)。LCG-T1全根系及侵染根系的侵染强度、侵染根系的菌丝结丰度指标分别比BL-T1高出32.64%、10.93%、31.9% 。LCG-T2全根系及侵染根系的侵染强度、侵染根系的菌丝结丰度指标分别比BL-T2高出39.2%、25.77%、44.54%。

表1 不同分布区桃叶杜鹃菌根形态†Table 1 Mycorrhizal morphology of R. annae from different distribution regiongs
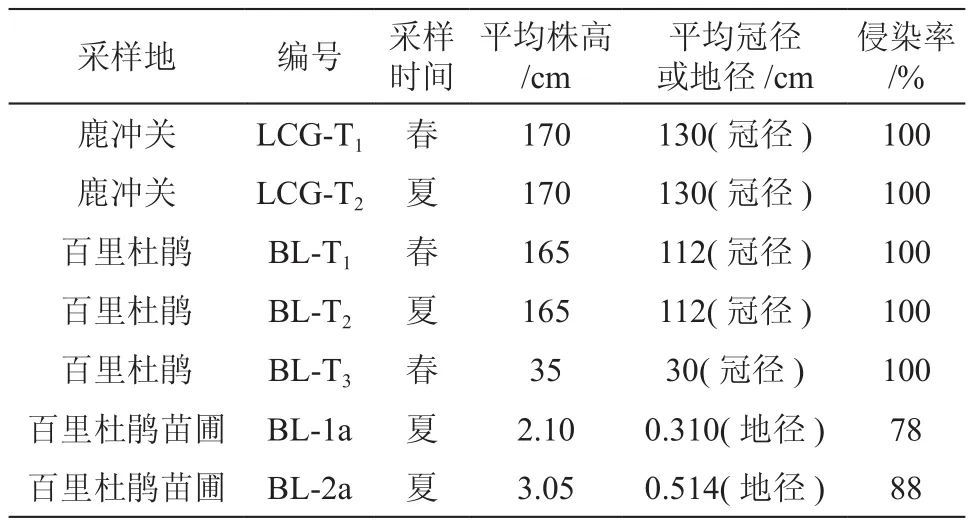
表2 桃叶杜鹃菌根侵染率Table 2 Comparison of mycorrhiza infection of R. annae

图2 不同分布区菌根侵染比较Fig.2 Mycorrhizal colonization in different distribution area
2.3.2 不同季节野生桃叶杜鹃菌根真菌侵染比较
分 析 春 季 (LCG-T1、BL-T1)和 夏 季(LCG-T2、BL-T2)两地野生桃叶杜鹃根系侵染情况。结果为:在春夏两季桃叶杜鹃根系均完全形成菌根,侵染率为100%(见表2);其它侵染指标两地春季几乎全部高于夏季(见图2)。从图中可以看出,LCG菌根春夏两季侵染变化小,而BL菌根春夏两季侵染则变化较大。经方差分析,菌根侵染率受季节影响差异不显著(P<0.05)。
2.3.3 成年开花植株与幼树菌根侵染比较
春季采集于百里杜鹃方家坪成年开花植株菌根(BL-T1)与幼树(BL-T3)菌根侵染情况测定。结果表明,不论植株高低,野生桃叶杜鹃根系均完全形成菌根,侵染率为100%(见表2)。其它指标BL-T3明显高于BL-T1菌根,BL-T3根系及侵染根系的侵染强度、菌丝结丰度指标分别比BL-T1高出43.64%、29.47%、53.3% (见图3)。经方差分析,幼树与成熟开花树菌根侵染率差异显著(P<0.05)。

图3 成年开花树与幼树菌根侵染比较Fig.3 Mycorrhizal colonization with different standard
2.3.4 播种苗根系菌根侵染情况
1a、2a播种苗的侵染率相对较低,且差异不显著(见表2)。从图4中可能看出,1a、2a苗总侵染强度、菌根菌丝结丰度指标很低,但侵染根段的菌丝结丰度相对其它指标高很多,这说明桃叶杜鹃菌根浸染首先形成ERM的潜力很大。2a苗侵染指标较1a呈上升趋势,侵染根段菌丝结丰度已近50%。

图4 1a、2a播种苗侵染比较Fig.4 Seedlings colonization of 1a, 2a
3 讨 论
3.1 桃叶杜鹃菌根结构
杜鹃花类菌根是一类复杂的菌根[8],一株植株根系常会结合多种类型菌根菌[19]。吴重华等[20]在冷杉林下的金背杜鹃(Rh. clementinae subsp.aureodorsale)根系中发现了3种与其形成外生菌根的真菌。Vohník和Albrechtová(2011年)对欧洲的六种杜鹃花菌根进行研究,发现它们的根内同时存在有ERM真菌、深色有隔的内生真菌和其它真菌[21]。Setaro等[22]对生长于厄瓜多尔南部热带高山雨林的杜鹃花科植物Cavendishia nobilis var. capitata Sebacinales菌根进行了研究,指出其菌根为特殊的内外生菌根,其菌根中的蜡壳耳目(Sebacinales)是一类既能形成菌丝鞘、同时在细胞间穿越和侵入细胞内形成菌丝结结构的真菌。通过染色观察,发现桃叶杜鹃菌根具有ERM特有的、典型的菌丝结,属于ERM菌根。但在桃叶杜鹃菌根(主要为LCG-T菌根)中还出现了丛枝菌根(AM)及外生菌根(ECM)具有的一些结构特点,这与贾锐等观察兴安杜鹃菌根的结果相似[23],但形成这些菌根结构是哪类或哪几类真菌,还需要进一步研究。
3.2 桃叶杜鹃复杂菌根结构形成的原因
郑钰等[7]认为杜鹃花植物菌根形成外生菌根是因为常处于林下层的杜鹃花类植物,通过与外生菌根植物共生的同一种真菌菌丝体整合到森林的公共菌丝体网络,成为森林内部以公共菌丝体网络为中介的资源再分配活动的参与者,作者指出这可能对于它们适应多样的生境具有重要意义。鹿冲关森林公园为桃叶杜鹃模式产地,生物种类繁多,树林郁闭较高,桃叶杜鹃生长于林下为中下层灌木。桃叶杜鹃复杂的菌根结构由多种真菌侵入引起,可能是维持该物种在复杂环境中生存的一种方式。
有学者认为杜鹃花菌根内同时存在ERM和其它内生菌根的原因是因为分布的纬度与海拔不同[21]。BL-T分布海拔较高,各年龄阶段桃叶杜鹃菌根内多见菌丝结结构;LCG-T分布海拔较低,菌根真菌为复杂的菌根结构。从试验结果来看,两者之间是有一定差异,但造成分布地菌根结构的差异原因是否因纬度与海拔不同造成,还需要进一步研究。
3.3 桃叶杜鹃菌根真菌的侵染
ERM真菌的侵染受到地域环境的综合影响[1],菌根多样性与地上部分生物的多样性有相关性[24]。Grime等实验发现由于菌丝网络作用,人工小群落中的亚优势种能够在优势种的存在下得以生存,接种后的植物群落比不接种的对照组具有更高的植物多样性[25]。分布于鹿冲关森林公园的桃叶杜鹃菌根侵染率高,侵染强度大,原因可能与地上部分植被丰富有关,机理可能是通过森林菌根网络在同种或不同种植物间实现资源的重新分配和共享[26]。分布于百里杜鹃的桃叶杜鹃菌根侵染率及侵染强度稍低可能与其分布区几乎为纯林有关。通过对幼树菌根观察,发现菌根几乎为菌丝体占据,这与金背杜鹃纯林菌根侵染率很低的结果有所不同[20]。
幼树的侵染指标较成年树高,原因除了菌根能显著提高根系吸收营养的能力供其生长,还可能是方便幼树在更大范围内选择适合共生真菌[27]。
菌根在不同季节侵染率及侵染强度不同,生态环境条件是主要原因之一。如在西澳大利亚州的南部,由于季节性地中海气候,杜鹃花菌根真菌明显活动仅限于较冷湿的月份,在冬天到春天的一段时间菌根的侵染达到了最高[1,28]。桃叶杜鹃菌根侵染是否受到贵州亚热带高原季风湿润气候的影响需要作进一步的研究。百里杜鹃的桃叶杜鹃菌根春夏季侵染变化较大的原因,可能与生长在高海拔、昼夜温差大、长时间处于空气与土壤湿度均较大的环境中有关系。影响侵染率及侵染强度的另外一个原因是植物自身生长发育过程影响。桃叶杜鹃在春季开花,集中花期在5月,开花期需要更多的菌根来吸收营养物质,特别是对磷元素的获取[29]。桃叶杜鹃春季菌根侵染普遍高于夏季的情况及原因与梅(Prunus mume Sieb. et Zucc.)和兰(Orchis L. )类似[30-31]。
1a、2a播种苗培养基质中带有部分原生境真菌,因此播种苗具有一定的侵染,虽然侵染率相对野生较低,但说明桃叶杜鹃人工栽培条件下能形成ERM,这为桃叶杜鹃菌根化育苗提供了事实依据。2a苗侵染指标较1a呈上升趋势,这可能与ERM真菌选择、侵染时间和定居时间有关,然而是否与小苗的生长适应性有关需进一步研究。
从试验结果来看,幼苗—幼树—成年菌根侵染指标呈现低—高—低的变化趋势,变化产生的原因及对宿主的影响还需要更多的探索。
致谢:贵州大学生命科学学院江龙教授,林学院谢双喜教授;1a、2a桃叶杜鹃小苗由百里杜鹃林业局黄家涌提供。
[1] Dixon K W, Sivasithamparam K, Read D J. Ericoid Mycorrhizas in Plant Communities[J].Microorganisms in Plant Conservation and Biodiversity, 2004,227-239.
[2] Read D J.The structure and function of the ericoid mycorrhizal root[J].Annals of Botany,1996,77:365-374.
[3] Cairney J W G.Evolution of mycorrhiza systems[J].Naturwissens chaften,2000,87:467-475.
[4] Cairney J W G,Meharh A A. Ericoid mycorrhizal:A partnership that exploits harsh edaphic conditions[J].European Journal of Soil Science,2003,54:735-740.
[5] Sokolovski S G, Meharg Y A, Maathuis F J M. Calluna vulgaris root cells show increased capacity for amino acid uptake when colonized with the mycorrhizal fungus Hymenoscyphus ericae[J].New Phytologist.2002,155(3):525-530.
[6] Starrett M C,Blazich F A,Shafer S R, et al. In vitro colonization of micropropagated Pieris floribunda by ericoid mycorrhizae.Establishment of mycorrhizae on microshoots[J].Hort Science,2001,36(2):353-356.
[7] Strandberg M,Johannsson M.Uptake of nutrients in Calluna vulgaris seed plants growth with and without mycorrhizae[J].Forest Ecology and Management, 1999,114:129-135.
[8] 张春英,侯奕敏,戴思兰.云锦杜鹃菌根显微结构观察[J].园艺学报,2008,35(11):1641-1646.
[9] 郑 钰,高 博,孙立夫,等.银叶杜鹃和繁花杜鹃根部真菌的多样性[J].生物多样性,2010,18(1):76-82.
[10] Ashford A E,Allaway W G, Reed M L. A possible role of Lysinema ciliatum R. Br.&other Epacridaceae[J].Annals of Botany,1996,77:375-381.
[11] Massicotte H B,Melville L H,Peterson R L.Structural characteristics of root-fungal interactions for five ericaceous species in eastern Canada [J].Canadian Journal of Botany,2005,83:1057-1064.
[12] Usuki F, Junichi A P, Kakishima M.Diversity of ericoid mycorrhizl fungi isolated from hair roots of Rhododendron obtusum var. Kaempferi in a Japanese red pine forest[J].Mycoscience,2003,44:97–102.
[13] 徐小蓉,张习敏,牛晓娟,等.赤霉素+2,4-D及赤霉素+丁酰肼对马缨杜鹃光合作用日变化的影响[J].中南林业科技大学学报,2011,31(11):131-136.
[14] 李朝婵,赵云龙,张冬林,等.长蕊杜鹃扦插内源激素变化及解剖结构观察[J].林业科学研究,2012,25(3):360-365.
[15] 高贵龙,龙秀琴,胡小京,等.赤霉素对两种高山杜鹃种子发芽的影响[J].种子,2010,29(5):22-25
[16] 苗永美,王永清,庄 平,等.桃叶杜鹃组织培养技术研究[J].生物学杂志,2006,23(6):29-31.
[17] Komanik P P,Bryon W C,Schultz R C. Procedures and equipment for staining large numbers of plant root samples for endomycorrhizal assay[J].Canadian Journal of Microbiology,1980,26(4):536-538.
[18] Trouvelot A, Kough J L, Gianinazzi-Pearson V. Mesure du taux de mycorhization VA d´un système radiculaire.Recherche de méthodes d´estimation ayantune signification fonctionnelle.In:Physiological and Genetical Aspects of Mycorrhizoe,V.Gianinazzi-Pearsin and S.Gianinazzi(eds.).INRA Press, Paris,1986,217-221.
[19] Allen T R,Miller T,Berch S M, et al. Culturing and direct DNA extraction find different fungi from the same ericoid mycorrhizal roots[J].New Phytologist, 2003,160:255-272.
[20] 吴重华,王吉忍,杨俊秀,等.太白山自然保护区金背杜鹃菌根调查研究[J].西北林学院学报,2000,15(3):68-70.
[21] Vohník M and Albrechtová J.The Co-occurrence and Septate Endophytes in Roots of Six European Rhododendron Species,Folia Geobotanica, 2011, 15 March. published online(springer).
[22] Setaro S, Weiß M, Oberwinkler F, et al. Sebacinales form ectendomycorrhizas with Cavendishia nobilis, a member of the Andean clade of Ericaceae, in the mountain rain forest of southern Ecuador[J]. New Phytologist,2006,169: 355–365.
[23] 贾锐,杨秀丽,闫 伟.兴安杜鹃菌根形态特征和土壤理化性质的关系研究[J].内蒙古农业大学学报,2011,32(3):63-66.
[24] Peterson T A, Mueller W C, Englander L.Anatomy and ultrastructure of a Rhododendron root fungus association[J].Canadian Journal of Botany,1980,58:2421-2433.
[25] Grime J P,Mackey J M L,Hiller S H,et al. Floristic diversity in a model system using experimental microcosms[J].Nature,1987,328:420-422.
[26] 梁 宇,郭良栋,马克平.菌根真菌在生态系统中的作用[J].植物生态学报,2002,26(6):739-745
[27] Zettler L W,Pixkin K A,Stewart S I, et al.Protocom mycobionts of the federally threatened eastein prairie fringed orchid,Platanthera leucophaea(Nutt.)Lindley and a technique to prompt leaf elongation in seedlings[J]. Studies in Mycology, 2005,53:163-171.
[28] Kemp E, Adam P,Ashford A E.Seasonal changes in hair roots and mycorrhizal colonization in Woollsia pungens (Cav.) F. Muell.(Epacridaceae) [J].Plant and Soil,2003,250: 241-248.
[29] Dighton J, Coleman D C. Phosphorus relations of roots and mycorrhizas of Rhododendron maximum L. in the southern Appalachians North Carolina[J]. Mycorrhiza,1992,1:175-184.
[30] 蔡邦平,陈俊愉,张启翔,等.中国梅丛枝菌根侵染的调查研究[J].园艺学报,2008,35(4):599-602.
[31] 侯天文,金 辉,刘红霞,等.四川黄龙沟优势兰科植物菌根真菌多样性及其季节变化[J].生态学报,2010,30(13):3424-3432.
Study on microstructure and infections of Rhododendron annae mycorrhiza
OU Jing1, LIU Ren-yang1, CHEN Xun2
(1.Forestry College , Guizhou University, Guiyang 550025, Guizhou, China; 2.Guizhou Provincial Dept. of Science and Technology,Guiyang 550001, Guizhou ,China)
By using the acid fuchsin staining, the roots of Rhododendron annae Franch were dyed and squashed, which grows in Guizhou province, and the microstructure and mycorrhizal colonization were observed. The results show that the lateral roots of ferine R. annae have complex structure, were enwrap by dense hypase to form hyphal sheath on the outside of the roots and there was no root hair; There were intracellular hyphal knots which are the unique and typical structure of ericoid mycorrhiza, there also were a few septate hypha and fasciculate hyphae structure. Wild plant infection index was higher, the indexes differences of the infected roots in different regions were remarkable, the indexes of Luchonghuang mycorrhiza of adult flowering plant were higher than Fangjiaping’s; In different seasons, the rates in spring were higher than that in summer; The indexes of flowering adult tree were obviously less than that young tree. Sowing seedlings’ index was lower. The infection indexes of 2-year-old sowing seedlings showed a rising trend compared with that of 1-year-old.
Rhododendron annae mycorrhiza;ericoid mycorrhiza;microstructure;infection index
S718.8
A
1673-923X(2012)11-0028-06
2012-10-10
贵州省农业科技攻关项目(黔科合NY字[2011]3076号)
欧 静(1974-),女,贵州威宁人,副教授,主要从事森林培育与种苗培育研究工作, E-mail:coloroj@126.com
陈 训(1956-),男,贵州赫章人,研究员,博导,主要从事森林培育与种苗培育研究工作;E-mail:chenxunke1956@163.com
[本文编校:吴 毅]

