理想气体p-V图上直线过程的温度与热量变化的分析*
任海林
(南京理工大学机械工程学院 江苏 南京 210094)
谭伟石 徐 浦
(南京理工大学应用物理系 江苏 南京 210094)
1 引言
在理想气体p-V图上的直线过程有四种,分别是:
(1)等压过程p=C;
(2)等容过程V=C;
(3)直线过程p=KV+C(K>0);
(4)直线过程p=-KV+C(K>0,C>0).
以上4式中C为常量,K为比例系数.其中(3)和(4)直线过程在大学物理教材[1,2]里都有详细讨论,本文只做概略性的论述,重点讨论后面两种过程.
从实际的物理意义来考虑,在研究理想气体的性质时,应该将其状态变化范围限定于p>0,V>0,T≥0,其中T=0为绝对零度,存在理论研究的意义.对于理想气体而言,p=0是不可达到的,而V=0是没有意义的.所以,本文所指理想气体的状态,在p-V图中仅限于第一象限区域,并去除p轴和V轴上的状态点,即p=0和V=0的状态点.
2 四种直线过程的讨论
2. 1 等压过程p=C
假设过程是由初态A到终态B,即等压膨胀过程,如图1(a)所示.TA和TB分别为ν摩尔理想气体在初态A和终态B的热力学温度.
由理想气体状态方程pV=νRT可得,当p=C时,T与V的函数关系为,如图1(b)所示.

图1 理想气体的等压膨胀过程
根据热力学第一定律,并考虑到理想气体的内能是温度的单值函数,在从初态A到终态B的等压膨胀过程中气体的温度升高,内能增加,同时,气体一直对外做功.所以,由A到B的过程中,理想气体始终是吸热的,吸热量为
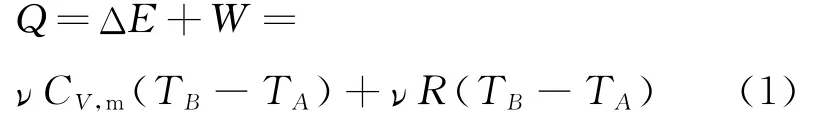
式中CV,m为理想气体的定容摩尔热容.
等压膨胀过程中,理想气体始终吸热,所吸收的热量一部分用来提高自身的内能,另一部分用来对外做功.
2. 2 等容过程V=C
图2(a)所示为理想气体的等容升压过程示意图.由理想气体状态方程pV=νRT,可得当V=C时,T与p的函数关系为,如图2(b)所示.

图2 理想气体的等容升压过程
由初态A到终态B的等容升压过程中,理想气体的温度上升,内能增加,对外做功为零,气体始终吸热,所吸收的热量全部用来增加自身的内能.

2. 3 直线过程p=KV+C(K>0)
2.3.1 C≠0的情况
如图3(a)所示的实线过程,理想气体沿该直线由初态A变化到终态B,显然TB>TA.

图3 理想气体直线过程p=KV+C
对于直线上的任何一点,其状态参量总满足理想气体状态方程pV=νRT,将p=KV+C(K>0)代入可得
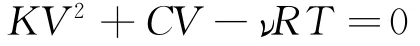
这样得到直线上任意一点的体积V与温度T的关系

图3(b)所示为此直线过程的T-V曲线示意图.由图可知,对于V>0时,T随着V的增加而升高,所以从初态A到终态B的过程中温度单调升高,内能不断增加.理想气体内能的改变量为

由初态A到终态B的过程中,气体始终对外做功

所以理想气体由初态A到终态B的直线过程中吸热量为

和等压膨胀过程相似,在升温的直线过程p=KV+C(K>0)中,理想气体始终吸热,所吸收的热量一部分用来提高自身的内能,另一部分用来对外做功.
2.3.2 C=0的情况
C=0是直线过程p=KV+C(K>0)的一个特殊情况,此时,理想气体沿过原点的直线由初态A到终态B,如图3(a)中的虚线过程所示.在这种情况下,能量转换关系没有特殊之处.全过程中理想气体均吸收热量,一部分用来提高自身的内能,另一部分用来对外做功.

2. 4 直线过程p=-KV+C(K>0,C>0)

图4(a)所示的p-V图上直线方程为

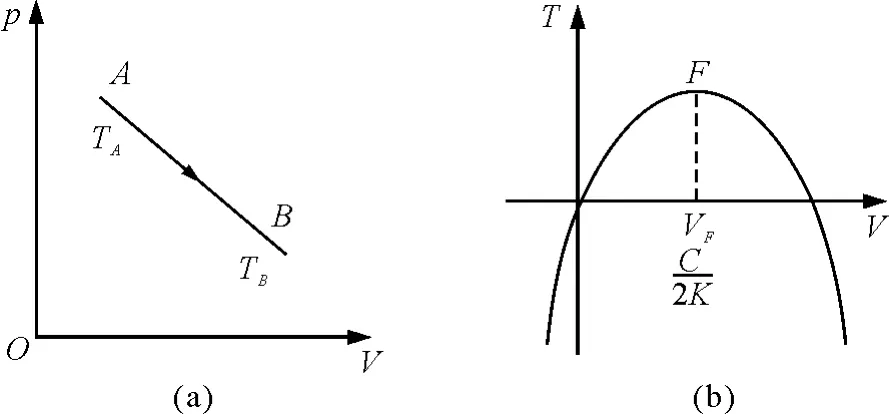
图4 理想气体直线过程p=-KV+C(K>0,C>0)

结合理想气体的状态方程和直线过程方程,考虑到V>0,可以得到T与V的函数关系为该情况的T-V曲线如图4(b)所示.从图4(b)可以看出,该过程中初态A和终态B的温度TA和TB的相对大小与直线斜率的绝对值K,常量C,状态参量VA和VB等多种因素有关.
由初态A到终态B的过程中,理想气体的体积膨胀,一直对外做功.气体对外做功为
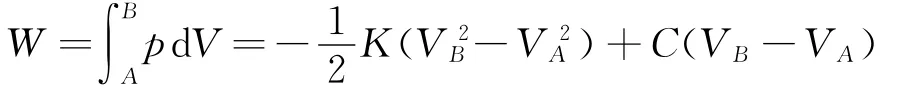
理想气体的内能改变量为

理想气体的净吸热量为
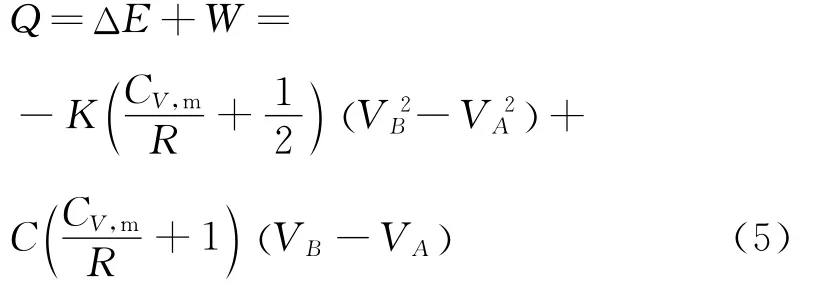
2. 4.2 直线过程能量转化的具体分析
现在要讨论的问题是,在这个直线过程中理想气体系统是净吸热、净放热还是吸放热的总量正好抵消呢?需要具体分析一下这个过程的能量转化情况.
如图4(b)所示,设AB直线过程中温度最高点
为F.显然温度最高点F处气体体积VF为,压强pF为,温度TF为.F点的位置和AB直线斜率的绝对值K和常量C的大小有关.按K值大小分为两种情况讨论.
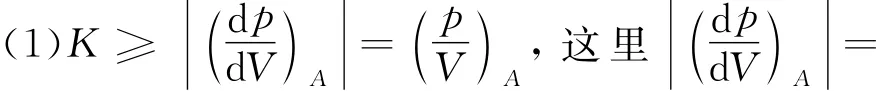
是温度为TA的等温线在A点处切线斜率的绝对值.

考虑到G点也应该在直线AB上,可以求得G点的体积参量为

显然,只有当VA=VF<VG<VB时,G点位于线段AB上,在该降温的直线过程中存在吸热和放热的转换点,在从初态A到状态G的过程中吸热,在从状态G到终态B的过程中放热.当VG<VA=VF时,该降温过程全程放热,当VG>VB时,该降温过程全程吸热.时,气体由初态A到终态B的直线过程中可能经历两种情况:始终升温(VB<VF)或者先升温后降温(VB>VF).

因为在整个过程中可能存在升温和降温两个过程,能量转换关系比较复杂.如果从热量的角度来讲,可能存在吸热和放热两种不同的情况.那么,在AB过程中是否必然存在一个吸热和放热的转换点呢?如果存在,这个转换点是否就是温度最高点F?毫无疑问,该转换点存在时,其体积参量仍然可用式(7)表示,而且必有.至于该转换点是否存在,还取决于过程终态B的体积参量的大小,若则该转换点存在.
若转换点存在,必须γ=1时才有

也就是说转换点和温度最高点重合.很显然,这是不可能的,因为.所以转换点(若存在)和温度最高点是不重合的,准确地说必有VG>VF.
2.4.3 两种特殊情况
最后讨论直线过程p=-KV+C(K>0,C>0)中的两种特殊情况.
(1)理想气体系统净吸热为零
在这种情况下,终态B的体积参量是多少呢?根据式(5)
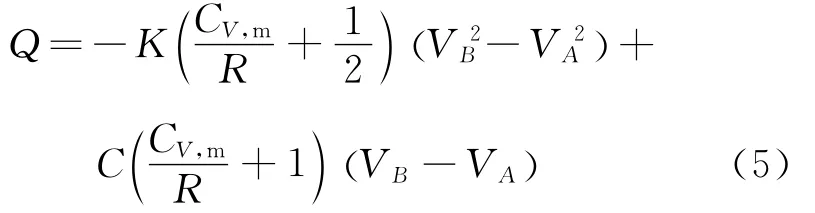
令Q=0,得到

对于理想气体系统而言,V必须大于零,所以只有当初态A的体积满足条件线过程中才能存在一个状态B,使得由状态A到状态B的净吸热量为零.在这种情况下,吸热与放热的时,在直转换点仍然用表示.容易验证,此时G点正好是AB线段的中点.
(2)TA=TB初态A和终态B位于同一条等温线上
对于等温过程,有pAVA=pBVB,代入直线方程p=-KV+C(K>0,C>0)

在AB直线过程中温度最高点F的体积为

式(8)说明F即为AB线段的中点.此时,吸热和放热的转换点G的体积为

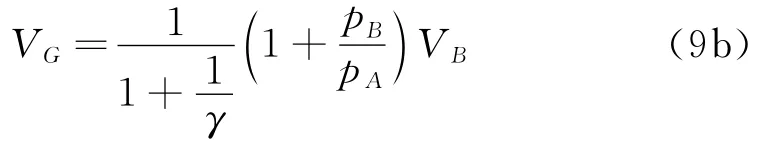
[1]第193页的例4.8属于式(10a)的情形,该例题计算得到的吸热放热转换点的体积与利用本文式(9a)的计算结果一致.
[2]第263页的习题7-19属于式(10b)的情形,可以利用本文式(9a)很方便地计算得到吸热放热转换点的体积.
3 结语
本文详细讨论了理想气体p-V图上四种直线过程的能量转换关系和温度变化情况,其中斜率为负的直线过程中的能量转换关系比较复杂,系统吸收热量还是放出热量既与直线过程方程的斜率和截距有关,还与过程初态和终态的状态参量有关,实际应用时需要具体分析.在讨论直线过程的能量转换关系和包含直线过程的循环过程的效率等问题时,本文的结果具有参考价值.
参考文献
1 秦允豪.热学.北京:高等教育出版社,1999
2 邓开明,等.大学物理(上).北京:机械工业出版社,2005

