国产高通量透析器在血液透析治疗中的有效性和安全性评估
徐 斌 张 文 龚德华 李 川 刘志红 季大玺
中空纤维膜透析器已在临床应用50余年[1,2],目前公认聚砜膜空心纤维透析器疗效最佳。随着高通透性膜的发展,20世纪80年代中期出现了高通量透析(HFHD)技术[3,4],要求透析器膜的孔径和面积较大,膜较薄,对水和溶质的通透性高,超滤系数大,不仅能有效清除中、小分子毒素,而且能通过对流、吸附方式清除部分低分子量蛋白,改善透析患者远期预后,减少透析相关性并发症[5],提高慢性透析患者的生存率[6],但国内目前临床使用的HFHD透析器主要依赖进口。威海威高血液净化制品有限公司开发的聚砜膜空心纤维透析器(HF12、HF16),超滤系数分别为25 ml/min和40 ml/min,属于高通透性透析器,目前尚未在国内临床正式使用。本研究经国家食品药品监督管理局批准,验证国产高通量聚砜膜空心纤维透析器(HF12、HF16)的临床有效性和安全性。
对象和方法
研究对象 采用随机平行对照设计,选取南京军区南京总医院全军肾脏病研究所血液净化中心维持性血液透析(MHD)患者135例,所有通过筛选评估,符合研究方案入选标准的受试者,随机分成三组,每组45例,分别为HF12试验组、HF16试验组和F60S对照组,分别使用HF12、HF16和F60S透析器行血液透析(HD)治疗1次。
入选标准 (1)年龄18~65岁,性别不限;(2)需要进行HD治疗的患者;(3)自愿参加并签署书面知情同意书。
排除标准 (1)严重感染、发热、血小板和白细胞减少、有凝血障碍者;(2)患有精神性疾病、无自制力、不能明确表达者;(3)妊娠及哺乳期妇女及近期准备生育者;(4)3月内参加过其他临床试验者;(5)既往对体外循环管路及滤器有过敏史者。
剔除标准 (1)入选后经临床检查符合排除标准者;(2)在试验过程中违反试验方案者;(3)自动退出者。
中止试验标准 (1)试验过程中患者原有症状加重或出现新症状者(如证实症状由验证透析器引起,则该病例应列入不良反应);(2)因合并其他的严重疾病而不适合继续进行HD治疗者;(3)申办者或研究者要求中止试验;(4)国家或省食品药品监督管理局、伦理委员会等要求中止试验。
临床试验用透析器 HF12和HF16透析器为威海威高血液净化制品有限公司生产,对照组F60S透析器为德国费森尤斯公司生产。相关参数见表1。
HD治疗方案 所有受试者均已行规律性HD,3次/周,4h/次。颈内静脉导管或动静脉内瘘为血管通路,普通肝素抗凝(首剂量0.3~0.5 mg/kg,追加剂量5~10 mg/h),血流量250 ml/min,透析液流速500 ml/min。HD机器品牌不限,但都具有容量调控,包括 AK95s(Gambro)及4008s(Fresenius)型透析机,按要求安装管路,连接透析器及管路,建立体外循环。

表1 各组采用透析器的相关参数
有效性评价
透析器溶质清除率检测 患者透析开始后60 min,固定工作状态下血流量和透析液流量不变,设置超滤率为0,10s后分别于透析器血液侧入口、出口处采血,测定尿素氮(BUN)、肌酐(SCr)、磷酸盐(P)和 β2微球蛋白(β2-MG)。用下列公式计算溶质清除率:
K=(CBI-CBO)×QBI/CBI
K:清除率(ml/min);CBI:透析器血液入口处的溶质浓度;CBO:透析器血液出口处的溶质浓度;QBI:产品入口处血流量(ml/min)。
透析器溶质下降率检测 在透析开始和结束时采血,停止超滤,血流量先减至100 ml/min,停泵10s后于透析器血液侧入口处采血,查血常规、BUN、SCr、P、β2-MG 及甲状旁腺素(PTH)。用下列公式计算溶质下降率:
透析溶质下降率(%)=(1-透析后浓度/透析前浓度)×100
透析后β2-MG实测值根据细胞外液容积变化进行校正
Cβ2-MGpost=Coβ2-MGpost(Wtpost-0.8Wttarget)/(Wtpre-0.8Wttarget)
Cβ2-MGpost:透析后校正浓度;Coβ2-MGpost:透析后实测浓度;Wtpre、Wtpost、Wttarget分别为透析前、后体重及干体重。
疗效评价
主要指标 BUN、β2-MG的清除率和下降率 。
次要疗效指标 SCr、P清除率和下降率,PTH下降率。
安全性评价 结合患者血液透析前后血常规、主客观症状及管路有无异常进行综合评价。
实验室指标 治疗前后血常规(红细胞、血红蛋白、白细胞、血小板)、白蛋白、球蛋白、补体C3的变化情况。
临床观察项目 (1)生命体征;(2)治疗期间患者是否有心悸、发热、皮疹、皮肤潮红、皮肤瘙痒及其他不适症状;(3)治疗中溶血发生率;(4)治疗中破膜现象的发生率;(5)是否出现其他不良反应。
透析器的适用性评价 (1)外包装袋是否严密、易撕开,便于使用;(2)标识是否清楚;(3)与透析仪器管路连接处有无漏液现象。
统计学分析 采用SPSS 16.0统计软件对数据资料进行统计分析。正态分布计量资料采用均值±标准差表示,各组间或同组内治疗前、后比较采用t或ANOVA检验,方差不齐者采用非参数秩和检验;计数资料采用例数和百分比描述,各组间或同组内治疗前、后比较采用χ2检验。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
基本资料 各组均入选患者45例。其中HF12组男性22例,女性23例,平均年龄39±12岁(19~62岁);HF16组男性33例,女性12例,平均年龄39±11岁(22~57岁);F60S组男性30例,女性15例,平均年龄40±11岁(19~61岁)。各组年龄和性别构成无差异。
透析器溶质清除率 对照组透析器BUN清除率略高于试验组,HF16组β2-MG清除率略高于其他两种透析器,三组透析器溶质清除率相比无统计学差异(表2)。
溶质下降率 HF12组BUN、SCr、P的溶质下降率略高于HF16组,HF16组略高于F60S组;HF16组的β2-MG和PTH的溶质下降率略高于F60S组,F60S组高于HF12组。三组患者溶质下降率之间均无统计学差异(表3)。
实验室安全性指标评价 试验组和对照组患者在透析前后外周血白细胞、血小板、白蛋白均在在正常范围;外周血红蛋白低于正常范围,对照组透析后白蛋白较透析前有明显升高(P<0.05),其他指标试验组与对照组以及每组透析前与透析后相比均无统计学差异(表4)。
不良反应 全部病例均顺利完成治疗,透析过程中患者生命体征稳定,均无不良反应,未发生透析器溶血及破膜现象,采用普通肝素抗凝剂能达到满意抗凝效果。
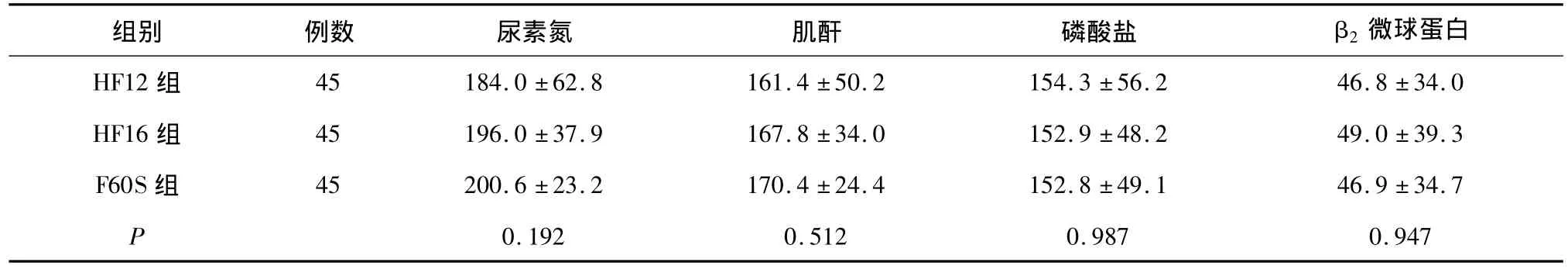
表2 各组溶质清除率比较(ml/min)

表3 各组溶质下降率比较(%)
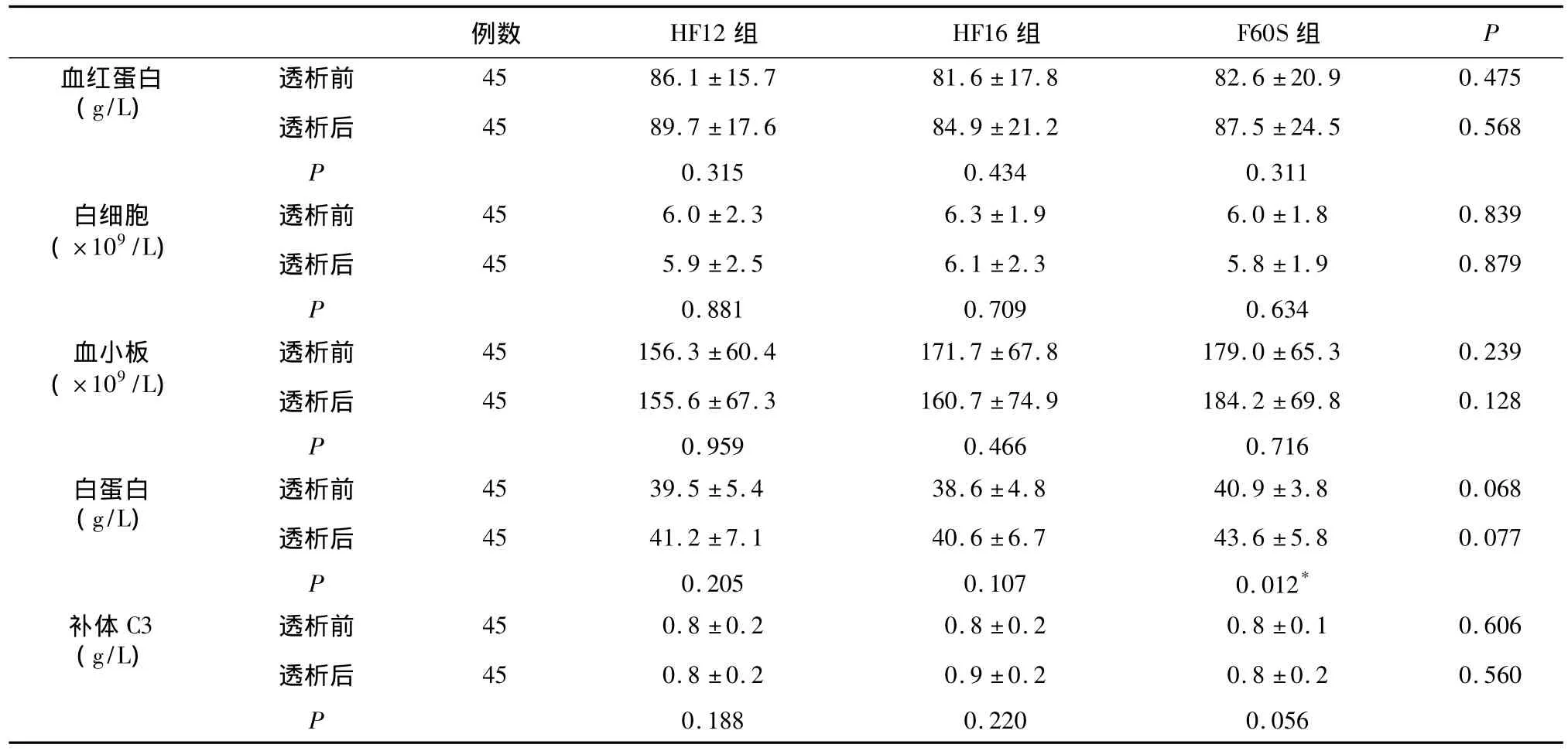
表4 各组安全性指标比较
讨 论
HD作为终末期肾病的有效治疗方法,已临床应用80多年[7],透析器是HD的关键,通过弥散、对流或吸附方式来清除溶质,其清除能力是由透析膜的结构、膜孔大小、数量和构型所决定[8]。本研究中的三种透析器均为聚砜中空纤维透析器,聚砜膜材料是生物相容性和功能有效性最好的材料之一[9]。目前越来越多的透析中心对MHD患者进行高通量透析。NIH HEMO研究小组认为透析器超滤系数(KUF)>14 ml/(h·mmHg)即可定义为高通量透析器[10],高通量透析器对包括低分子蛋白在内的中大分子物质的清除显著增加,清除方式也从单纯弥散方式变为弥散、对流和吸附相结合,因此中分子物质的清除还要取决于透析器有效面积和治疗时间。本研究中HF12和HF16透析器与对照组F60S进口透析器相比,具有相同的膜材料,相同的纤维内经及纤维厚度,并且均达到了高通量透析器的标准。
国产高通量透析器的有效性 本研究将BUN、β2-MG的清除率和下降率作为透析器有效性的主要评价指标。BUN作为尿毒症的小分子毒素已早被大家所认知,其清除率和下降率可作为评价小分子物质透析充分性的主要指标。HF12组、HF16组患者的BUN清除率和下降率分别为(184.0±62.8)ml/min、(196.0±37.9)ml/min和65.0% ±11.3%、63.9%±8.1%与对照组F60S[(200.6±23.2)ml/min、63.4% ±8.9%]相当(P >0.05),并且三种透析器BUN清除率均>180 ml/min,BUN下降率均>60%,提示三种透析器能较好地清除小分子毒素。HF16透析器虽然有最大的膜面积、最大的血室容积和与F60S一样的超滤率,但它对小分子毒素(包括BUN、SCr和P)的清除并未明显优于(甚至有的指标略低于)另外两种透析器,我们认为这与小分子毒素的透析清除机制有关,即主要取决于血液侧与透析液侧的溶质浓度差,而与膜面积、过高的超滤率关系不大,这与中分子物质的透析清除不同。中分子有害物质在MHD患者中的危害逐渐被大家重视,其中以β2-MG最具有代表性。它是一种相对分子质量为11 800D的蛋白质,95%经肾小球滤过,其在透析患者体内的积聚是造成透析相关淀粉样变(DRA)发生的主要原因[7],多中心临床试验HEMO结果表明,高血清β2-MG水平与MHD患者的长期生存率低显著相关[11]。因此临床上研发了高通量透析器,以便更好地清除中分子有害物质,减少与透析相关的慢性并发症。β2-MG作为透析器清除中分子物质充分性的评价指标,弥补了小分子透析充分性指标单一的片面性。临床上β2-MG清除率>20 ml/min即为高通量透析[10],也有研究认为每次透析β2-MG清除百分比应保证>40%[12]。本研究中的三种透析器的β2-MG清除率均>40 ml/min且下降>40%,提示对中分子物质有较好的清除效果。HF16组的β2-MG的清除率和下降率为(49.0±39.3)ml/min和47.0% ±15.0%,高于另外两组(P>0.05),我们认为其原因可能在于中分子物质清除率除与较高的超滤率的对流作用有关外还与透析器对β2-MG的吸附有关,HF16的膜面积、血室容积及膜的吸附能力均大于其他两种透析器。中分子溶质主要是通过吸附途径清除,仅少量通过弥散清除,一定程度的膜通透性变化对其清除率影响不大,而膜的有效面积则影响较大。但也有文献报道,聚砜膜对β2-MG的总清除中吸附所占比例<20%,主要通过弥散/对流方式进行[13]。
高磷血症是影响MHD患者生存质量和增加死亡率的危险因素[14]。血磷升高可诱发甲状旁腺功能亢进,从而导致肾性骨病,皮肤瘙痒、高脂血症及神经传导速度减慢等并发症。P是分子量<500D的小分子毒物,血磷和聚砜膜都带负电荷,其相斥性决定了延长透析时间并不能增加对磷的清除[12]。本研究中HF12组对磷的清除率和下降率略高于HF16组和F60S组(P>0.05),除考虑与电荷相关外,还需更多的临床试验来验证。63.6%的MHD患者存在着不同程度的继发性甲状旁腺功能亢进症,PTH是分子量为9 500D的中分子毒素,HF16组的PTH下降率为48.9% ±33.5%,略高于其他两组,考虑其机制同β2-MG的清除。
国产高通量透析器的安全性 除了有效性外,在临床治疗上更注重透析器的安全性。虽然目前认为HFHD是一种较安全、易行、高效的血液净化方法,但另一方面也要考虑HFHD对某些营养物质(如氨基酸、白蛋白)的清除增加和因反超等因素带来的不良反应[15],如存在反超滤、致热原反应相对较高以及高敏反应。同时由于水和溶质清除速率较快,低血压和失衡综合征等并发症的发生率较常规HD高[16]。本研究的所有患者在透析过程中生命体征稳定,未发生低血压、头痛、心悸及抽搐症状,未发生透析器溶血及破膜现象。此外透析膜的生物相容性也直接关系到MHD患者的生活质量与生存率。生物相容性是指使用透析器进行HD时,宿主不引起明显的临床反应,即无血栓形成、无毒性、无过敏或炎症反应、无破坏血细胞作用,不激活补体。目前大多数人认为聚砜膜是一种生物相容性较好的膜材料,对激肽系统的激活、凝血物质的产生、组织胺释放和各种细胞因子产生影响较小。试验组和对照组患者透析后血红蛋白、白蛋白水平及补体C3较透析前略有升高,考虑与HD超滤脱水导致血液浓缩有关。试验组患者血小板在透析后出现轻度下降,对照组则轻度上升,试验组和对照组透析后的白细胞较透析前略有下降,但血小板和白细胞都在正常范围,且波动幅度很小,因此我们认为这三种透析器均有较好的生物相容性。对于临床上出现的明显血小板减少较为多见的原因是肝素诱导的血小板减少症(HIT),O'Shea等[17]报道血液透析患者 HIT 发生率为0~12%,而 Jang和 Hursting[18]报道 HD 患者中的发生率约3.2%,也有报道称血小板的激活和HIT可与补体激活有关,血液与生物材料接触后也可能诱导补体介导的急性炎症反应[19]。
综上所述,本文使用的国产高通量 HF12和HF16型聚砜膜空心纤维透析器不仅对BUN、SCr和P等小分子毒素有良好的清除作用,对于β2-MG、PTH中分子物质也有良好的清除效果,且生物相容性较好。与德国费森尤斯公司生产的高通量聚砜膜中空纤维透析器F60S比较,其临床使用性能和安全性无明显差异。因此,本研究认为国产高通量HF12、HF16透析器临床试验安全、有效,可用于尿毒症患者HD治疗。
1 Gotch F,Lipps B,Weaver J Jr,et al.Chronic hemodialysis with the hollow fiber artificial kidney(HFAK).Trans Am Soc Artif Intern Organs,1969,15:87 -96.
2 Morti S,Shao Jh,Zydney AL.Importance of asymmetric structure in determining mass transport characteristics of hollow fiber hemodialyzers.J Membr Sci,2003,224(1/2):39 - 49.
3 Streicher E,Schneider H.The next generation of dialysis membracesbarriers or pathways Contrib Nephrol,1985,44:127 - 136.
4 郝继英,王质刚.高通量透析的临床研究.肾脏病与透析肾移植杂志,1998,7(2):130 -133.
5 陈欣,季大玺.高通量血液透析.肾脏病与透析肾移植杂志,2005,14(1):78-81.
6 Bosch JP,Lew SQ,Barlee V,et al.Clinical use of high-efficiency hemodialysis treatments:Long-term assessment.Hemodial Int,2006,10(1):73-81.
7 周亦伦.透析相关性淀粉样变//王质刚.血液净化学.第3版.北京:科学技术出版社,2010:764-772.
8 Locatelli F,Di Filippo S,Manzoni C.Efficiency in hemodialysis with polyethersulfone membrane(DIAPES).Contrib Nephrol,2003,(138):55-58.
9 Brandt T,Wiese F.Physical and chemical characteristics of different polyethersulfone membranes.Contrib Nephrol,2003,(138):1 -12.
10 Cheung AK,Agodoa LY,Daugirdas JT,et al.Effects of hemodialyzer reuse on clearances of urea and beta2-microglobulin.The Hemodialysis(HEMO)Study Group.J Am Soc Nephrol,1999,10(1):117-127.
11 Cheung AK,Rocco MV,Yan G,et al.Serum beta-2 microglobulin levels predict mortality in dialysis patients:results of the HEMO study.J Am Soc Nephrol,2006,17(2):546 - 555.
12 龚德华,季大玺.高通量透析器重复使用对清除低分子蛋白的影响.肾脏病与透析肾移植,2000,9(3):282-284.
13 龚德华,季大玺.透析膜的吸附特性.肾脏病与透析肾移植,1997,6(3):272-275.
14 Llach F,Yudd M.The importance of hyperphosphataemia in the severity of hyperparathyroidism and its treatment in patients with chronic renal failure.Nephrol Dial Transplant,1998,13(Suppl 3):57-61.
15 龚德华,季大玺,徐斌.高通量透析器的临床应用.肾脏病与透析肾移植杂志,2002,11(5):411 -414.
16 季大玺.血液透析并发症//黎磊石,刘志红.中国肾脏病学.北京:人民军医出版社,2008:1488-1491.
17 O'Shea SI,Sands JJ,Nudo SA,et al.Frequency of anti-heparinplatelet factor 4 antibodies in hemodialysis patients and correlation with recurrent vascular access thrombosis.Am J Hematol,2002 ,69(1):72-73.
18 Jang IK,Hursting MJ.When Heparins Promote Thrombosis:Review of heparin-inducedThrombocytopenia.Circulation,2005,111(20):2671-2683.
19 Hakim RM,Schafer AI.Hemodialysis-associated platelet activation and thrombocytopenia.Am J Med,1985,78(4):575 -580.

